The REVIEW OF RESEARCH ADVANCES IN ALGAL VOLATILE ORGANIC COMPOUNDS
-
摘要: 在水域生态系统中, 藻类释放的挥发性有机化合物(VOCs)种类众多, 主要有萜烯类、醛类、醇类、酯类、酮类、脂肪族烃、芳香族、硫化物和卤化物。这些VOCs通过不同的次生代谢途径形成, 可为多种环境因素所诱导产生。在逆境胁迫下, VOCs具有提高藻细胞抗逆性的作用。当VOCs释放到水体中后, 可为同种藻细胞传递胁迫信息, 使感受细胞做好防御准备。对于异种藻细胞, VOCs通过化感作用抑制其生长, 从而保证VOCs释放者的竞争优势。此外, VOCs还可驱避捕食者, 保护藻细胞免受伤害。未被感受者利用的VOCs经挥发进入大气层后, 会参与水域上空二次有机气溶胶的形成。通过对藻类VOCs的种类、形成途径、诱导释放因素及其生态作用进行综述, 以期对藻类VOCs的研究有所帮助。Abstract: In aquatic ecosystem, abundance of various volatile organic compounds (VOCs) are released from algae, including terpenoids, aldehydes, alcohols, esters, aliphatic hydrocarbons, aromatic series, sulfides and halogenides. These VOCs are synthesized from different secondary metabolism pathways, which can be induced by lots of environmental factors. Under environmental stresses, VOCs play an important role in improving algal resistance. When VOCs are released to water bodies, they transfer stress information to the congener algal cells, and the acceptors can prepare to defense the coming stress. For heterogeneous algal cells, VOCs can inhibit their growth via allelopathic effects and keep emitter's competitive advantages. Meanwhile, VOCs can also repel predators to protect algal cells. The VOCs which can not be captured by acceptors volatilize into the atmosphere and take part in the formation of secondary organic aerosols over the waters. To aid in helping the study of algal VOCs, this research review summarizes the types, forming pathways, inducing factors and ecological functions of algal VOCs.
-
Keywords:
- Volatile organic compounds /
- Forming pathway /
- Inducing factor /
- Ecological function
-
游泳运动是鱼类逃逸、捕食、繁殖等活动行为的重要实现方式, 为其生存生长及种群繁衍提供了基本保证。依据对氧气的需求, 鱼类游泳运动分为有氧运动和无氧运动2种类型, 前者反映有氧代谢能力, 与日常活动(如巡游、自发运动)和洄游等有关, 常以临界游泳速度(Ucrit)[1, 2]或步法转换速度(Ugt)评价[2], 而后者则反映无氧代谢能力, 与捕食活动、逃逸敌害、穿越激流等相关, 常用匀加速游泳速度(Ucat)或爆发游泳速度评估[3]; 鱼类的有氧和无氧运动能力可能存在权衡[3—5]。自Ucat用于衡量鱼类无氧运动能力起, 不同研究采用加速度均是0.167 cm/s2 [即10 (cm/s)/min][3—8]。采用单一加速度考察不同鱼类Ucat的方式可能具有局限性, 因为不同鱼类的生物学特征(如发育阶段、体重大小、游泳能力及性别等)差异较大, 将影响游泳能力的测定结果。因此, 不同加速度与鱼类Ucat关系的相关研究十分迫切。
鱼类表型存在种内个体变异并且在不同环境条件下维持稳定, 具有重要进化生物学和生态学意义[9]。鱼类处于静止状态、无食物消化吸收时的最低能量消耗称作为静止代谢率(Resting metabolic rate, RMR), 代表了机体基本功能的维持水平和有氧代谢能力的下限, RMR与标准代谢率(Standard metabolic rate, SMR)有相近的内涵, 本研究统一使用RMR; 高强度有氧运动对鱼类施加巨大的生理负荷, 使其对氧的需求达到最大, 表现出最大代谢率(Maximum metabolic rate, MMR), 代表了机体有氧代谢能力的上限, 二者的差值为鱼类的有氧代谢空间(Aerobic scope, AS=MMR–RMR), 它表示为其他生理功能提供的最大代谢潜能[10]。鱼类MMR和AS的测量方法通常包括两种, 一种是Ucrit法[11—14], 别一种则是人为诱导运动力竭的过量耗氧(Excess post-exercise oxygen consumption, EPOC)法[11, 15, 16]。2种方法的本质都是通过高强度游泳运动对机体施加最大生理负荷, 诱导机体产生最强有氧代谢水平。然而, 由于实验方法的操作性及其相应的生态学意义不尽相同, 比较不同研究结果时可能面临一定的方法学局限性, 有关鱼类有氧代谢能力特征诱导方法的比较研究十分匮乏[11]。
鲫(Carassius auratus Linnaeus)是我国常见的鲤科鱼类, 广泛分布于江河湖泊、池塘沼泽等水域中。为考察鲤科鱼类运动能力的个体变异和表型特征的生态关联, 以及不同加速度对匀加速能力测定的影响, 本研究以鲫幼鱼为实验对象, 通过2种方法分别测定该种鱼的有氧代谢参数(RMR、MMR、AS及FAS)和有氧运动能力(Ucrit), 同时也测量在不同加速度(0.083、0.167、0.250、0.333 cm/s2)条件下鲫幼鱼的Ucat, 在Ucrit和Ucat测定过程中分别录像以分析获取相应的Ugt, 分析比较鲫幼鱼的有氧和无氧运动能力特征及表型关联, 比较匀加速游泳能力在不同加速度条件下的响应特征, 为鱼类匀加速游泳能力测定加速度的合理选择提供有益参考, 同时也为我国过渔设施(如鱼道)工程的设计开发提供重要的运动生理学资料。
1. 材料与方法
1.1 实验鱼及其驯化
鲫幼鱼购自于重庆市北碚区歇马人工养殖基地, 运回后将鱼放置于3个实验室循环控温水槽(约250 L)中驯化3周。驯化期间, 每天以商业饲料(中国通威公司)饱足投喂1次, 投喂0.5h后用虹吸法清除残饵和粪便以维持水体环境。驯化水槽的日换水量约为水体的10%, 实验用水为曝气后控温的自来水, 用充气泵不断向驯化水槽充气使溶氧水平大于7 mg/L, 驯化水温为(25.0±0.5)℃(与当时季节水温相近), 光周期为光照14 L﹕10 D。
1.2 实验设计
在驯化结束后, 挑选鱼体健康、体重相近的鲫幼鱼[n=30, 体重(13.08±0.41) g, 体长(7.52±0.08) cm]作为实验对象, 并将实验鱼移入已编号的30个养殖单元格中以便辨别实验鱼。实验之前, 对鱼禁食24h。在第1天先测量实验鱼的RMR, 随后采用游泳代谢仪测定鱼的Ucrit、Ugt和MMR并计算获取AS, 测定完毕后将鱼放回至养殖单元格中并投喂一次约0.5%体重的饵料[17], 以维持实验鱼的体重和生理恢复; 第3天测定EPOC法诱导鲫幼鱼的MMR并在运动力竭后连续测定鱼的恢复代谢率, 共计算10min的过量耗氧(EPOC), 在测定完毕后将鱼放回至养殖单元格中并投喂一次约0.5%体重的饵料; 从第5天开始随后的连续4d中, 于每天上午只测定一个加速度条件下实验鱼的Ucat和Ugt, 本研究设定的加速度包括0.083、0.167、0.250、0.333 cm/s2, 每天测定完毕后对单尾鱼投喂一次约0.5%体重的饵料。对于单尾鱼而言, 在Ucrit和EPOC测定时均有48h机体恢复时间, 在不同加速度条件下测量Ucat的恢复时间也达24h, 并在每次饵料投喂过程中所有实验鱼全部表现快速摄食, 但由于体重控制要求仅对每尾鱼投喂约0.5%体重的饵料。根据研究报道, 在运动力竭1h后鱼类白肌的三磷酸腺苷和磷酸肌酸恢复到运动前水平[17], 力竭运动后8h后机体的乳酸水平也恢复运动前水平[18]。本研究实验参数测定时间的间隔明显长于上述重要能量物质恢复和产物清除时间, 不影响鲫幼鱼游泳能力的测定。实验期间所有环境条件(如温度、溶氧、光周期等)与驯化期间保持一致。
1.3 RMR的测定
本研究采用流水式呼吸代谢仪测定实验鱼的RMR。将鱼从养殖单元格转移至呼吸代谢仪的呼吸室驯化24h, 以消除转移过程带来的影响。驯化结束后, 采用溶氧仪(HQ30d, 美国哈希公司)在第2 天的9:00、11:00、13:00、15:00、17:00、19:00和21:00测定实验鱼的耗氧率。呼吸代谢仪的环境条件(如水温、溶氧和光周期等)与驯化期间保持一致; 测定过程中实验室保持安静, 以减少声音对实验鱼生理状态造成影响。将7个时间点的耗氧率取平均值用来表征实验鱼的RMR [mg O2/(kg·h)], 计算公式如下:
${\rm{RMR}} = \Delta {{\rm{O}}_2} \times v/m$


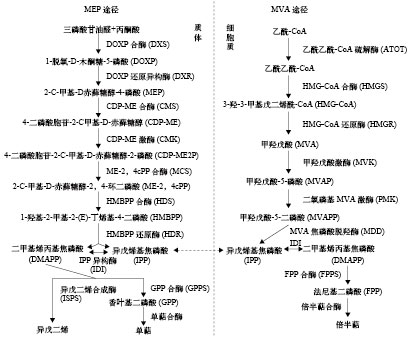
式中, ΔO2是实验呼吸室(有鱼)出水口与空白呼吸室(无鱼)出水口的溶氧差值(mg O2/L), v是呼吸室流速(L/h), 由呼吸室出水口装满50 mL容量瓶所需时间计算获得, m为实验鱼的体重(kg)。由于实验鱼的体重十分相近, 无需进行代谢率的体重校正。
1.4 Ucrit和MMR的测定
(1) Ucrit测定法: 采用鱼类游泳代谢仪同时测定实验鱼的运动代谢率和Ucrit, 同时通过摄像系统拍摄实验鱼的游泳行为。先将实验鱼装入游泳代谢仪的游泳管中驯化1h, 驯化流速为6 cm/s; 随后每隔20min增加6 cm/s, 直至实验鱼运动力竭。力竭标准: 实验鱼因运动力竭不能抵抗水流而后退停靠于游泳管的尾端筛板, 并且在尾端筛板的停靠时间达20s以上[19]。Ucrit(cm/s)的计算公式如下:
${U_{{\rm{crit}}}} = V + \left( {t/\Delta T} \right) \times \Delta V$


式中, V是实验鱼能够完成20min游泳运动的最大流速, ΔV是流速增量(6 cm/s), ΔT是时间间隔(20min), t是在最高流水速度下实验鱼的游泳历时(持续时间短于20min)。
在测定Ucrit过程中, 同时测量实验鱼的运动代谢率。游泳代谢仪装有1个连接溶氧仪外部水循环系统(流量约为500 mL/min), 当溶氧仪探头连接该系统时游泳代谢仪形成封闭状态, 可监测游泳代谢仪内部水体溶氧水平。每隔20min, 打开游泳仪谢仪尾盖20s随后关闭, 该时间足以保证代谢仪内部与外部之间水体的充分置换, 溶氧水平可迅速恢复至正常状态。通过设定好的电脑程序控制目标流速, 用溶氧仪每隔2min测定一次游泳代谢仪内部水体的溶氧水平(mg/L), 连续测定10次。实验鱼的运动代谢率[MO2, mg O2/(kg·h)]的计算公式如下:
$M{{\rm{O}}_2} = \left( {{S_{\rm{t}}} - {S_{\rm{b}}}} \right) \times 60 \times V/m$


This page contains the following errors:
error on line 1 at column 1: Start tag expected, '<' not foundBelow is a rendering of the page up to the first error.
在Ucrit测定过程中, 在游泳管正上方安置一台高清摄像机, 录像单尾鱼Ucrit游泳行为。随流速的逐渐增加, 由于鱼类开始动用白肌(无氧代谢)提供游泳动力而打破体内乳酸平衡, 使得体内的乳酸积累一定程度时, 鱼类开始出现“爆发–滑行”的游泳行为变化并且摆尾频率变化明显, 该游泳行为被称为步法转换, 首次出现“爆发–滑行”游泳行为时的游泳速度称作为步法转换速度(Ugt), 评价最大有氧运动能力[2, 20]。虽然Ucrit测定过程中涉及到无氧代谢且饱受争议, 但现有研究仍采用Ucrit或Ugt评价鱼类的有氧运动能力[2]。
(2) EPOC测定法: 通过力竭运动诱导实验鱼的MMREPOC [mg O2/(kg·h)]并计算代谢空间(ASEPOC=MMREPOC–RMR)。EPOC的简要步骤[15]: 将鱼从养殖单元格中转移至力竭运动驱赶装置(Φ外=56 cm, Φ内=33 cm, 水深15 cm)的环行水道(流速~60 cm/s)中; 在环形水道中实验鱼逆流快速游泳, 一段时间后鱼体因高流速无法保持相对稳定游泳而后退, 此时人工连续驱赶实验鱼向前游泳直至其运动力竭; 处于力竭状态的鱼通常失去平衡且用手接触尾部时不再有明显应激反应, 整个过程一般在5min之内完成[21]; 然后将鱼迅速(10s之内完成)转移至呼吸代谢仪的呼吸室中进行30min的恢复代谢测定。溶氧数据采集时间分别为0、1、2、3、4、5、6、7、8、9、10、15、20、25、30min。在恢复代谢测定过程中, 呼吸室流速约为500 mL/min。经计算, 在此流速条件下呼吸室水体置换率达99%的历时小于1min[22]。因此, 将随后数分钟出现的最大耗氧率作为实验鱼的MMR, 其计算公式与RMR一样。鱼类的EPOC是指其在运动恢复期内超过静止状态耗氧水平的额外耗氧量, 在一定程度上反映了鱼类的最大无氧代谢能力, 计算恢复期内高于运动前的差值在时间上的总和即为该时期的EPOC[15]。为便于比较不同鲫个体的代谢恢复特征, 本研究仅选取前10min的EPOC用于数据分析。
1.5 Ucat的测定
本研究共采用了4个加速度(0.083、0.167、0.250、0.333 cm/s2), 每天只测定1个加速度下实验鱼的Ucat。将鱼放入游泳代谢仪的游泳管中驯化1h, 管内流速为6.0 cm/s。驯化结束后, 流速从6.0 cm/s开始按照某一加速度(每秒种递增)逐渐增加游泳代谢仪的流速, 直至实验鱼运动力竭, 该力竭状态被认为是鱼类的最大匀加速游泳能力, 此时对应的流速即为实验鱼的Ucat。游泳代谢仪的流速控制由电脑软件完成, 可即时观察游泳管中即时流速及其变化特征。在测定过程中, 在游泳管正上方安装一台高清摄像机, 录像单尾鱼整个的匀加速游泳过程。对获取的视频资料分析确定实验鱼首次“爆发–滑行”游泳行为的出现时间并结合摆尾频率的变化特征, 以确定在Ucat测定过程中实验鱼的Ugt。
1.6 数据处理与统计分析
采用Excel (2003)软件对所有实验数据作常规计算, 统计软件为SPSS (19.0)软件。实验数据均以“平均值±标准误”(Means±SE)表示, 显著水平为P<0.05。Ucrit测定中的能量代谢参数与游泳能力的关系及Ucat与无氧代谢(Ucat–Ugt)的关系均采用一般线性回归方程。两种方法诱导MMR和AS的比较采用T-检验, 能量代谢参数之间的相关性采用Pearson相关分析。采用单因素方差分析考察不同加速度对游泳能力参数的影响, 若组间存在显著差异则采用最小显著性差异法(Least significant difference, LSD)检验组间数据差异。采用组内相关系数(Intraclass correlation coefficient, ICC)和肯德尔和谐系数(Kendall concordance coefficient, KCC)考察匀加速游泳能力参数在不同加速度条件下的重复性。
2. 结果
2.1 Ucrit中能量代谢与游泳速度的关系
在Ucrit法中鲫幼鱼的MMR和AS均与Ucrit呈正相关, 但RMR与Ucrit不相关(图 1A)。此外, 鲫幼鱼的能量代谢参数(MMR、AS、RMR)与Ugt不相关(图 1B, 所有P>0.05)。
![]() 图 1 鲫幼鱼能量代谢与游泳速度的关系MMR=最大代谢率; AS=代谢空间; RMR=静止代谢率; 游泳速度与代谢率的回归方程如下: MMR=10.678×Ucrit+219.677, R2=0.445, P<0.001; AS=10.898×Ucrit+3.823, R2=0.443, P<0.001Figure 1. The relationships between metabolic rates and swimming velocity in juvenile crucian carpMMR=maximum metabolic rate; AS=aerobic scope; RMR=resting metabolic rate. Regressions equations between swimming velocities and metabolic rates as follows: MMR=10.678×Ucrit+219.677, R2=0.445, P<0.001; AS=10.898×Ucrit+3.823, R2=0.443, P<0.001
图 1 鲫幼鱼能量代谢与游泳速度的关系MMR=最大代谢率; AS=代谢空间; RMR=静止代谢率; 游泳速度与代谢率的回归方程如下: MMR=10.678×Ucrit+219.677, R2=0.445, P<0.001; AS=10.898×Ucrit+3.823, R2=0.443, P<0.001Figure 1. The relationships between metabolic rates and swimming velocity in juvenile crucian carpMMR=maximum metabolic rate; AS=aerobic scope; RMR=resting metabolic rate. Regressions equations between swimming velocities and metabolic rates as follows: MMR=10.678×Ucrit+219.677, R2=0.445, P<0.001; AS=10.898×Ucrit+3.823, R2=0.443, P<0.0012.2 两种方法中鲫幼鱼能量代谢参数的比较及相关性
本研究采用了2种常规诱导鱼类最大代谢率的方法, 分别为Ucrit法和EPOC法。结果发现, 两种方法获取鲫幼鱼的MMR和AS均无显著性差异(图 2A, MMR: T=0.200, P=0.843; AS: T=0.220, P=0.827); 同样, 2种方法获得的FAS (Ucrit法: 4.84±0.38; EPOC法: 4.98±0.36)也无明显差异(T=0.593, P=0.558)。虽然2种方法获得能量代谢参数的平均值无差异, 但2种方法的能量代谢参数(MMR、AS和FAS)仍保持较高的重复性(图 2B, MMR: r=0.434, P=0.017; 图 2C, AS: r=0.493, P=0.006; 图 2D, FAS: r=0.808, P<0.001)。
![]() 图 2 两种运动方式诱导鲫幼鱼有氧代谢能力的比较及相关性MMR=最大代谢率; AS=代谢空间; Ucrit=临界游泳速度; EPOC=运动后过量耗氧; FAS=相对代谢空间Figure 2. The comparison and relationship in aerobic capacities induced by two methods in juvenile crucian carpMMR=Maximum metabolic rate; AS =Aerobic scope; Ucrit=Critical swimming speed; EPOC=Excess post-exercise oxygen consumption; FAS=Factorial aerobic scope
图 2 两种运动方式诱导鲫幼鱼有氧代谢能力的比较及相关性MMR=最大代谢率; AS=代谢空间; Ucrit=临界游泳速度; EPOC=运动后过量耗氧; FAS=相对代谢空间Figure 2. The comparison and relationship in aerobic capacities induced by two methods in juvenile crucian carpMMR=Maximum metabolic rate; AS =Aerobic scope; Ucrit=Critical swimming speed; EPOC=Excess post-exercise oxygen consumption; FAS=Factorial aerobic scope在Ucrit法中, 鲫幼鱼的RMR与MMR及AS均不相关, 但与FAS呈负相关; MMR与AS及FAS呈正相关, AS与FAS也呈正相关(表 1)。在EPOC法中, 鲫幼鱼的RMR与MMR不相关, 但与AS、FAS、EPOC均呈负相关, MMR与AS、FAS、EPOC均呈正相关(表 1)。AS、FAS、EPOC三者之间呈正相关(表 1)。
表 1 两种方法中鲫幼鱼能量代谢参数之间的相关性Table 1. Correlations among parameters of metabolic rate induced by two exercised methods in juvenile crucian carp测定方法Method 实验参数Parameter 相关性Correlation Ucrit测定法 最大代谢率MMR 代谢空间AS 相对代谢空间FAS 静止代谢率RMR r=0.043 P=0.820 r= –0.197 P=0.298 r= –0.630** P<0.001 最大代谢率MMR r=0.971** P<0.001 r=0.711** P<0.001 代谢空间AS r=0.850** P<0.001 EPOC测定法 最大代谢率MMR 代谢空间AS 相对代谢空间FAS 过量耗氧EPOC 静止代谢率RMR r= –0.326 P=0.079 r= –0.581** P=0.001 r= –0.800** P<0.001 r= –0.470** P=0.009 最大代谢率MMR r=0.959** P<0.001 r=0.775** P<0.001 r=0.544** P=0.002 代谢空间AS r=0.908** P<0.001 r=0.610** P<0.001 相对代谢空间FAS r=0. 519** P=0.003 注: RMR=静止代谢率; MMR=最大代谢率; AS=代谢空间; Ucrit=临界游泳速度; EPOC=运动后过量耗氧; FAS=相对代谢空间。*表示P<0.05, **表示P<0.01 Note: RMR=Resting metabolic rate; MMR=Maximum metabolic rate; AS =Aerobic scope; Ucrit=Critical swimming speed; EPOC=Excess post-exercise oxygen consumption; FAS=Factorial aerobic scope. * means P<0.05 and ** meansP<0.01 2.3 鲫幼鱼的有氧和无氧运动能力
鲫幼鱼的Ucrit低于不同加速度条件下的Ucat, 但加速度对Ucat测定无显著影响(图 3A, F=9.333, P<0.001)。然而, 随加速度的增加,Ugt呈现先增加后下降的变化规律(图 3B, F=87.386, P<0.001)。与Ugt类似, 运动能力比例(Ugt/Ucrit或Ugt/Ucat)也呈现先递增后降低的变化趋势(图 3C, F=58.797, P<0.001)。
不论是Ucrit法还是Ucat法, 鲫幼鱼在两方法中的Ugt均与Ucrit或Ucat呈现正相关, 并且在不同加速度条件下Ugt与Ucat呈现的正相关方向保持不变(表 2)。此外, 鲫幼鱼的匀加速游泳能力参数[Ucat, Ugt, Ugt/Ucat, Ucat–Ugt, (Ucat–Ugt)/Ucat]在不同加速度条件下均保持较高的重复性(表 3)。
表 2 鲫幼鱼最大游泳能力与步法转换速度的回归方程Table 2. Regressions (±SE) of gait transition speed (x) as a function of swimming velocity (y, Ucrit or Ucat), y=a x+b测定方法Method 加速度
Accelerate rate (cm/s2)a b R2 P Ucrit法 / 0.198±0.080 16.380±5.250 0.177 0.021* Ucat法 0.083 0.367±0.062 11.244±5.120 0.552 <0.001** 0.167 0.514±0.141 22.784±11.637 0.335 0.001** 0.250 0.489±0.181 22.925±15.336 0.212 0.011* 0.333 0.773±0.120 –3.907±9.835 0.608 <0.001** 注: Ucrit=临界游泳速度, Ucat=匀加速游泳速度. *表示P<0.05, **表示P<0.01 Note: Ucrit=critical swimming speed, Ucat=Accelerated swimming speed. * denotes P<0.05, ** denotesP<0.01 表 3 鲫幼鱼匀加速游泳能力参数的重复性Table 3. Repeatability of parameters of acceleration swimming performance in juvenile crucian carp实验参数Parameters 组内相关系数Intraclass correlation coefficient (ICC) 肯德尔和谐系数Kendall concordance coefficient (KCC) Ucat ICC=0.790 P<0.001 KCC=0.028 P = 0.472 Ugt ICC=0.573 P=0.002 KCC=0.476 P <0.001 Ugt/Ucat ICC=0.627 P<0.001 KCC=0.577 P <0.001 Ucat–Ugt ICC=0.626 P<0.001 KCC=0.546 P <0.001 ( Ucat–
Ugt)/UcatICC=0.629 P<0.001 KCC=0.591 P <0.001 从加速度0.083 cm/s2逐渐增加至0.250 cm/s2, 鲫幼鱼Ucat的无氧代谢能力(Ucat–Ugt)与Ucat之间均呈现正相关(图 4A-C, 所有P<0.01), 而在加速度0.333 cm/s2下二者不相关(图 4D, r=0.342, P=0.069)。在匀加速能力测定中, 鲫幼鱼的有氧代谢能力(Ugt)与无氧代谢能力(Ucat–Ugt)呈负相关, 即二者存在权衡(图 5, r= –0.607, P<0.001)。
3. 讨论
3.1 鲫幼鱼有氧运动能力与能量代谢的关系
随着游泳速度逐渐增加至Ucrit时, 鱼类呼吸循环系统的生理功能处于最大负荷状态, 表现出最大有氧代谢水平, 常用来评价鱼类的有氧运动能力[23]。本研究发现, 鲫幼鱼的运动代谢率随游泳速度的增加而呈指数性上升, 并且其MMR和AS与Ucrit均呈现正相关, 即有氧代谢能力越强的个体可以支撑更强水平的有氧运动, 反之亦然。这种现象不仅存在于鲤科鱼类的种间水平[13], 而且也发现于鲤科鱼类的种内水平[7, 24]。本研究还发现鲫幼鱼的RMR与Ucrit不相关, 这与鲤(Cyprinus carpio Linnaeus)[7]和青鱼(Mylopharyngodon piceusRichardson)[24]的正相关报道并不一致。在Ucrit测定过程中, 鲫幼鱼的Ucrit与Ugt呈正相关, 但Ugt与该种鱼的MMR、AS及RMR均不相关, 这可能是因为鲫幼鱼首次出现“爆发–滑行”游泳行为时(Ugt)的有氧代谢水平低于Ucrit时的MMR, 并且这两个代谢水平间的差距因个体而异, 具有明显个体变异; 另一方面由于游泳速度与有氧代谢之间的拟合方程指数不尽相同, 即相同游泳速度的增加, 指数越大的鲫个体其有氧代谢上升更为明显[11, 19]。
本研究采用了Ucrit法和EPOC法诱导鲫幼鱼的MMR和AS, 发现Ucrit法中MMR和AS的平均值与EPOC法的十分相近且无明显差异。然而, 这只是在组间水平的平均值差异检验, 还可以在组内个体水平上对两种方法进行比较。为此, 本研究将Ucrit法的能量代谢参数(MMR、AS和FAS)分别与EPOC法的进行重复性分析。结果发现, 3个能量代谢参数在两种方法之间保持较高的重复性, 即个体的生理表型保持较强的可重复测量水平并且在种群中的表型排序维持稳定, 表明在排除环境因素(如水温、体重和溶氧)后, 不论Ucrit法和EPOC法诱导鱼类的最大有氧代谢能力均可采用并进行比较。值得注意的是, 不论Ucrit法还是EPOC法均是排除实验鱼消化道中食物消化吸收的影响, 但先前研究发现鱼类最大代谢率的诱导与其代谢模式有关, 食物的消化吸收和游泳运动同时进行的方式可诱导某些鱼类(如鲤)的最大代谢率[23], 这种由2种生理活动叠加诱导的最大代谢率明显大于单一生理活动(运动或消化)的诱导值。因此, 在方法采用时还需要考虑实验鱼的代谢模式类型。
3.2 鲫幼鱼RMR与MMR或AS的关系
RMR是鱼类机体的最小维持代谢水平, 而MMR或AS代表了机体的最大有氧代谢能力, 二者的关系引起研究者的广泛关注[25]。如果自然选择倾向于动物既具有较低的能量维持消耗又具有较强的最大代谢能力的表型特征组合, 那么拥有这种最佳表型组合的动物在自然界中具有极高的适合度[25], 然而这种最佳表型关联的进化结果可能是不存在的[26, 27]。根据内温动物有氧代谢能力的进化理论, 自然选择在倾向于选择个体拥有较强的最大有氧代谢能力同时也会倾向于选择较高的维持代谢, 因为具备较强功能的器官(如发达的呼吸循环系统和运动系统)的机体相应具有更多收益(即具有更高的最大代谢率), 但这些器官也具有相应的代价(即相应较高的能量消耗)[28]。因此, 维持代谢消耗与最大代谢率在理论上将呈正相关。支持该假说的鱼类实验证据已见报道, 例如鲤[7]、青鱼[24]和鳟(Salmo trutta Linnaeus)[25]的RMR与MMR呈现正相关。
对于鱼类种内RMR与MMR呈正相关而言, 在排除体重差异和发育因素外迄今还未找到与之有关器官形态学的证据, 但在生化水平上发现证据: 如鳟肝脏上两种有氧代谢关键酶的活性与RMR及MMR均呈正相关[25]。然而, 也有研究发现南方鲇(Silurus meridionalis Chen)的RMR与MMR及AS不相关[14]; 欧鲈(Dicentrarchus labrax Linnaeus)[5]、鲫[15]和鳊(Parabramis pekinensisBasilewsky)[16]的RMR与MMR不相关, 与AS呈负相关; 大西洋鲑(Salmo salar Linnaeus)的RMR与FAS呈现负相关[29], 暗示该种鱼的RMR与MMR也不相关; 上述研究表明不同鱼类的研究结果差异甚大, 但可总结为两种类型: 一是正相关, 二是不相关。本研究发现, 两种运动法中鲫幼鱼RMR与MMR均不相关, EPOC法中RMR与AS呈负相关, 符合第二种相关类型。在自然界中, 假定自然选择会使鱼类同时具有较强的有氧代谢能力和较高的代谢维持, 并且较强的有氧代谢能力有助于个体的生存、生长和繁衍[30], 理论上拥有该表型个体会获得较高的适合度。因此, 在长进化时间尺度上, 自然选择结果是该鱼类种群的有氧代谢能力表型峰值更高且表型维度变异较窄。然而, 这种理论推测并未得到野外和实验室观测数据的支持, 因为野外和实验室表型特征的个体变异仍然较大[3—5]。另一方面, 在实验室条件下可以获取鱼类的最大有氧代谢能力, 但无法确定鱼类在野外条件下最大有氧代谢能力的使用频率[31], 该功能表型受到自然选择的强度及其与生活史的关联的研究也十分困难, 这也可能是导致维持代谢与最大代谢不相关的原因之一。
3.3 鲫幼鱼的匀加速能力及加速度影响
鱼类匀加速游泳能力的评价研究最早见于2000年报道, 该研究采用的加速度为0.167 cm/s2 [10 (cm/s)/min][3], 但该研究并未对加速度的采用原因进行解释, 即加速度的影响被忽视。本研究发现在4个加速度(0.083、0.167、0.250、0.333 cm/s2)下鲫幼鱼的匀加速能力Ucat不受加速度的影响。同样, 虹鳟(Oncorhynchus mykissWalbaum)[32]和鳊幼鱼的Ucat在较大加速度范围内也保持不变[33, 34], 与本研究结果类似。前期研究发现在较小加度速下的Ucat介于Ucrit与较大加速度下Ucat之间[33, 34], 即加速度越小, Ucat值越接近于Ucrit, 本研究鲫幼鱼Ugt也具有相似变化规律, 该现象可能是因为在较小加速度条件下实验鱼在大部分时间进行有氧运动, Ucrit很大程度上反映了鱼类有氧代谢能力并且可被认为是最小匀加速的特例, 鱼类的低匀加速游泳是一种非常接近有氧运动的游泳类型, 因而低加速度下Ucat值接近Ucrit值[33]。然而, 从另一方面考虑, 如果以过大加速度考察鱼类的匀加速游泳能力, 加速度越快, 实验鱼的运动力竭时间相应越短[33], 那么过高的加速度将影响鱼类匀加速游泳能力的准确评估, 因为过快频率的流速变化可能导致实验鱼提前停止游泳而造成假的运动力竭现象。值得注意的是, Farrell研究的加速度递增时间为每分钟[32], 本研究中及实验室前期研究[33, 34]的加速度递增时间为每秒钟。以每秒钟递增的加速度的设定方式对鱼类匀游泳运动的引导作用更为积极连贯, 可更好反映鱼类的匀加速游泳能力, 同时降低了因流速的突然陡增对鱼产生的生理胁迫影响。
研究认为, 鱼类Ucat包括有氧代谢组分(Ugt)和无氧代谢组分(Ucat–Ugt), 并且2个组分间可能存在权衡, 因为前者是由红肌有氧代谢供能而后者是白肌无氧代谢供能[4, 5]。本研究发现鲫幼鱼的Ugt与Ucat–Ugt呈现负相关, 并且Ucat与Ucat–Ugt呈正关, 表明该种鱼在匀加速游泳能力过程中有氧代谢和无氧代谢之间存在权衡。大西洋鳕(Gadus morhua Linnaeus)的研究数据支持上述权衡观点[3], 但欧鲈的实验结果并不支持[4, 5]。上述权衡观点在人类运动员研究中找到了肌肉形态结构的支持证据, 即短跑运动员的腿部快肌(无氧代谢)拥有比例高于慢肌(有氧代谢), 而马拉松运动员的腿部慢肌(有氧代谢)拥有比例高于快肌(无氧代谢)[35]。同样, 大部分鱼类的肌肉组成也包括常见的红肌和白肌两种类型, 二者的解剖学结构差异明显, 是上述功能权衡的形态学基础[36]。随着游泳速度的逐渐增加, 鱼类的游泳行为特征发生相应变化, 例如: 在较高游泳速度下稳定游泳的控制程度下降, 摆尾幅度和频率增加[20]及“爆发–滑行”行为的发生频率上升[10]; 在生化角度上, 无氧代谢大量参与的证据在于鱼类体内重要器官(如肌肉、肝脏和血液)的乳酸水平明显上升, 但是在静止状态下也保持一定的乳酸水平[18, 33, 34], 代谢底物和产物含量的个体差异可能有助于解释上述权衡现象。然而, 验证上述权衡的不同研究结果出现分歧, 仍有必要结合形态学与生化水平进一步探索权衡现象背后的内在机制。
综上所述, 本研究采用2种运动方法诱导鲫幼鱼有氧代谢能力的观测值不论在组间水平还是个体水平均无方法学的差异, 并且能量代谢参数之间存在表型关联; 加速度对鲫幼鱼的Ucat测定无影响, 建议选择较高的加速度, 加速度对Ugt测定有影响, 在不同加速度条件下鲫幼鱼的匀加速游泳能力保持较高的重复性, 并且有氧代谢与无氧代谢存在权衡。
-
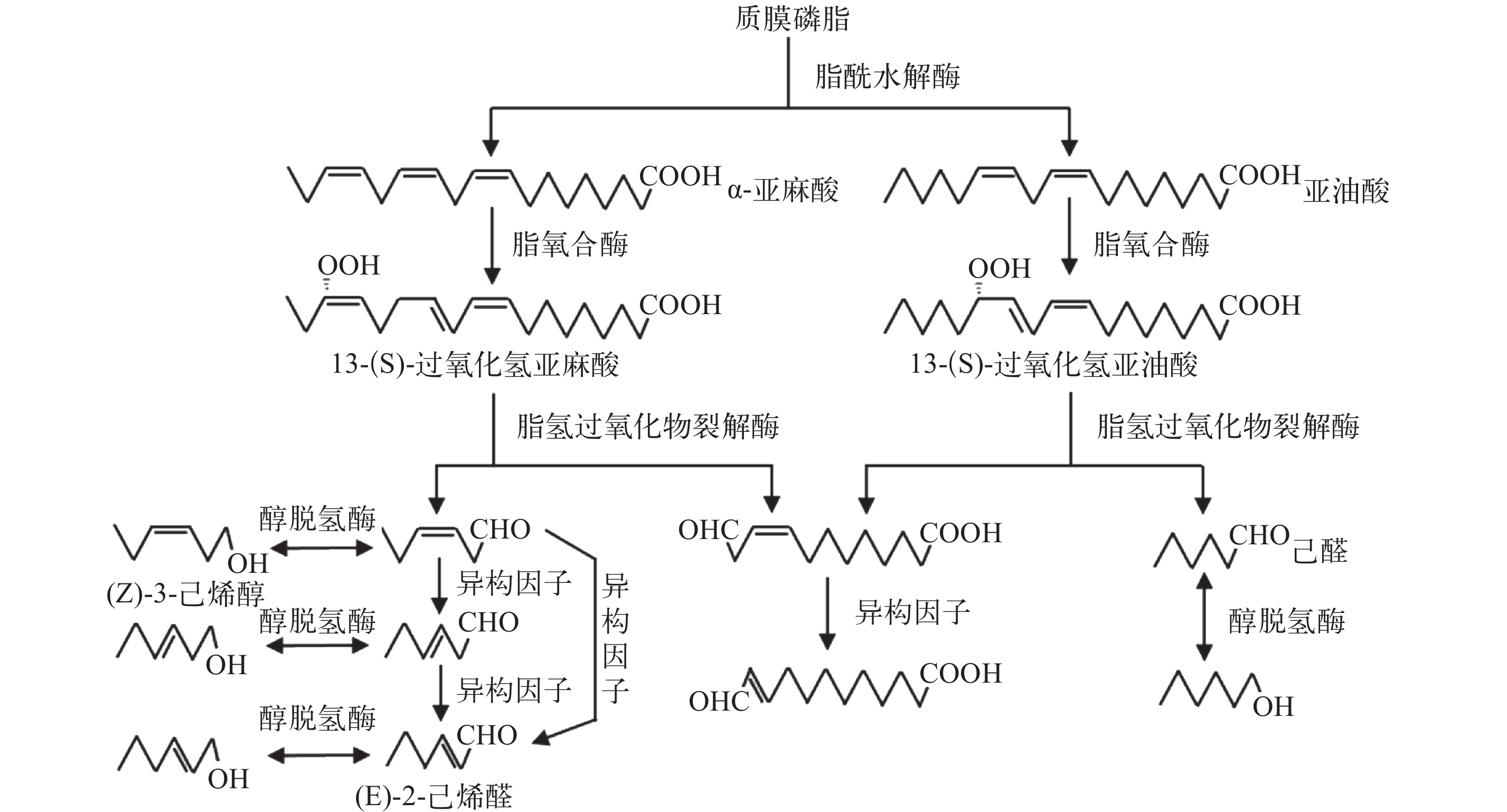
图 2 GLVs的形成途径[30]
Figure 2. The forming pathway of GLVs
-
[1] Lerdau M, Slobodkin K. Trace gas emissions and species dependent ecosystem services [J]. Trends in Ecology & Evolution, 2002, 17(7): 309—312
[2] Peñuelas J, Llusià J. Plant VOC emissions: making use of the unavoidable [J]. Trends in Ecology and Evolution, 2004, 19(8): 402—404 doi: 10.1016/j.tree.2004.06.002
[3] Baldwin I T, Halitschke R, Paschold A, et al. Volatile signaling in plant-plant interactions: " talking trees” in the genomics era [J]. Science, 2006, 311(5762): 812—815 doi: 10.1126/science.1118446
[4] Zhang R M, Zuo Z J, Gao P J, et al. Allelopathic effects of VOCs of Artemisia frigida Willd. on the regeneration of pasture grasses in Inner Mongolia [J]. Journal of Arid Environments, 2012, 87: 212—218 doi: 10.1016/j.jaridenv.2012.04.008
[5] Kladi M, Vagias C, Roussis V. Volatile halogenated metabolites from marine red algae [J]. Phytochemistry Reviews, 2004, 3(3): 337—366 doi: 10.1007/s11101-004-4155-9
[6] Fujise D, Tsuji K, Fukushima N, et al. Analytical aspects of cyanobacterial volatile organic compounds for investigation of their production behavior [J]. Journal of Chromatography A, 2010, 1217(39): 6122—6125 doi: 10.1016/j.chroma.2010.07.008
[7] Abrahamsson K, Choo K S, Pedersén M, et al. Effects of temperature on the production of hydrogen peroxide and volatile halocarbons by brackish-water algae [J]. Phytochemistry, 2003, 64(3): 725—734 doi: 10.1016/S0031-9422(03)00419-9
[8] Zuo Z J, Zhu Y R, Bai Y L, et al. Volatile communication between Chlamydomonas reinhardtii cells under salt stress [J]. Biochemical Systematics and Ecology, 2012, 40(1): 19—24
[9] Zuo Z J, Zhu Y R, Bai Y L, et al. Acetic acid-induced programmed cell death and release of volatile organic compounds in Chlamydomonas reinhardtii[J]. Plant Physiology and Biochemistry, 2012, 51(2): 175—184
[10] 甘丽平, 徐庆欢, 杨王庭, 等. NaNO3胁迫对两种微囊藻VOCs释放的影响. 水生生物学报, 2015, 39(4): 782—788 doi: 10.7541/2015.102 Gan L P, Xu Q H, Yang W T, et al. The effects of NaNO3 stress on the release of VOCs from two Microcystis [J]. Acta Hydrobiologica Sinica, 2015, 39(4): 782—788
甘丽平, 徐庆欢, 杨王庭, 等. NaNO3胁迫对两种微囊藻VOCs释放的影响. 水生生物学报, 2015, 39(4): 782—788 doi: 10.7541/2015.102[11] Vallina S M, Simó R. Strong relationship between DMS and the solar radiation dose over the global surface ocean [J]. Science, 2007, 315(5811): 506—508 doi: 10.1126/science.1133680
[12] Walsh K, Jones G J, Dunstan R H. Effect of high irradiance and iron on volatile odour compounds in the cyanobacterium Microcystis aeruginosa [J]. Phytochemi-stry, 1998, 49(5): 1227—1239 doi: 10.1016/S0031-9422(97)00943-6
[13] Huang W J, Lai C H, Cheng Y L. Evaluation of extracellular products and mutagenicity in cyanobacteria cultures separated from a eutrophic reservoir [J]. Science of the Total Environment, 2007, 377(2/3): 214—223
[14] 崔晨茜, 韩姣姣, 董丽莎, 等. 温度与海带挥发性成分量效关系的解析. 食品工业科技, 2016, 37(24): 157—162 Cui C Q, Han J J, Dong L S, et al. Effects of processing temperature on volatile compounds in Laminaria japonica [J]. Science and Technology of Food Industry, 2016, 37(24): 157—162
崔晨茜, 韩姣姣, 董丽莎, 等. 温度与海带挥发性成分量效关系的解析. 食品工业科技, 2016, 37(24): 157—162[15] 杨少玲, 于刚, 戚勃, 等. 顶空固相微萃取法分析龙须菜干品中的挥发性成分. 南方水产科学, 2016, 12(6): 115—122 Yang S L, Yu G, Qi B, et al. Analysis of volatile compounds of dried Gracilaria lemaneiformis by HS-SPME method [J]. South China Fisheries Science, 2016, 12(6): 115—122
杨少玲, 于刚, 戚勃, 等. 顶空固相微萃取法分析龙须菜干品中的挥发性成分. 南方水产科学, 2016, 12(6): 115—122[16] 胡传明, 王丹青, 王锡昌, 等. 条斑紫菜与坛紫菜挥发性风味的电子鼻分析. 广西科学, 2016, 23(2): 138—143 Hu C M, Wang D Q, Wang X C, et al. Odors analysis of Pyropia yezoensis and Pyropia haitanensis by electro-nic nose[J]. Guangxi Science, 2016, 23(2): 138—143
胡传明, 王丹青, 王锡昌, 等. 条斑紫菜与坛紫菜挥发性风味的电子鼻分析. 广西科学, 2016, 23(2): 138—143[17] Holopainen J K, Blande J D. Where do herbivore-induced plant volatiles go [J]? Frontiers in Plant Science, 2013, 4(1): 185 https://www.researchgate.net/publication/239948726_Where_do_herbivore-induced_plant_volatiles_go
[18] Palmer P I, Shaw S L. Quantifying global marine isoprene fluxes using MODIS chlorophyll observations [J]. Geophysical Research Letters, 2005, 32(9): L09805
[19] Gantt B, Meskhidze N, Kamykowski D. A new physi-cally-based quantification of marine isoprene and primary organic aerosol emissions [J]. Atmospheric Chemistry and Physics, 2009, 9(14): 4915—4927 doi: 10.5194/acp-9-4915-2009
[20] Luo G, Yu F. A numerical evaluation of global ocea-nic emissions of α-pinene and isoprene [J]. Atmospheric Chemistry and Physics, 2010, 10(4): 2007—2015 doi: 10.5194/acp-10-2007-2010
[21] Rohmer M, Knani M, Simonin P, et al. Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate [J]. Bioche-mical Journal, 1993, 295(1): 517—524
[22] Chappell J, Wolf F, Proulx J, et al. Is the reaction catalysed by 3-hydroxy-3-methylglutaryl coenzyme A reductase a rate-limiting step for isoprenoid biosynthesis in plants [J]? Plant Physiology, 1995, 109(4): 1337—1343
[23] Hsieh M H, Goodman H M. The Arabidopsis IspH homolog is involved in the plastid nonmevalonate pathway of isoprenoid biosynthesis [J]. Plant Physiology, 2005, 138(2): 641—653 doi: 10.1104/pp.104.058735
[24] Withers S T, Keasling J D. Biosynthesis and engineering of isoprenoid small molecules [J]. Applied Microbiology and Biotechnology, 2007, 73(5): 980—990
[25] Hemmerlin A, Hoeffler J-F, Meyer O, et al. Cross-talk between the cytosolic mevalonate and the plastidial methylerythritol phosphate pathways in tobacco bright yellow-2 cells [J]. The Journal of Biological Chemi-stry, 2003, 278: 26666—26676 doi: 10.1074/jbc.M302526200
[26] Soler E, Clastre M, Bantignies B, et al. Uptake of isopentenyl diphosphate by plastids isolated from Vitis vinifera L. cell suspensions [J]. Planta, 1993, 191(3): 324—329
[27] Seto H, Watanabe H, Furihata K. Simultaneous operation of the mevalonate and non-mevalonate pathways in the biosynthesis of isopentenyl diphosphate in Streptomyces aeriouvifer [J]. Tetrahedron Letters, 1996, 37(44): 7979—7982 doi: 10.1016/0040-4039(96)01787-X
[28] Jüttner F. Quantitative trace analysis of volatile orga-nic compounds [J]. Methods in Enzymology, 1988, 167: 609—616 doi: 10.1016/0076-6879(88)67070-4
[29] Jüttner F. The algal excretion product, geranylacetone: A potent inhibitor of carotene biosynthesis in Synechococcus [J]. Zeitschrift Fur Naturforschung, 1979, 34(11): 957—960
[30] Hatanaka A. The biogeneration of green odour by green leaves [J]. Phytochemistry, 1993, 34(5): 1201—1218 doi: 10.1016/0031-9422(91)80003-J
[31] Fall R, Karl T, Hansel A, et al. Volatile organic compounds emitted after leaf wounding: on-line analysis by proton-transfer-reaction mass spectrometry [J]. Jour-nal of Geophysical Research, 1999, 104(D13): 15963—15974 doi: 10.1029/1999JD900144
[32] Xu Q, Yang L, Yang W, et al. Volatile organic compounds released from Microcystis flos-aquae under nitrogen sources and their toxic effects on Chlorella vulgaris [J]. Ecotoxicology and Environmental Safety, 2017, 135: 191—200 doi: 10.1016/j.ecoenv.2016.09.027
[33] Cheesbrough T M, Kolattukudy P E. Alkane biosynthesis by decarbonylation of aldehydes catalyzed by a particulate preparation from Pisum sativum [J]. Proceedings of the National Academy of Sciences of the United States of America, 1984, 81(21): 6613—6617 doi: 10.1073/pnas.81.21.6613
[34] Schirmer A, Rude M A, Li X, et al. Microbial biosynthesis of alkanes [J]. Science, 2010, 329(5991): 559—562 doi: 10.1126/science.1187936
[35] Zhang J, Lu X, Li J J. Conversion of fatty aldehydes into alk(a/e)nes by in vitro reconstituted cyanobacterial aldehyde-deformylating oxygenase with the cognate electron transfer system [J]. Biotechnology for Biofuels, 2013, 6: 86 doi: 10.1186/1754-6834-6-86
[36] Klähn S, Baumgartner D, Pfreundt U, et al. Alkane biosynthesis genes in cyanobacteria and their transcriptional organization [J]. Frontiers in Bioengineering and Biotechnology, 2014, 2: 1—12 doi: 10.12970/2311-1755.2014.02.01.1
[37] Pichersky E, Noel J P, Dudareva N. Biosynthesis of plant volatiles: nature ’s diversity and ingenuity [J]. Science, 2006, 311(5762): 808—811 doi: 10.1126/science.1118510
[38] Vassao D G, Gang D R, Koeduka T, et al. Chavicol formation in sweet basil (Ocimum basilicum): cleavage of an esterified C9 hydroxyl group with NAD(P)H-dependent reduction [J]. Organic & Biomolecular Chemistry, 2006, 4(14): 2733—2744
[39] Rudbäck J, Bergström M A, Börje A, et al. α-Terpinene, an antioxidant in tea tree oil, autoxidizes rapidly to skin allergens on air exposure [J]. Chemical Research in Toxicology, 2012, 25(3): 713−721 doi: 10.1021/tx200486f
[40] Halkier B A, Gershenzon J. Biology and biochemistry of glucosinolates [J]. Annual Review of Plant Biology, 2006, 57: 303—333. doi: 10.1146/annurev.arplant.57.032905.105228
[41] Kettle A J, Andreae M O. Flux of dimethylsulfide from the oceans: a comparison of updated data sets and flux models [J]. Journal of Geophysical Research-Atmospheres, 2000, 105(D22): 26793—26808 doi: 10.1029/2000JD900252
[42] Kiene R P, Bates T S. Biological removal of dimethyl sulphide from sea water [J]. Nature, 1990, 345(6277): 702—705 doi: 10.1038/345702a0
[43] Curson A R J, Todd J D, Sullivan M J, et al. Catabo-lism of dimethylsulphoniopropionate: microorganisms, enzymes and genes [J]. Nature Reviews Microbiology, 2011, 9(12): 849—859 doi: 10.1038/nrmicro2653
[44] Moran M A, Reisch C R, Kiene R P, et al. Genomic insights into bacterial DMSP transformations [J]. Annual Review of Marine Science, 2012, 4: 523—542 doi: 10.1146/annurev-marine-120710-100827
[45] Yost D M, Mitchelmore C L. Dimethylsulfoniopropio-nate (DMSP) lyase activity in different strains of the symbiotic alga Symbiodinium microadriaticum [J]. Marine Ecology Progress Series, 2009, 386: 61—70 doi: 10.3354/meps08031
[46] Franklin D J, Steinke M, Young J, et al. Dimethylsulphoniopropionate (DMSP), DMSP-lyase activity (DLA) and dimethylsulphide (DMS) in 10 species of coccolithophore [J]. Marine Ecology Progress Series, 2010, 410: 13—23 doi: 10.3354/meps08596
[47] de Souza M P, Chen Y P, Yoch D C. Dimethylsulfo-niopropionate lyase from the marine macroalga Ulva curvata: purification and characterization of the enzyme [J]. Planta, 1996, 199(3): 433—438 doi: 10.1007/BF00195736
[48] Lu X, Fan C, He W, et al. Sulfur-containing amino acid methionine as the precursor of volatile organic sulfur compounds in algae-induced black bloom [J]. Journal of Environmental Sciences, 2013, 25(1): 33—43 doi: 10.1016/S1001-0742(12)60019-9
[49] Ohsawa N, Ogata Y, Okada N, et al. Physiological function of bromoperoxidase in the red marine alga, Corallina pilulifera production of bromoform as an allelochemical and the simultaneous elimination of hydrogen peroxide [J]. Phytochemistry, 2001, 58(5): 683—692 doi: 10.1016/S0031-9422(01)00259-X
[50] Winter J M, Moore B S. Exploring the chemistry and biology of vanadium-dependent haloperoxidases [J]. The Journal of Biological Chemistry, 2009, 284: 18577—18581 doi: 10.1074/jbc.R109.001602
[51] Moore R M, Webb M, Tokarczyk R, et al. Bromoperoxidase and iodoperoxidase enzymes and production of halogenated methanes in marine diatom cultures [J]. Journal of Geophysical Research, 1996, 101(C9): 20899—20908 doi: 10.1029/96JC01248
[52] Shaw S L, Chisholm S W, Prinn R. Isoprene production by Prochlorococcus, a marine cyanobacterium, and other phytoplankton [J]. Marine Chemistry, 2003, 80(4): 227—245 doi: 10.1016/S0304-4203(02)00101-9
[53] Bonsang B, Gros V, Peeken I, et al. Isoprene emission from phytoplankton monocultures: the relationship with chlorophyll-a, cell volume and carbon content [J]. Environmental Chemistry, 2010, 7(6): 554—563 doi: 10.1071/EN09156
[54] Meskhidze N, Sabolis A, Reed R, et al. Quantifying environmental stress-induced emissions of algal isoprene and monoterpenes using laboratory measurements [J]. Biogeosciences, 2015, 12(3): 637—651 doi: 10.5194/bg-12-637-2015
[55] Fall R, Wildermuth M C. Isoprene synthase: from biochemical mechanism to emission algorithm [J]. Jour-nal of Geophysical Research, 1998, 103(D19): 25599—25609 doi: 10.1029/98JD00808
[56] Abrahamsson K, Ekdahl A, Collén J, et al. Marine algae—a source of trichloroethylene and perchloroethy-lene [J]. Limnology and Oceanography, 1995, 40(7): 1321—1326 doi: 10.4319/lo.1995.40.7.1321
[57] Ekdahl A, Pedersén M, Abrahamsson K. A study of the diurnal variation of biogenic volatile halocarbons [J]. Marine Chemistry, 1998, 63(1-2): 1—8
[58] Bondu S, Cocquempot B, Deslandes E, et al. Effects of salt and light stress on the release of volatile haloge-nated organic compounds by Solieria chordalis: a labo-ratory incubation study [J]. Botanica Marina, 2008, 51(6): 485—492
[59] Hughes C, Sun S. Light and brominating activity in two species of marine diatom [J]. Marine Chemistry, 2016, 181: 1—9 doi: 10.1016/j.marchem.2016.02.003
[60] Milne A, Davey M S, Worsford P S, et al. Real-time detection of reactive oxygen species generation by marine phytoplankton using flow injection-chemiluminescence [J]. Limnology and Oceanography: Me-thods, 2009, 7(10): 706—715 doi: 10.4319/lom.2009.7.706
[61] Wever R, van der Horst M A. The role of vanadium haloperoxidases in the formation of volatile bromi-nated compounds and their impact on the environment [J]. Dalton Transactions, 2013, 42(33): 11778—11786 doi: 10.1039/c3dt50525a
[62] van Rijssel M, Gieskes W W C. Temperature, light, and the dimethylsulfoniopropionate (DMSP) content of Emiliania huxleyi (Prymnesiophyceae) [J]. Journal of Sea Research, 2002, 48(1): 17—27 doi: 10.1016/S1385-1101(02)00134-X
[63] Pasqua G, Monacelli B, Manfredini C, et al. The role of isoprenoid accumulation and oxidation in sealing wounded needles of Mediterranean pines [J]. Plant Science, 2002, 163(2): 355—359 doi: 10.1016/S0168-9452(02)00139-5
[64] Loreto F, Pinelli P, Manes F, et al. Impact of ozone on monoterpene emissions and evidence for an isoprene-like antioxidant action of monoterpenes emitted by Quercus ilex leaves [J]. Tree Physiology, 2004, 24(4): 361—367 doi: 10.1093/treephys/24.4.361
[65] Loreto F, Schnitzler J P. Abiotic stresses and induced BVOCs [J]. Trends in Plant Science, 2009, 15(3): 154—166
[66] García-Plazaola J I, Portillo-Estrada M, Fernández-Marín B, et al. Emissions of carotenoid cleavage products upon heat shock and mechanical wounding from a foliose lichen [J]. Environmental and Experimental Botany, 2017, 133: 87—97 doi: 10.1016/j.envexpbot.2016.10.004
[67] Rabalais N N. Nitrogen in aquatic ecosystems [J]. A Journal of the Human Environment, 2002, 31(2): 102—112 doi: 10.1579/0044-7447-31.2.102
[68] Glibert P M, Heil C A, Hollander D, et al. Evidence for dissolved organic nitrogen and phosphorus uptake during a cyanobacterial bloom in Florida Bay [J]. Marine Ecology Progress Series, 2004, 280: 73—83 doi: 10.3354/meps280073
[69] Dai R, Liu H, Qu J, et al. Effects of amino acids on microcystin production of the Microcystis aeruginosa [J]. Journal of Hazardous Materials, 2009, 161(2-3): 730—736 doi: 10.1016/j.jhazmat.2008.04.015
[70] Hasegawa M, Nishizawa A, Tsuji K, et al. Volatile organic compounds derived from 2-keto-acid decarboxylase in Microcystis aeruginosa [J]. Microbes and Environments, 2012, 27(4): 525—528 doi: 10.1264/jsme2.ME12099
[71] Nishikawa K, Machida H, Yamakoshi Y, et al. Polyphosphate metabolism in an acidophilic alga Chlamydomonas acidophila KT-1 (Chlorophyta) under phosphate stress [J]. Plant Science, 2006, 170(2): 307—313 doi: 10.1016/j.plantsci.2005.08.025
[72] von Elert E, Jüttner F. Phosphorus limitation and not light controls the extracellular release of allelopathic compounds by Trichormus doliolum (Cyanobacteria) [J]. Limnology and Oceanography, 1997, 42(8): 1796—1802 doi: 10.4319/lo.1997.42.8.1796
[73] Laturnus F, Giese B, Wiencke C, et al. Low molecular-weight organoiodine and organobromine compounds released by polar macroalgae-the influence of abiotic factors [J]. Fresenius Journal of Analytical Chemistry, 2000, 368: 297—302 doi: 10.1007/s002160000491
[74] Collen J, Ekdahl A, Abrahamsson K, et al. The involvement of hydrogen peroxide in the production of volatile halogenated compounds by Meristiella gelidium [J]. Phytochemistry, 1994, 36(5): 1197—1202 doi: 10.1016/S0031-9422(00)89637-5
[75] Vickers C E, Possell M, Cojocariu C I, et al. Isoprene synthesis protects transgenic tobacco plants from oxidative stress [J]. Plant Cell and Environment, 2009, 32(5): 520—531 doi: 10.1111/pce.2009.32.issue-5
[76] Velikova V, Várkonyi Z, Szabó M, et al. Increased thermos stability of thylakoid membranes in isoprene-emitting leaves probed with three biophysical techniques [J]. Plant Physiology, 2011, 157(2): 905—916 doi: 10.1104/pp.111.182519
[77] Zuo Z, Chen Z, Shi M, et al. Reactive oxygen species contribute to the release of volatile organic compounds from Chlamydomonas reinhardtii during programmed cell death [J]. Phycological Research, 2015, 63(1): 37—42 doi: 10.1111/pre.12071
[78] Yordanova Z P, Iakimova E T, Cristescu S M, et al. Involvement of ethylene and nitric oxide in cell death in mastoparan-treated unicellular alga Chlamydomonas reinhardtii [J]. Cell Biology International, 2010, 34(3): 301—308 doi: 10.1042/CBI20090138
[79] Abrantes N, Antunes S C, Pereira M J, et al. Seasonal succession of cladocerans and phytoplankton and their interactions in a shallow eutrophic lake (Lake Vela, Portugal) [J]. Acta Oecologica, 2006, 29(1): 54—64 doi: 10.1016/j.actao.2005.07.006
[80] Li Y, Li D. Competition between toxic Microcystis aeruginosa and nontoxic Microcystis wesenbergii with Anabaena PCC7120 [J]. Journal of Applied Phycology, 2012, 24(1): 69—78 doi: 10.1007/s10811-010-9648-x
[81] Ikawa M, Sasner J J, Haney J F. Activity of cyanobacterial and algal odor compounds found in lake waters on green alga Chlorella pyrenoidosa growth [J]. Hydrobiologia, 2001, 443(1): 19—22
[82] Chang D W, Hsieh M L, Chen Y M, et al. Kinetics of cell lysis for Microcystis aeruginosa and Nitzschia palea in the exposure to β-cyclocitral [J]. Journal of Hazardous Materials, 2011, 185(2-3): 1214—1220 doi: 10.1016/j.jhazmat.2010.10.033
[83] Harada K I, Ozaki K, Tsuzuki S, et al. Blue color forma-tion of cyanobacteria with β-cyclocitral [J]. Journal of Chemical Ecology, 2009, 35(11): 1295—1301 doi: 10.1007/s10886-009-9706-5
[84] Zhao J, Yang L, Zhou L, et al. Inhibitory effects of eucalyptol and limonene on the photosynthetic abilities in Chlorella vulgaris (Chlorophyceae) [J]. Phycologia, 2016, 55(6): 696—702 doi: 10.2216/16-38.1
[85] 周律, 赵静娴, 徐庆欢, 等. 桉树脑和柠檬烯对莱茵衣藻光合特性的影响. 水生生物学报, 2016, 40(6): 294—300 http://ssswxb.ihb.ac.cn/CN/abstract/abstract4145.shtml Zhou L, Zhao J X, Xu Q H, et al. Effects of eucalyptol and limonene on the photosynthetic abilities in Chlamydomonas reinhardtii [J]. Acta Hydrobiologica Sinica, 2016, 40(6): 294—300
周律, 赵静娴, 徐庆欢, 等. 桉树脑和柠檬烯对莱茵衣藻光合特性的影响. 水生生物学报, 2016, 40(6): 294—300 http://ssswxb.ihb.ac.cn/CN/abstract/abstract4145.shtml[86] Zeraatpisheh Z, Vatanparast J. Eucalyptol induces hyperexcitability and epileptiform activity in snail neu-rons by inhibiting potassium channels [J]. European Journal of Pharmacology, 2015, 764: 70—78 doi: 10.1016/j.ejphar.2015.06.050
[87] Ozdemir G, Karabay N U, Dalay M C, et al. Antibacterial activity of volatile component and various extracts of Spirulina platensis [J]. Phytotherapy Research, 2004, 18(9): 754—757 doi: 10.1002/(ISSN)1099-1573
[88] Gómez-Tenorio M A, Zanón M J, de Cara M, et al. Efficacy of dimethyl disulfide (DMDS) against Meloidogyne sp. and three formae speciales of Fusarium oxysporum under controlled conditions [J]. Crop Protection, 2015, 78: 263—269 doi: 10.1016/j.cropro.2015.09.013
[89] Ghadouani A, Pinel-Alloul B, Plath K, et al. Effects of Microcystis aeruginosa and purified microcystin-LR on the feeding behavior of Daphnia pulicaria [J]. Limnology and Oceanography, 2004, 49(3): 666—679 doi: 10.4319/lo.2004.49.3.0666
[90] Schnitzler I, Pohnert G, Hay M E, et al. Chemical defense of brown algae (Dictyopteris spp.) against the herbivorous amphipod Ampithoe longimana [J]. Oecologia, 2001, 126(4): 515—521 doi: 10.1007/s004420000546
[91] Pohnert G. Phospholipase A2 activity triggers the wound activated chemical defense in the diatom Thalassiosira rotula [J]. Plant Physiology, 2002, 129(1): 103—111 doi: 10.1104/pp.010974
[92] Watson S B, Jüttner F, Köster O. Daphnia behavioural responses to taste and odour compounds: ecological significance and application as an inline treatment plant monitoring tool [J]. Water Science and Technology, 2007, 55(5): 23—31 doi: 10.2166/wst.2007.158
[93] Jüttner F, Watson S B, von Elert E, et al. β-Cyclocitral, a grazer defence signal unique to the cyanobacterium Microcystis [J]. Journal of Chemical Ecology, 2010, 36(12): 1387—1397 doi: 10.1007/s10886-010-9877-0
[94] Fink P, von Elert E, Jüttner F. Volatile foraging kairomones in the tittoral zone: attraction of an herbivorous freshwater gastropod to algal odors [J]. Journal of Chemical Ecology, 2006, 32(9): 1867—1881 doi: 10.1007/s10886-006-9115-y
[95] Atkinson R. Atmospheric chemistry of VOCs and NOx[J]. Atmospheric Environment, 2000, 34(12-14): 2063—2101
[96] Calogirou A, Larsen B R, Kotzias D. Gas-phase terpene oxidation products: a review [J]. Atmospheric Environment, 1999, 33(9): 1423—1439 doi: 10.1016/S1352-2310(98)00277-5
[97] Xu L, Guo H, Boyd C M, et al. Effects of anthropoge-nic emissions on aerosol formation from isoprene and monoterpenes in the southeastern United States [J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(1): 37—42 doi: 10.1073/pnas.1417609112
[98] Yuan J S, Himanen S J, Holopainen J K, et al. Smelling global climate change: mitigation of function for plant volatile organic compounds [J]. Trends in Ecology & Evolution, 2009, 24(6): 323—331
[99] Orlando J J, Nozière B, Tyndall G S, et al. Product studies of the OH-and ozone-initiated oxidation of some monoterpenes [J]. Journal of Geophysical Research, 2000, 105(D9): 11561—11572 doi: 10.1029/2000JD900005
[100] 李时政, 马嫣, 郑军, 等. α-蒎烯臭氧氧化反应中二次有机气溶胶理化特性与云凝结核活性. 环境化学, 2015, 34(9): 1633—1641 doi: 10.7524/j.issn.0254-6108.2015.09.2015021002 Li S Z, Ma Y, Zheng J, et al. Physicochemical properties and cloud nucleating abilities of secondary organic aerosol from α-pinene ozonolysis [J]. Environmental Chemistry, 2015, 34(9): 1633—1641
李时政, 马嫣, 郑军, 等. α-蒎烯臭氧氧化反应中二次有机气溶胶理化特性与云凝结核活性. 环境化学, 2015, 34(9): 1633—1641 doi: 10.7524/j.issn.0254-6108.2015.09.2015021002[101] Sievert S, Kiene R, Schulz-Vogt H. The sulfur cycle [J]. Oceanography, 2007, 20(2): 117—123 doi: 10.5670/oceanog
-
期刊类型引用(7)
1. 刘铠源,段勇杰,程浩,吕俊贤,谢婷,李娟,关长涛,贾玉东. 斑石鲷(Oplegnathus punctatus)、云龙石斑鱼(Epinephelus moara♀×E.lanceolatus♂)、许氏平鮋(Sebastes schlegelii)游泳行为对比分析研究. 海洋与湖沼. 2024(03): 555-565 .  百度学术
百度学术
2. 段勇杰,谢婷,高云涛,王枫林,李梦迪,关长涛,贾玉东. 斑石鲷(Oplegnathus punctatus)游泳性能研究. 海洋与湖沼. 2023(01): 183-193 .  百度学术
百度学术
3. 张静静,王亚冰,王倩,韩多彩,彭士明. 不同抗流能力大黄鱼(Larimichthys crocea)肌肉转录组学差异分析. 海洋与湖沼. 2023(05): 1507-1516 .  百度学术
百度学术
4. 李新丹,肖新平,周卫国,罗江,周杨浩,荣义峰,祁洪芳,史建全,杜浩. 青海湖裸鲤的游泳能力及鱼梯通过效果. 渔业科学进展. 2022(02): 44-52 .  百度学术
百度学术
5. 蔡露,Katopodis Christos,金瑶,黄应平,韩德举,胡望斌,陈小娟,陶江平,侯轶群. 中国鲤科鱼类游泳能力综合分析和应用. 湖泊科学. 2022(06): 1788-1801 .  百度学术
百度学术
6. 孙春艳,曾令清. 颜色标记对两种鱼类有氧运动能力的影响. 重庆师范大学学报(自然科学版). 2020(03): 67-71 .  百度学术
百度学术
7. 朱峰磊,张敬敬,龙静,闫玉莲,谢小军. 游泳加速模式对南方鲇和团头鲂运动后代谢恢复的影响. 淡水渔业. 2020(03): 65-71 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载: