THE EFFECTS OF LINSEED OIL AND SOYBEAN OIL ON FATTY ACID COMPOSITION AND Δ6FAD GENE EXPRESSION IN LIVER AND MUSCLE OF LARGE YELLOW CROAKER (LARIMICHTHYS CROCEA)
-
摘要: 为了研究亚麻籽油(LO)和豆油(SO)完全替代鱼油(FO)对大黄鱼(Larimichthys crocea)肝脏和肌肉脂肪酸组成及Δ6Fad (Δ6 Fatty acid desaturase)基因表达的影响。实验用豆油和亚麻籽油替代鱼油制备了3种等氮等脂的精制饲料, 在海水浮动网箱中进行了为期10周的养殖实验。实验结果表明: (1)鱼油组的增重率、饲料效率和特定生长率均显著高于亚麻籽油组和豆油组(P<0.05), 但对成活率, 肝体指数和脏体指数没有显著影响(P>0.05); (2)亚麻籽油和豆油完全替代鱼油显著改变了鱼体肝脏和肌肉的脂肪酸组成, 降低了肝脏和肌肉LC-PUFA (Long chain-polyunsaturated fatty acid)的相对含量(P<0.05), 在亚麻籽油组(LO)和豆油组(SO)中没有显著差异(P>0.05), 在各处理组中, 肌肉的n-3LC-PUFA的相对含量显著高于肝脏(P<0.05); (3)亚麻籽油和豆油显著上调了肌肉和肝脏中Δ6Fad基因的表达量(P<0.05), 其表达量在肝脏中分别升高了7.6和6.5倍, 在肌肉中分别上升了2.2和2.8倍。结果表明, 在实验条件下亚麻籽油和豆油完全替代鱼油对大黄鱼生长具有不利影响, 亚麻籽油和豆油替代鱼油降低了肝脏和肌肉中LC-PUFA的含量, 提高了Δ6Fad基因的表达量。Abstract: To investigate the effects of linseed oil and soybean oil on fatty acid composition and Δ6Fad gene expression in liver and muscle of large yellow croaker, three defined diets were made with fish oil (FO), soybean oil (SO) and linseed oil (LO) as fat sources for a 10 weeks experiment on floating cages. Results indicated that the weight gain rate, feed efficiency ratio and specific growth rate of FO group was significantly higher than LO group and SO group (P<0.05), and no significant difference in survival rate,HSI and VSI (P>0.05) were observed among groups. The fatty acid was changed and the relative content of LC-PUFA (Long chain-polyunsaturated fatty acid) reduced significantly (P<0.05) in liver and muscle when fish oil was replaced by linseed oil and soybean oil, but there was no significant difference between linseed oil treatment and soybean oil treatment (P>0.05). The relative content of n-3 LC-PUFA in muscle was more than that of liver (P<0.05). SO and LO induced the Δ6Fad expression 7.6 and 6.5 times in liver and 2.2 and 2.8 times in muscle respectively. Results suggest that the replacement of fish oil by linseed oil and soybean oil had negative effect on fish performance possibly via lipids metabolism.
-
Keywords:
- Large yellow croaker /
- Δ6Fad /
- Fatty acid /
- Linseed oil /
- Soybean oil
-
近几十年来, 随着西藏经济社会的快速发展, 西藏鱼类资源也面临着国内其他水域渔业发展所出现的一些共性问题, 如部分流域过度捕捞[1, 2—5]、水利设施建设导致的大坝阻隔、栖息地丧失、生境片段化等[6]。而且由于西藏特殊的地理位置和社会经济特点, 它还面临着更为严峻的生态环境问题和挑战, 如外来物种入侵[7—9]、全球气候变化[10]等, 加之高原生态环境脆弱、生态系统结构简单、生产力低下[11]以及鱼类生长缓慢、早期资源发育周期较长[12]、对生境高度适应和依赖等特点[2—5], 西藏水生生态更容易受到外界的影响。双须叶须鱼处于这种生存环境中, 本身的种群结构是不容乐观的, 对于这种生态系统的扰动, 都将造成鱼类资源的不同程度上的破坏, 恢复过程都将是十分缓慢的, 甚至无法恢复[11]。双须叶须鱼(Ptychobarbus dipogon Regan), 隶属裂腹鱼亚科, 叶须鱼属, 为雅鲁藏布江中游的特有鱼类[1]。2016年双须叶须鱼列入中国脊椎动物红色名录[13]。因此, 必须加快推动双须叶须鱼的养护工作[14]。目前, 有关双须叶须鱼的研究报道, 见于渔业资源调查[15]、营养价值评定[16]、摄食器官与食性[17]、繁殖策略[18]、染色体多样性[19]、性腺发育[20]、年龄和生长及死亡率的关系[21]、年龄鉴定[22]、染色体数目[23]、体长体重关系[24, 25]、线粒体序列[26]等。
鱼类的早期发育研究, 一方面为鱼类的繁殖生物学, 鱼类资源保护与利用提供科学依据和理论基础。另一方面, 鱼类早期发育研究为鱼类的规模化生产提供技术支持。鱼类的受精卵在不同的发育时期对外界环境的反应也不一样, 在生产实践过程中, 应该密切关注外界环境, 规避风险, 减少损失。陈礼强等[27]指出细鳞裂腹鱼的早期发育过程, 原肠期对外界环境变化最为敏感。在原肠期, 由于细胞的分裂迅速和流动量大, 代谢旺盛, 耗氧多, 对环境要求高, 处在这个时期的胚胎如果遇到水温突变等异常情况都可能导致细胞重排时间和空间程序的混乱, 容易造成胚胎的死亡或器官出现畸形[28]。关于裂腹鱼类的早期发育研究, 主要有: 四川裂腹鱼(Schizothorax kozlovi)[29]、青海湖裸鲤(Gymnocypis przewalskii)[30]、松潘裸鲤(Gymnocypris potanini)[31]、齐口裂腹鱼(Schizothorax prenanti)[32]、小裂腹鱼(Schizothorax parvus)[33]、新疆扁吻鱼(Aspiorhynchus laticeps)[34, 35]、塔里木裂腹鱼(Schizothorax (Racoma) biddulphi)[36]、宝兴裸裂尻鱼(Schizopygopsis malacanthus baoxingensis)[37]、昆明裂腹鱼(Schizothorax grahami)[38]、细鳞裂腹鱼(Schizothorax chongi)[27]、黄河裸裂尻鱼(Schizopygopsis pylzovi)[39, 40]、伊犁裂腹鱼(Schizothorax pseudaksaiensis)[41], 异齿裂腹鱼(Schizothorax o’connori)[42]、尖裸鲤(Oxygymnocypris stewartii)[43]、光唇裂腹鱼(Schizothorax lissolabiatus)[44]、厚唇裸重唇鱼(Gymnodiptychus pachycheilus)[45]、祁连山裸鲤(Gymnocypris chilianensis)[46]、短须裂腹鱼(Schizothorax wangchiachii)[47—49]等。未见双须叶须鱼早期发育的研究报道。因此, 开展双须叶须鱼胚胎和仔鱼发育的时序与特点研究就显得尤为重要, 进而为双须叶须鱼的人工繁育技术、资源保护和增殖提供科学依据。
1. 材料与方法
1.1 双须叶须鱼亲鱼获取及孵化
2014年2月, 将采自位于拉萨市墨竹工卡县扎雪乡拉萨河段的双须叶须鱼亲鱼运至西藏农牧学院藏鱼繁育基地。其中, 雌性1尾(体重599.5 g, 体长374 mm), 雄性1尾(体重327 g, 体长310 mm)。通过干法人工授精, 自然产卵, 得到3314粒受精卵。平均分为3组, 将受精卵移入孵化框(55 cm×33 cm×9 cm), 孵化框置于塑料缸(85 cm×65 cm×75 cm) 中, 采用上海海圣控温养殖系统控制水温在10℃左右, 溶解氧8 mg/L以上。用吸管及时剔除死卵, 死鱼苗。
1.2 双须叶须鱼的早期发育观察
使用Nikon SMZ1500体式显微镜(生产商: 日本尼康株式会社)进行观察, ScopePhoto 3.0图像测量软件进行测量、Adobe Photoshop CS6软件处理图片。考虑到各发育期的时间存在个体差异, 将半数以上个体出现新的特征作为发育时期的划分标准, 依据相关文献对双须叶须鱼的胚胎发育过程进行判别[29, 43]。
1.3 数据处理
采用Matlab 2011软件的神经网络聚类算法(Self Organizing Maps, SOM)对已有的裂腹鱼亚科和鲃亚科鱼类的相关文献数据进行收集[29—55], 如卵径、初孵仔鱼长度、吸水卵径、卵周隙、总积温等, 进行聚类分析。
2. 结果
2.1 双须叶须鱼的胚胎发育过程
![]() 图版Ⅰ 双须叶须鱼胚胎发育图1. 受精卵; 2. 卵黄周隙最大; 3. 胚盘隆起; 4. 2细胞期; 5. 4细胞期; 6. 8细胞期; 7. 16细胞期; 8. 32细胞期; 9. 64细胞期; 10. 多细胞期; 11. 桑葚期; 12. 囊胚早期; 13. 囊胚中期; 14. 囊胚晚期; 15. 原肠早期; 16. 原肠中期; 17. 原肠晚期; 18. 神经胚期; 19. 体节出现期; 20. 胚孔封闭期; 21. 眼原基出现期; 22. 眼囊出现期; 23. 听囊期; 24. 耳石出现期; 25. 尾牙出现期; 26. 眼晶体出现期; 27. 肌肉效应期; 28. 心脏原基出现期; 29. 嗅囊期; 30. 心搏期; 31. 胸鳍原基出现期; 32. 肛板期; 33. 血液循环; 34. 尾部鳍褶期; 35. 出膜; 胚盾(16-1); 脊索(18-1); 体节(19-1); 脑泡原基(20-1); 眼原基(21-1); 听囊(23-1); 耳石(24-1); 眼晶体(26-1); 围心腔(28-1); 心脏原基(28-2); 嗅囊(29-1); 胸鳍原基(31-1); 消化道(31-2); 肛板(32-1)图版Ⅰ. The embryonic development of Ptychobarbus dipogon1. Fertilized egg; 2. Perivitelline space maximum; 3. Blastdisc stage; 4. 2 cell stage; 5. 4 cell stage; 6. 8 cell stage; 7. 16 cell stage; 8. 32 cell stage; 9. 64 cell stage; 10. Morula stage; 11. Morula stage; 12. Early blastula stage; 13. Mid-blastula stage; 14. Late gastrula stage; 15. Early gastrula stage; 16. Mid-gastrula stage; 17. Late gastrula stage; 18. Neural embryo formation; 19. Metameres appearance; 20. Blastopore formation; 21. Optic anlage; 22. Eye bud formation; 23. Otic vesicle phase; 24. Otoliths stage; 25. Tail bud stage; 26. Eye lens formation stage; 27. Muscular contraction stage; 28. Heart rudiment stage; 29. Olfactory capsule stage; 30. Heart pulsation stage; 31. Pectoral fin stage; 32. Anal membrane stage; 33. Blood circulation stage; 34. Caudal fin fold stage; 35. Newly hatching stage; Embryonic shield (16-1); Notochord (18-1); Somite (19-1); Brain vesicle primordium (20-1); Eye primordial (21-1); Otic vesicle (23-1); Otoliths (24-1); Eye lens (26-1); Cardiocoelom (28-1); Cardiac primordia (28-2); Olfactory capsule (29-1); Pectoral fin primordial (31-1); Alimentary canal (31-2); Anal membranae (32-1)表 1 双须叶须鱼胚胎发育特征描述Table 1. The embryonic development features of Ptychobarbus dipogon
图版Ⅰ 双须叶须鱼胚胎发育图1. 受精卵; 2. 卵黄周隙最大; 3. 胚盘隆起; 4. 2细胞期; 5. 4细胞期; 6. 8细胞期; 7. 16细胞期; 8. 32细胞期; 9. 64细胞期; 10. 多细胞期; 11. 桑葚期; 12. 囊胚早期; 13. 囊胚中期; 14. 囊胚晚期; 15. 原肠早期; 16. 原肠中期; 17. 原肠晚期; 18. 神经胚期; 19. 体节出现期; 20. 胚孔封闭期; 21. 眼原基出现期; 22. 眼囊出现期; 23. 听囊期; 24. 耳石出现期; 25. 尾牙出现期; 26. 眼晶体出现期; 27. 肌肉效应期; 28. 心脏原基出现期; 29. 嗅囊期; 30. 心搏期; 31. 胸鳍原基出现期; 32. 肛板期; 33. 血液循环; 34. 尾部鳍褶期; 35. 出膜; 胚盾(16-1); 脊索(18-1); 体节(19-1); 脑泡原基(20-1); 眼原基(21-1); 听囊(23-1); 耳石(24-1); 眼晶体(26-1); 围心腔(28-1); 心脏原基(28-2); 嗅囊(29-1); 胸鳍原基(31-1); 消化道(31-2); 肛板(32-1)图版Ⅰ. The embryonic development of Ptychobarbus dipogon1. Fertilized egg; 2. Perivitelline space maximum; 3. Blastdisc stage; 4. 2 cell stage; 5. 4 cell stage; 6. 8 cell stage; 7. 16 cell stage; 8. 32 cell stage; 9. 64 cell stage; 10. Morula stage; 11. Morula stage; 12. Early blastula stage; 13. Mid-blastula stage; 14. Late gastrula stage; 15. Early gastrula stage; 16. Mid-gastrula stage; 17. Late gastrula stage; 18. Neural embryo formation; 19. Metameres appearance; 20. Blastopore formation; 21. Optic anlage; 22. Eye bud formation; 23. Otic vesicle phase; 24. Otoliths stage; 25. Tail bud stage; 26. Eye lens formation stage; 27. Muscular contraction stage; 28. Heart rudiment stage; 29. Olfactory capsule stage; 30. Heart pulsation stage; 31. Pectoral fin stage; 32. Anal membrane stage; 33. Blood circulation stage; 34. Caudal fin fold stage; 35. Newly hatching stage; Embryonic shield (16-1); Notochord (18-1); Somite (19-1); Brain vesicle primordium (20-1); Eye primordial (21-1); Otic vesicle (23-1); Otoliths (24-1); Eye lens (26-1); Cardiocoelom (28-1); Cardiac primordia (28-2); Olfactory capsule (29-1); Pectoral fin primordial (31-1); Alimentary canal (31-2); Anal membranae (32-1)表 1 双须叶须鱼胚胎发育特征描述Table 1. The embryonic development features of Ptychobarbus dipogon阶段Stage 发育时期Developmental stages 时间记录Time records 发育累计时间Cumulative time (h) 特征Character 前期Earlier stage 受精卵 3.24 (23:29) 圆形、淡黄色或橙色具有半透明光泽, 沉性卵, 鱼卵具有微黏性, 受精遇水后失黏, 富含卵黄且分布均匀, 卵径3.7—3.9 mm, 卵黄极性明显, 卵在受精75min后, 膨胀至最大, 卵膜直径5.1—5.3 mm, 卵黄直径3.7—4.3 mm, 胶膜弹性非常强(图版Ⅰ-1)。 胚盘隆起 3.25 (04:57) 4.47 原生质丝向动物极靠拢, 并随着时间推移逐渐变大, 变高, 形成的边缘轮廓并不完整呈星射辐射状, 此刻胚盘的最大高度占卵径1/5, 宽度占卵径2/3 (图版Ⅰ-3)。 卵裂期Cleavage stage 2细胞期 3.25 (07:24) 6.92 胚盘顶部出现一条纵沟, 将动物极分成两个大小相等的分裂球, 卵径4.94 mm, 卵黄直径3.72 mm, 卵膜平均0.5 mm, 分裂球高度平均0.8 mm (图版Ⅰ-4)。 4细胞期 3.25 (10:57) 10.47 出现第二次分裂, 分裂沟与第一次分裂沟垂直, 形成四个大小相等的分裂球(图版Ⅰ-5)。 8细胞期 3.25 (13:15) 13.77 出现第三次分裂, 形成2排8个分裂球, 胚盘逐渐向植物极延伸(图版Ⅰ-6)。 16细胞期 3.25 (17:05) 17.60 出现第四次分裂, 形成16个分裂球, 4排4列整齐排列(图版Ⅰ-7)。 32细胞期 3.25 (20:24) 20.92 完成第五次分裂, 有四个经裂面, 且与第三次分裂面平行, 4排8列整齐的排在同一个平面上(图版Ⅰ-8)。 64细胞期 3.25 (21:54) 22.42 完成第六次分裂, 因细胞分裂速度不一致, 故分裂球的大小, 形态差异明显, 64个细胞排列在一个分裂球面上(图版Ⅰ-9)。 多细胞期 3.25 (23:41) 24.20 出现水平分裂和切线分裂, 分裂球越来越小, 卵裂的速度加快, 形态、体积差异明显, 细胞排列无规律, 细胞界限模糊无法计数细胞的个数(图版Ⅰ-10)。 桑葚期 3.26 (04:26) 28.95 细胞分裂不同步, 细胞数目不断增加, 细胞体积逐渐变小, 多层细胞叠加如同桑葚, 高度占卵黄直径的1/3 (图版Ⅰ-11)。 囊胚期Blastula stage 囊胚早期 3.26 (08:50) 33.52 细胞界限模糊, 分裂球组成的囊胚层隆起, 位于卵黄之上, 高度达卵黄的1/5 (图版Ⅰ-12)。 囊胚中期 3.26 (14:51) 39.52 囊胚层细胞向动物极移动, 变低, 变薄, 胚体高度下降约为卵黄1/4 (图版Ⅰ-13)。 囊胚晚期 3.27 (06:42) 56.52 囊胚细胞向卵黄部位下包, 约占整个细胞的1/3, 动物极较植物色彩暗, 去掉卵膜卵黄破裂, 该期未受精卵开始裂解(图版Ⅰ-14)。 原肠期Gastrula stage 原肠早期 3.28 (19:01) 92.84 胚层细胞约占卵黄的1/3, 背唇呈新月状, 出现光亮明黄的胚环, 胚胎外形呈蘑菇朵状(图版Ⅰ-15)。 原肠中期 3.29 (08:49) 106.64 胚层细胞占卵黄的1/2, 帽状胚层细胞覆盖在卵黄囊上, 在胚胎的背唇处出现箭头似的隆起即是胚盾(16-1, 图版Ⅰ-16)。 原肠晚期 3.29 (16:27) 114.27 胚层下包3/4, 胚盾加厚加长, 胚盾向动物极发展, 胚体的雏形逐渐形成(图版Ⅰ-17)。 神经胚期 Neural embryo formation 神经胚期 3.29 (20:06) 117.92 胚体下包4/5, 能清晰看到胚体的轮廓, 胚盾前端出现神经板, 胚胎外露很小部分卵黄, 细胞内卷内陷形成神经沟, 侧面观察, 胚体背面增厚隆起, 胚体靠近卵黄部形成一条可见的模糊透明圆柱形脊索(18-1, 图版Ⅰ-18)。 体节出现期 3.30 (02:30) 124.32 胚体中部出现2—3对体节(19-1), 胚体占卵黄囊周长1/2—2/3, 神经板头端隆起加大, 尾部也逐渐变大, 头部, 尾部厚于胚体背部, 卵膜可剥, 从顶看胚体不平整(图版Ⅰ-19)。 胚孔封闭期 3.30 (12:18) 134.12 背唇, 腹唇, 侧唇在胚孔处汇合, 将胚孔封闭, 背部颜色较深的条纹为神经沟, 中间凸起明显, 脊索逐渐清晰向尾部延长, 以胚孔方向为正, 左面少于右面, 头部开始膨大隆起的为脑泡原基(20-1, 图版Ⅰ-20)。 器官分化期Qrgan differentiation stage 眼原基出现期 3.30 (20:09) 143.97 脑泡两侧出现椭圆形的隆起即眼原基(21-1), 体节从背部开始向头尾两边增加至6对, 此时胚体绕卵黄4/5 (图版Ⅰ-21)。 眼囊期 3.31 (07:28) 155.29 眼基中央出现像“I”的横凹, 并逐渐扩大变深, 脑泡已经开始分化为前, 中, 后三脑模型, 体节9—10对, 头部出现的铭文皱褶开始加深, 卵黄囊的韧性开始变强, 体节14—15对(图版Ⅰ-22)。 听囊期 3.31 (11:30) 159.29 胚体后脑出现椭圆透明的囊腔, 即为听囊(23-1), 体节17—18对, 此时尾牙模型基本已形成, 呈箭头状脑部铭文状的纹路开始延伸到眼囊后部, 胚体环绕卵黄约5/8, 脊索已成细线条状(图版Ⅰ-23)。 耳石出现期 3.31 (23:36) 171.39 体节19—24对, 听囊增大且清晰, 耳囊内出现两颗透明的小斑即是耳石(24-1, 图版Ⅰ-24)。 尾芽期 4.2 (04:12) 199.99 体节28对, 胚体后端膨大隆起, 卵黄囊椭圆形, 胚体首尾逐步靠近, 尾牙游离于胚体, 靠近尾部的卵黄出现凹陷(图版Ⅰ-25)。 2.2 双须叶须鱼仔稚鱼发育过程
表 2 双须叶须仔稚鱼发育特征描述Table 2. The larvae and juveniles development features of Ptychobarbus dipogon器官出现时期
Qrgan appearance stage时间记录
Time record (d)特征Characters 体色素出现Body pigment
胸鳍上翘Pectoral upward
鳃盖骨出现Operculum
下颌原基出现Underjaw primordial1 全长(12.44±0.15) mm, 肛前长9.39 mm, 肛后长2.78 mm, 心率55—60次/min, 体节60对, 初孵仔鱼颜色透明, 胸鳍上翘, 头部游离卵黄囊, 身体呈S型, 卵黄囊前部呈椭圆型, 后部呈短状棒形。心脏由心房(图版Ⅱ-1d-2)、心室(图版Ⅱ-1d-3)和静脉窦(图版Ⅱ-1d-5)组成, 位于头部之下、卵黄囊前方, 血液从心脏发出沿着背大动脉向前颈动脉流向脑眼等部位, 向后流向尾动脉, 在尾的中部折向, 下入尾静脉在脊索下方入主静脉, 在脑部方向与来自头部的前主静脉汇合, 通过居维氏管进入静脉窦返回心脏, 卵黄囊前端腹部存有血窦(图版Ⅱ-1d-4)。头部靠后1/3处可见食道(图版Ⅱ-1d-7)雏形, 泄殖孔(图版Ⅱ-1d-8)和鳃盖骨(图版Ⅱ-1d-6)均清晰可见, 耳石上方出现环状耳蜗(图版Ⅱ-1d-9), 下颌原基(图版Ⅱ-1d-1)出现。鱼侧卧静息在水底, 扭动频繁, 此时仔鱼为内源营养需要。 鳃弓原基出现Branchial arch primordial 2 全长14.81 mm, 肛前长11.14 mm, 眼睛的直径0.40 mm, 心率62次/min, 鳃部鳃弓原基(图版Ⅱ-2d-1)出现且有血液流过, 脊柱内血液循环明显, 尾部稍显平直。 消化道出现Alimentary canal
肝胰脏原基出现Hepatopancreas primordial3 心率60—65次/min, 消化道(图版Ⅱ-3d-3)明显, 下方出现肝胰脏原基(图版Ⅱ-3d-2), 泄殖孔处凹陷, 下颌(图版Ⅱ-3d-1)形成, 卵黄囊上的色素斑点变深, 能清晰看到卵黄囊上的血管(图版Ⅱ-3d-4), 仔鱼趋于平直, 胸鳍牙增大呈圆扇形, 活动能力进一步加强。 鳃耙出现Gill raker
体表色素细胞带出现Body pigment cell mass4 全长15.48 mm, 肛前长11.39 mm, 肛后长3.91 mm, 心率60—65次/min, 眼晶体向外凸出, 鳃弓有4对, 鳃弓内出现凸起为鳃耙(图版Ⅱ-4d-1), 口凹加深, 头向前伸, 鳃盖伸长, 心脏靠近胸腔, 仔鱼躯体已有明显的细胞色素团(图版Ⅱ-4d-2), 尾鳍的辐射状条纹下叶多于上叶。 口凹、鳃丝形成Stomatodeum, Gill filament 5 口凹(图版Ⅱ-5d-1)形成但未形成口裂, 口不能张合, 下颌开始微微抽动, 鳃丝(图版Ⅱ-5d-2)形成, 围心腔收缩, 仔鱼集群静息于池角或尺边底。 胸鳍褶、背鳍褶、腹鳍褶出现弹性丝Elastic thread of pectoral fin fold, dorsal fin fold, pelvic fin fold 6 下颌下上抽动回缩频率加大, 口裂(图版Ⅱ-6d-1)清晰, 眼前缘的嗅窝加深, 鱼体腹部出现鳍褶且逐渐增大, 尾椎微微上翘, 尾鳍鳍褶加大, 卵黄囊继续收缩形成哑铃或者棒状的结构, 头部、背部零星地出现黑色素, 星芒状, 鳃盖伸长, 下部可盖住鳃丝, 胸鳍褶、背鳍褶、腹鳍褶出现弹性丝。 鼻凹出现Nose concave
星芒状色素团出现Astral form pigment group7 鼻凹(图版Ⅱ-7d-1)出现, 位于眼前方, 鳃丝血流量加大加快, 鳃盖透明可略微张合, 腹部出现星芒状的黑色素(图版Ⅱ-7d-2), 头骨进一步隆起, 胸鳍进一步变大, 脊索与卵黄囊接触处出现星状黑色素细胞(图版Ⅱ-7d-2), 脊椎模型成形, 仔鱼可以上下游动, 鱼苗进入混合营养期。 鳔前原基出现Swim bladder primordial 9 头部色素斑点增多增大, 眼睛可转动, 胸鳍后部卵黄囊中间有一突起, 为鳔前原基(图版Ⅱ-9d-1), 消化道前端变粗且有皱褶, 血液循环延伸至最末脊椎骨, 下颌开闭自如。胸鳍摆动以便平衡, 鳃丝数量增多。 尾鳍鳍条开始出现Tail fin 11 尾鳍中间间质细胞形成了鳍条, 下颌运动伴随着围心腔的斜上方向的收张, 毛细血管呈网状分布在卵黄囊上。 鳔一室出现Swim bladder one room
半规管形成Semicircular canal13 鳔一室(图版Ⅱ-13d-1)出现, 色素细胞呈片状相连布满体表, 伴随着下颌的张合鳃盖开闭, 卵黄囊呈棒状, 胸鳍末端呈圆弧状, 位于胸位, 消化道有褶皱且增粗, 充塞有饵料, 背鳍原基出现, 清晰可见上颌、下颌、上唇、下唇, 耳囊内半规管形成。 背鳍原基出现Dorsal fin primordial 17 背鳍原基(图版Ⅱ-17d-1)出现, 透明无鳍条。胸鳍的鳍条明显, 可见胸鳍支鳍骨。尾鳍圆弧形, 尾鳍鳍条数目增多且有黑色素。肌节清晰, 腹鳍变宽, 腹部有点状色素, 眼膜络网、晶状体、视网膜清晰可见, 肝胰脏增大, 有排泄物排出。 胸鳍鳍条出现Pectoral
fins鳔二室出现Swim bladder two room19 鳔二室出现(图版Ⅱ-19d-1), 鳃盖骨可见清晰横状纹路。 腹部鳍褶变大Pelvic fin fold became bigger 21 卵黄消失, 背鳍透明无鳍条, 仔鱼体色呈褐色, 舌颌骨(图版Ⅱ-21d-1)出现, 围心腔不透明。 臀鳍原基出现Anal fin primordial
脾脏出现Spleen
腹鳍原基出现Pelvic fin primordial28 吻部较尖, 鳔室增大明显, 鳔前室变大, 仍未充气胸鳍透明, 鳔前端腹部有一黑褐色圆饼状组织为脾脏(图版Ⅱ-28d-1), 尾鳍鳍条20条左右, 背鳍较小, 外缘呈锯齿状, 背鳍原基出现3根辐射状纹, 泄殖孔前方出现腹鳍原基(图版Ⅱ-28d-2), 泄殖孔后方出现臀鳍原基(图版Ⅱ-28d-3)。鳃盖上具有一条纹路。 侧线出现Lateral line 29 鳔二室充气明显, 体侧中央可见一条黑色细线, 为侧线(图版Ⅱ-29d-1)。 腹鳍出现Pelvic fin ray 33 腹部中央可见呈辐射状腹鳍(图版Ⅱ-33d-1), 尾部鳍条清晰, 尾鳍边缘呈锯齿状, 背部的肌肉增厚。 鳞片出现Scale 34 两鳔室下方可见闪光质的鳞片(图版Ⅱ-34d-1), 消化道前端膨大, 后端渐小, 鳞片逐渐由腹部下方向上方覆盖, 由鳔向泄殖孔方向覆盖。 38 泄殖孔附近出现两条白色的管道, 并在泄殖孔口汇合, 臀鳍有模糊不清的条纹。 76 尾鳍后缘呈叉型, 鱼体体色近成鱼, 呈黄褐色, 鳞片覆盖体表。 ![]() 图版Ⅱ 双须叶须鱼仔稚鱼发育图1d-1. 下颌原基; 1d-2. 心房; 1d-3. 心室; 1d-4. 血窦; 1d-5. 静脉窦; 1d-6. 鳃盖骨; 1d-7. 食道; 1d-8.泄殖孔; 1d-9. 耳蜗; 2d-1. 鳃弓原基; 3d-1. 下颌; 3d-2. 肝胰脏原基; 3d-3. 消化道; 3d-4. 血管; 4d-1. 鳃耙; 4d-2. 体色素细胞团; 5d-1. 口凹; 5d-2. 鳃丝; 6d-2. 胸鳍褶 6d-3. 背鳍褶; 6d-4. 腹鳍褶; 7d-1. 鼻凹; 7d-2. 星芒状色素团; 9d-1. 鳔前原基; 13d-1. 鳔一室; 17d-1. 背鳍原基; 17-2. 胸鳍鳍条; 19d-1. 鳔二室; 21d-1. 舌颌骨; 28d-1. 脾脏; 28d-2. 腹鳍原基; 28d-3. 臀鳍原基; 29d-1. 侧线; 33d-1. 腹鳍鳍条; 34d-1. 鳞片图版Ⅱ. The larvae and juveniles development features of Ptychobarbus dipogon1d-1. Underjaw primordial; 1d-2. Atrium; 1d-3. Ventricle; 1d-4. Blood sinus; 1d-5. Venous sinus; 1d-6. Operculum; 1d-7. Esophagus; 1d-8. Cloacal orifice; 1d-9. Cochlea; 2d-1. Branchial arch primordial; 3d-1. Underjaw; 3d-2. Hepatopancreas primordial; 3d-3. Alimentary canal; 3d-4. Blood vessel; 4d-1. Gill raker; 4d-2. Body pigment cell mass; 5d-1. Stomatodeum; 5d-2. Gill filament; 6d-2. Pectoral fin fold; 6d-3. Dorsal fin fold; 6d-4. Pelvic fin fold; 7d-1. Nose concave; 7d-2. Astral form pigment group; 9d-1. Swim bladder primordial; 13d-1. Swim bladder one room; 17d-1. Dorsal fin primordial; 17-2. Pectoral fins; 19d-1. Swim bladder two room; 21d-1. Hyomandibular; 28d-1. Spleen; 28d-2. Pelvic fin primordial; 28d-3. Anal fin primordial; 29d-1. Lateral line; 33d-1. Pelvic fin ray; 34d-1. Scale
图版Ⅱ 双须叶须鱼仔稚鱼发育图1d-1. 下颌原基; 1d-2. 心房; 1d-3. 心室; 1d-4. 血窦; 1d-5. 静脉窦; 1d-6. 鳃盖骨; 1d-7. 食道; 1d-8.泄殖孔; 1d-9. 耳蜗; 2d-1. 鳃弓原基; 3d-1. 下颌; 3d-2. 肝胰脏原基; 3d-3. 消化道; 3d-4. 血管; 4d-1. 鳃耙; 4d-2. 体色素细胞团; 5d-1. 口凹; 5d-2. 鳃丝; 6d-2. 胸鳍褶 6d-3. 背鳍褶; 6d-4. 腹鳍褶; 7d-1. 鼻凹; 7d-2. 星芒状色素团; 9d-1. 鳔前原基; 13d-1. 鳔一室; 17d-1. 背鳍原基; 17-2. 胸鳍鳍条; 19d-1. 鳔二室; 21d-1. 舌颌骨; 28d-1. 脾脏; 28d-2. 腹鳍原基; 28d-3. 臀鳍原基; 29d-1. 侧线; 33d-1. 腹鳍鳍条; 34d-1. 鳞片图版Ⅱ. The larvae and juveniles development features of Ptychobarbus dipogon1d-1. Underjaw primordial; 1d-2. Atrium; 1d-3. Ventricle; 1d-4. Blood sinus; 1d-5. Venous sinus; 1d-6. Operculum; 1d-7. Esophagus; 1d-8. Cloacal orifice; 1d-9. Cochlea; 2d-1. Branchial arch primordial; 3d-1. Underjaw; 3d-2. Hepatopancreas primordial; 3d-3. Alimentary canal; 3d-4. Blood vessel; 4d-1. Gill raker; 4d-2. Body pigment cell mass; 5d-1. Stomatodeum; 5d-2. Gill filament; 6d-2. Pectoral fin fold; 6d-3. Dorsal fin fold; 6d-4. Pelvic fin fold; 7d-1. Nose concave; 7d-2. Astral form pigment group; 9d-1. Swim bladder primordial; 13d-1. Swim bladder one room; 17d-1. Dorsal fin primordial; 17-2. Pectoral fins; 19d-1. Swim bladder two room; 21d-1. Hyomandibular; 28d-1. Spleen; 28d-2. Pelvic fin primordial; 28d-3. Anal fin primordial; 29d-1. Lateral line; 33d-1. Pelvic fin ray; 34d-1. Scale3. 讨论
Hora[56]指出, 裂腹鱼亚科起源于鲃亚科, 喜马拉雅山北面的鱼类区系, 可能是在一个较早的时期, 由具有共同的性状的祖先分化而来的。据曹文宣等[57]对骨骼的比较研究, 裂腹鱼类与鲃亚科中一些原始的属, 如四须鲃属、突吻鱼属和鲃属等的颅骨结构非常相似。这进一步证实了, 裂腹鱼类的祖先, 是近似于鲃亚科中原始属的种类。裂腹鱼亚科和鲃亚科鱼类在生态上的区别, 正如它们目前的分布区域的自然条件所显示, 前者是适应寒冷的气候, 后者是适应于温暖的气候(表 3)。但是, 在气候比较寒冷的青藏高原地区在晚第三纪分布有鲃亚科鱼类, 这说明, 裂腹鱼类的出现和发展, 是与青藏高原的急剧隆起, 及随之发生的自然条件的显著改变息息相关的[57]。
表 3 裂腹鱼亚科与鲃亚科鱼类胚胎发育比较Table 3. Comparison of embryonic development between Schizothoracinae fish and Barbinae fishes鱼类Fish 代码Code 卵径ED 初孵仔鱼长度LNH 吸水卵径
EDI卵周隙PA 总积温AT 数据来源
Data source●裂腹鱼亚科Schizothoracinae ●●裂腹鱼属Schizothorax 光唇裂腹鱼Schizothorax lissolabiatus Fish1 2.20 8.50 3.20 1.00 2189.76 文献[44] 齐口裂腹鱼Schizothorax prenanti Fish2 2.95 11.00 4.20 1.25 2211.00 文献[32] 四川裂腹鱼Schizothorax kozlovi Fish3 2.65 8.30 3.70 1.05 2125.50 文献[29] 塔里木裂腹鱼
Schizothorax (Racoma) biddulphiFish4 1.75 7.50 2.75 1.00 1656.20 文献[36] 细鳞裂腹鱼Schizothorax chongi Fish5 2.80 10.00 3.75 1.45 2108.00 文献[27] 伊犁裂腹鱼
Schizothorax pseudaksaiensisFish6 1.75 7.90 3.03 1.28 2510.00 文献[41] 异齿裂腹鱼Schizothorax o’connori Fish9 2.92 8.97 3.72 0.80 2656.80 文献[42] 异齿裂腹鱼Schizothorax o’connori Fish10 2.40 9.84 3.67 1.27 2451.00 文献[50] 拉萨裂腹鱼Schizothorax waltoni Fish13 2.95 10.67 4.03 1.08 2904.00 文献[50] 昆明裂腹鱼Schizothorax grahami Fish14 2.70 11.10 4.01 1.31 2556.00 文献[38] 小裂腹鱼Schizothorax parvus Fish19 1.90 7.50 3.00 1.10 2495.37 文献[33] 短须裂腹鱼Schizothorax wangchiachii Fish20 2.70 11.36 3.68 0.92 2539.98 文献[49] 短须裂腹鱼Schizothorax wangchiachii Fish21 2.36 8.70 3.68 1.32 3565.30 文献[47] 短须裂腹鱼Schizothorax wangchiachii Fish22 3.18 10.88 3.96 0.78 2633.68 文献[48] ●●裸重唇鱼属Gymnodiptychus 厚唇裸重唇鱼
Gymnodiptychus pachycheilus2.50 − 4.41 1.91 1962.00 文献[45] ●●裸裂尻鱼属Schizopygopsis 黄河裸裂尻鱼Schizopygopsis pylzovi Fish7 2.30 10.10 3.20 0.90 2727.50 文献[40] 黄河裸裂尻鱼Schizopygopsis pylzovi Fish8 2.20 11.20 3.20 1.00 3880.80 文献[39] 宝兴裸裂尻鱼
Schizopygopsis malacanthus baoxingensis3.41 8.99 − − 4006.15 文献[37] 拉萨裸裂尻鱼
Schizopygopsis younghusbandiFish12 2.50 10.86 3.54 1.04 3038.50 文献[50] ●●尖裸鲤属Oxygymnocypris 尖裸鲤Oxygymnocypris stewartii Fish11 2.57 10.27 3.22 0.65 2726.40 文献[43] ●●裸鲤属Gymnocypris 祁连山裸鲤Gymnocypris chilianensis Fish15 1.94 8.20 3.24 1.30 2429.15 文献[46] 松潘裸鲤Gymnocypris potanini Fish16 2.80 8.00 4.00 1.15 2520.00 文献[31] 青海湖裸鲤Gymnocypis przewalskii Fish17 2.10 9.05 4.00 1.90 2574.00 文献[30] ●●叶须鱼属Ptychobarbus 双须叶须鱼Ptychobarbus dipogon Fish18 3.80 12.50 5.17 1.37 3360.20 本研究 ●●扁吻鱼属Aspiorhynchus 新疆扁吻鱼Aspiorhynchus laticeps Fish23 1.87 7.50 3.37 1.50 2511.04 文献[34] 新疆扁吻鱼Aspiorhynchus laticeps Fish24 1.60 7.50 2.70 1.10 2000.00 文献[35] ●鲃亚科Barbinae ●●光唇鱼属Acrossocheilus 云南光唇鱼
Acrossocheilus yunnanensisFish25 1.93 7.50 4.05 2.12 2019.00 文献[51] ●●结鱼属Tor 瓣结鱼Tor brevifilis brebifilis Fish26 1.80 6.60 2.60 0.80 1514.80 文献[52] ●●倒刺鲃属Spinibarbus 黑脊倒刺鲃Spinibarbus caldwelli Fish27 2.00 7.40 3.00 1.00 1199.10 文献[53] 注: (1) ED: Egg diameter (mm); LNH: Length of hatched larvae (mm); EDI: Egg diameter after inflation (mm); PA: perivitelline space (mm); AT: accumulated temperature (h·℃); (2)表格中数据是平均值The data in the form are average values 因此, 通过对24种裂腹鱼类和3种鲃亚科鱼类的5种早期发育特征参数的神经网络聚类分析(图 1), 发现鲃亚科鱼类(3种鱼类)与之演化较为接近的裂腹鱼亚科鱼类(裂腹鱼属, 扁吻鱼属)聚为F1、F2两类(不包括裸鲤属鱼类), 此类群较其他裂腹鱼亚科鱼类早期发育具有如下特点: 卵径较小(2 mm左右)、初孵仔鱼长度较短(8 mm左右), 吸水后卵径小(3 mm左右), 卵周隙较大(>1 mm), 总积温较少(2000h·℃左右)。卵径大小对鱼的早期发育和存活具有重要的生物学意义[54], 同一个物种, 小卵死亡率更高, 而大卵具备更高的生存潜力[55]。裂腹鱼类卵径的变化和演化, 是对分布区域自然环境的不断适应。卵径比较小的裂腹鱼类, 其分布海拔较低, 以部分裂腹鱼属鱼类为例, 主要分布在海拔1250—2500 m之内[57], 海拔低, 气候较为温和, 适合卵径较小的裂腹鱼类的发育, 能够保证物种的延续。而卵径比较大的裂腹鱼类, 其分布海拔较高, 以裸裂尻属鱼类和裸鲤属鱼类为例, 主要分布海拔在3750—4750 m内[57], 海拔高, 气候较为恶劣, 大的卵径, 可以提供较多卵黄等营养物质, 从而保证物种的延续。另外一个佐证就是, 卵径最大的一个类别的鱼类(F3), 与其他3个类别存在显著差异(P<0.05), 其初孵仔鱼长度不是最大, 却小于卵径次之的F4的裂腹鱼类(表 4), 可以推断, 为了适应高海拔的恶劣环境, 卵黄一部分作为内源性营养物质进行消化, 另外一部分则用于适应环境的能量消耗。同时, 卵径究竟与早期发育哪些关键参数存在关系? 发现与总积温对数值存在线性相关, 也就是说卵径越大, 总积温越大(图 2), 可以推断, 卵径大的裂腹鱼类, 其自然分布水域的温度较低, 相关数据有待进一步搜集。
![]() 图 1 裂腹鱼亚科与鲃亚科鱼类胚胎发育重要参数SOM聚类a. 根据ward联系方法, 采用欧氏距离进行聚类分析, 分为四类; b. 根据卵径、初孵仔鱼长度、吸水卵径、卵周隙总积温对裂腹鱼亚科与鲃亚科鱼类胚胎发育进行SOM聚类; Fish1—Fish27参见表 3Figure 1. SOM cluster of key parameters of embryonic development about Schizothoracinae fish and Barbinae fishesa. Dendrogram of the hierarchical cluster analysis according to the ward linkage method using Euclidean distance, defining four cluster; b. Classification of embryonic development about Schizothoracinae fish and Barbinae fishes. Based on egg diameter, length of newly hatched larve, egg diameter after inflation, perivitelline space and accumulated temperature; Fish1—Fish27 referred to Tab. 3表 4 基于SOM聚类出四个类别鱼类胚胎发育特征分析Table 4. Characteristics of SOM clusters for four groups fish embryonic development
图 1 裂腹鱼亚科与鲃亚科鱼类胚胎发育重要参数SOM聚类a. 根据ward联系方法, 采用欧氏距离进行聚类分析, 分为四类; b. 根据卵径、初孵仔鱼长度、吸水卵径、卵周隙总积温对裂腹鱼亚科与鲃亚科鱼类胚胎发育进行SOM聚类; Fish1—Fish27参见表 3Figure 1. SOM cluster of key parameters of embryonic development about Schizothoracinae fish and Barbinae fishesa. Dendrogram of the hierarchical cluster analysis according to the ward linkage method using Euclidean distance, defining four cluster; b. Classification of embryonic development about Schizothoracinae fish and Barbinae fishes. Based on egg diameter, length of newly hatched larve, egg diameter after inflation, perivitelline space and accumulated temperature; Fish1—Fish27 referred to Tab. 3表 4 基于SOM聚类出四个类别鱼类胚胎发育特征分析Table 4. Characteristics of SOM clusters for four groups fish embryonic development指标Index F1 F2 F3 F4 卵径Egg diameter (mm) 1.88±0.21b 2.09±0.32b 2.91±0.43a 2.62±0.34a 初孵仔鱼长度Length of hatching after larvae (mm) 7.5±0.6b 8.16±0.58b 10.44±1.39a 10.52±0.82a 吸水卵径Egg diameter after inflation (mm) 2.88±0.23c 3.58±0.38b 4.12±0.5a 3.5±0.3b 卵周隙Perivitelline
space (mm)1±0.11b 1.5±0.38a 1.27±0.13a 0.87±0.14b 总积温Accumulated temperature (h·℃) 1842.54±474.91b 2533.43±501.56a 2587.17±426.83a 2886.24±465.37a SOM聚类 涉及的鱼类 涉及的属 胚胎发育特征 n° F1 Fish1, Fish4, Fish19, Fish24, Fish26, Fish27 裂腹鱼属, 扁吻鱼属, 结鱼属, 倒刺鲃属 卵径小, 初孵仔鱼长度小, 吸水卵径小, 卵周隙适中, 总积温少。 6 F2 Fish3, Fish6, Fish15, Fish17, Fish21, Fish23, Fish25 裂腹鱼属, 裸鲤属, 扁吻鱼属, 光唇鱼属 卵径适中, 初孵仔鱼长度适中, 吸水卵径适中, 卵周隙大, 总积温适中。 7 F3 Fish2, Fish5, Fish10, Fish13, Fish14, Fish16, Fish18 裂腹鱼属, 叶须鱼属, 尖裸鲤属, 裸裂尻鱼属 卵径大, 初孵仔鱼长度适中, 吸水卵径大, 卵周隙适中, 总积温适中。 7 F4 Fish7, Fish8, Fish9, Fish11, Fish12, Fish20, Fish22 裂腹鱼属, 裸裂尻鱼属 卵径适中, 初孵仔鱼长度大, 吸水卵径适中, 卵周隙小, 总积温多。 7 注: n°表示样本数
Note: n°: Number of samples在一定温度范围内, 水温升高可以加快胚胎的发育速度; 相反, 水温降低会减缓胚胎发育速度, 超过温度范围可能引起胚胎发育停滞、畸形或死亡[35, 58, 59]。通常在一定的温度范围内, 温度越高, 发育越快, 但并非总是呈线性增加[43]。因此, 在不影响胚胎正常发育的前提下, 提高孵化的温度, 这对于提高生产效率、降低管理成本和风险、减少疾病感染的机会有着积极的意义[32]。新疆扁吻鱼在适宜温度范围下, 高温(18—21℃)较常温(13—19℃)不仅胚胎发育快(发育速度4倍有余), 而且孵化率高[35]。祁连山裸鲤孵化率随水温升高呈现出先升高后降低的趋势, 畸形率随水温的升高呈现出先降低后升高的趋势[46]。松潘裸鲤的孵化和幼鱼饲养水温不宜超过23℃[31], 而齐口裂腹鱼的孵化水温可高达24℃而不出现异常和畸形[32]。细鳞裂腹鱼在水10.4—22.8℃的条件下能够正常发育[27]。伊犁裂腹鱼自然产卵孵化水温在 18—22℃ 左右, 平均为20℃[41]。
双须叶须鱼卵径在已报道裂腹鱼类卵径最大, 其分布水域海拔从2900 m (林芝县)到4700 m (萨嘎县)均有分布, 我们的调查数据显示, 在水温高于15℃的水域, 就没有该鱼类的分布, 这也是我们控制繁殖水温在10℃的原因所在。
Lake[60]和Matsuura[61]认为在一些鱼类受精卵吸水膨胀后有较大的卵周隙, 可以更好地抗击外界环境的冲击, 提高受精卵的成活率。而卵周隙大小, 直接决定卵的性质, 沉性卵或者漂浮性卵。我们统计发现, 虽然第二类别和第三类别的卵周隙较第一类别和第四类别大, 存在显著差异(P<0.05), 但是裂腹鱼亚科鱼类和鲃亚科鱼类的卵周隙未超过2.0 mm, 而四大家鱼卵周隙均超过了2.0 mm。这也从另外一个角度说明, 裂腹鱼类属沉性卵, 而四大家鱼则属于漂浮性卵。裂腹鱼亚科鱼类区别于鲃亚科的主要形态差异在于肛门和臀鳍基部的两侧各具有一列变形的大鳞片, 称为臀鳞, 其产生与裂腹鱼类适应流水环境繁殖习性有关[57]。裂腹鱼类产卵前, 雄鱼通过尾部的摆动, 以臀鳍和尾鳍在河底掘出小坑, 产出的沉性卵粒便聚集在小坑内进行胚胎发育, 从而避免了被水流冲到河流下游的不适宜环境中去[57]。除裸鲤属鱼类外, 大部分裂腹鱼类产卵集中在3—5月份, 如实验对象双须叶须鱼产卵集中在3月中下旬, 其水域在这个时期恰逢枯水期, 水体较为温和, 相对于底质平坦的浅水滩而言, 沉积在小坑或者鹅卵石缝隙里的裂腹鱼类受精卵在较为稳定水体中发育, 减少了鱼卵被水冲涮和减弱了光线的照射强度。而四大家鱼繁殖期正值涨水季节, 受水流的冲击, 卵周隙大对于卵的保护起着至关重要的作用。
-
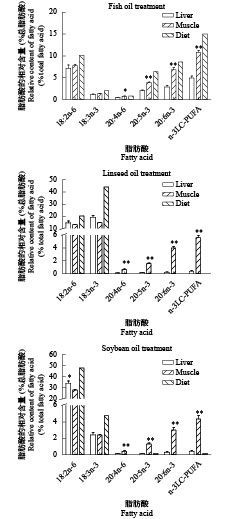
图 1 相同处理组中大黄鱼肝脏、肌肉及饲料的脂肪酸组成(%总脂肪酸)
数据表示为平均值±标准误(n=3), “*”表示差异显著(P<0.05), “**”表示差异极显著(P<0.01)
Figure 1. Fatty acid composition in liver, muscle of large yellow croaker under each diet (% total fatty acid)
Values represent means ± SEM (n=3), * indicated significant difference (P<0.05), ** indicated extremely significant difference (P<0.01)
表 1 实验饲料配方以及化学组成(%干物质)
Table 1 Formulation and chemical proximate composition of the experimental diets (% dry matter)
成分Ingredient 饲料Diet 鱼油组FO 亚麻籽油LO 豆油组SO 酪蛋白Casein 36.80 36.80 36.80 明胶Gelatin 9.20 9.20 9.20 糊精Dextrin 28.00 28.00 28.00 微晶纤维素MCC 3.00 3.00 3.00 α-淀粉α-Starch 6.35 6.35 6.35 卵磷脂Lecithin 2.00 2.00 2.00 维生素Vitamin premix1 2.00 2.00 2.00 无机盐Mineral salt1 2.00 2.00 2.00 抗氧化剂Antioxidant 0.05 0.05 0.05 诱食剂Attractant2 0.30 0.30 0.30 防霉剂Mold inhibitor3 0.10 0.10 0.10 氯化胆碱Choline chloride 0.20 0.20 0.20 鱼油Fish oil 10.00 0.00 0.00 亚麻籽油Linseed oil 0.00 10.00 0.00 豆油Soybean oil 0.00 0.00 10.00 总计Total 100.00 100.00 100.00 营养成分组成(%干物质) Chemical proximate composition (% dry matter) 粗蛋白Crude protein 43.38 43.95 42.57 粗脂肪Crude lipid 11.23 12.08 11.32 注: 1维生素和无机盐混合物参考严晶[19]; 2诱食剂为甘氨酸﹕甜菜碱=1﹕3;3防霉剂为富马酸﹕丙酸钙=1﹕1 Note: 1Vitamin premix and Mineral salt according to Yan [19]; 2Attractant compromise 25% Alycine and 75% Betaine; 3Mold inhibitor compromise 50% Calcium and 50% Fumaric acid 表 2 饲料脂肪酸组成(%总脂肪酸)
Table 2 Diet fatty acids composition (% total fatty acid)
脂肪酸Fatty acid 饲料Diet 鱼油组FO 亚麻籽油LO 豆油组SO 14:0 5.44 0.46 0.60 16:0 21.30 9.26 13.00 18:0 4.54 4.82 4.54 20:0 0.61 — 0.39 ∑SFA 31.89 14.54 18.53 16:1n-7 5.85 — 0.29 18:1n-9 16.56 21.07 26.44 18:1n-7 3.16 — — 20:1n-9 2.53 — 0.41 ∑MUFA 28.10 21.07 27.14 18:2n-6 10.16 20.31 47.92 20:4n-6 0.83 — — ∑n-6PUFA 10.99 20.31 47.92 18:3n-3 2.04 44.08 4.76 20:5n-3(EPA) 6.4 — 0.16 22:6n-3(DHA) 8.64 — — ∑n-3PUFA 17.08 4.92 44.08 n-3/n-6PUFA 1.55 2.17 0.10 ∑n-3LC-PUFA 15.04 — 0.16 DHA/EPA 1.35 — — 注: 较低含量的脂肪酸表中未列出; SFA. 饱和脂肪酸; MUFA. 单不饱和脂肪酸; PUFA. 多不饱和脂肪酸; LC-PUFA. 长链多不饱和脂肪酸; “—”表示未检出 Note: The low level fatty acids are not list on. SFA. Saturated fatty acid; MUFA. Monounsaturated fatty acid; PUFA. Polyunsaturated fatty acid; LC-PUFA. Long chain-Polyun-saturated fatty acid; “—” means not detected 表 3 饲料脂肪酸对大黄鱼生长和饲料利用的影响
Table 3 Effects of dietary lipids on growth and feed utilization of large yellow croaker
项目Item 饲料脂肪源Dietary lipid source 鱼油FO 亚麻籽油LO 豆油SO 初体重Initial weight (g/尾) 15.45±0.04 15.39±0.01 15.42±0.01 终末体重Final weight (g/尾) 40.51±0.43b 37.86±0.6a 37.01±0.59a 增重率WGR (%) 162.29±3.36b 146.04a±4.0 139.98±3.60a 饲料效率FER 0.58±0.01b 0.53±0.01a 0.53±0.02a 特定生长率SGR (%/d) 1.38±0.03b 1.29±0.02a 1.25±0.02a 成活率Survival rate (%) 82.42±0.40b 80.41±0.85ab 79.76±0.88a 肝体指数HSI (%) 1.24±0.05 1.36±0.21 1.78±0.38 脏体指数VSI (%) 6.47±0.28 6.87±0.38 7.14±0.31 注: 值用平均数±标准误表示, 上标相同字母表示差异不显著(P>0.05); 下同 Note: Values represent means ± SEM, the same superscript lowercase letter indicated no significant difference (P>0.05); the same applies below 表 4 饲料脂肪源对大黄鱼肝脏和肌肉脂肪酸组成的影响(%总脂肪酸)
Table 4 Effect of dietary lipids on liver and muscle fatty acid composition of large yellow croaker (% total fatty acid)
脂肪酸Fatty acid 肝脏Liver 肌肉Muscle FO LO SO FO LO SO 14:0 2.84±0.14b 0.81±0.11a 0.85±0.12a 3.30±0.16b 2.10±0.03a 1.94±0.13a 16:0 24.00±0.51b 8.97±0.25a 10.56±1.57a 24.13±0.44b 18.17±0.03a 17.63±0.10a 18:0 8.00±0.49 8.24±1.49 8.03±1.30 6.65±0.26ab 7.34±0.28b 6.35±0.21a 20:0 0.24±0.01b 0.18±0.02a 0.23±0.02ab 0.42±0.02b 0.39±0.02ab 0.35±0.02a ∑SFA2 35.09±0.26b 18.21±1.69a 19.68±2.18a 34.50±0.58c 28.00±0.29b 26.26±0.10a 16:1n-7 9.47±0.16b 3.64±0.56a 3.02±0.60a 6.88±0.21b 3.83±0.17a 3.66±0.18a 18:1n-9 28.46±0.94a 37.68±2.86b 34.79±1.09ab 22.21±0.45a 24.31±0.82ab 26.90±0.99b 18:1n-7 2.74±0.02c 1.37±0.05a 1.62±0.01b 2.79±0.08 — — 20:1n-9 2.00±0.01b 0.98±0.06a 0.80±0.08a 2.25±0.09c 1.69±0.02b 1.32±0.08a ∑MUFA3 42.67±1.00 43.67±3.48 40.23±1.63 34.13±0.55b 30.54±0.77a 32.59±0.16b 18:2n-6(LA) 7.16±0.76a 14.63±1.59b 34.25±1.89c 7.80±0.23a 13.21±0.28b 28.09±0.58c 20:4n-6(ARA) 0.47±0.05b 0.11±0.02a 0.13±0.03a 0.76±0.09b 0.67±0.08ab 0.45±0.06a ∑n-6PUFA4 7.63±0.78a 14.75±1.61b 34.39±1.93c 8.56±0.23a 13.87±0.35b 28.54±0.53c 18:3n-3(LNA) 1.18±0.09a 19.25±1.62b 2.43±0.27a 1.34±0.08a 14.90±0.42c 2.40±0.08b 20:5n-3(EPA) 2.03±0.13b 0.16±0.03a 0.14±0.02a 3.92±0.09b 1.60±0.07a 1.34±0.09a 22:6n-3(DHA) 2.89±0.37b 0.26±0.08a 0.16±0.01a 6.85±0.46b 3.99±0.26a 3.01±0.35a ∑n-3PUFA 6.10±0.53a 19.67±1.65b 2.86±0.12a 12.11±0.39b 20.48±0.34c 6.75±0.37a n-3/n-6PUFA 0.81±0.09b 1.37±0.18c 0.08±0.01a 1.42±0.06b 1.48±0.04b 0.24±0.02a ∑n-3LC-PUFA5 4.92±0.49b 0.41±0.08a 0.43±0.15a 10.77±0.46b 5.58±0.31a 4.35±0.44a DHA/EPA 1.41±0.11 1.68±0.11 1.91±0.66 1.75±0.12a 2.50±0.13b 2.24±0.11b 注: “—”表示未检出 Note: “—”means not detected -
[1] Norman S J, Burton L, Hee-Yong K, et al. Mechanisms of action of docosahexaenoic acid in the nervous system [J]. Lipids, 2001, 36(9): 945—959
[2] Ans E, Saskia O, Peter L Z, et al. Effects of n-3 long chain polyunsaturated fatty acid supplementation on visual and cognitive development throughout childhood: a review of human studies [J]. Prostaglandins Leukot Essent Fatty Acids, 2007, 76: 189—203
[3] Torrejon C, Jung U J, Deckelbaum R. Deckelbaum R J. n-3 fatty acids and cardiovascular disease: actions and molecular mechanisms [J]. Prostaglandins Leukot Essent Fatty Acids, 2007, 77: 319—326
[4] A Leaf, Kang J X. Prevention of cardiac sudden death by N-3 fatty acids: a review of the evidence [J]. Journal of Internal Medicine, 1996, 240(1): 5—12
[5] Rebecca W, R Paul R, Gerald F F. Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids [J]. Nutrition Reviews, 2010, 68(5): 280—289
[6] Philip C C. Immunomodulation by omega-3 fatty acids [J]. Prostaglandins Leukot Essent Fatty Acids, 2007, 77(5—6): 327—335
[7] Turchini G M, Torstensen B E, Ng W K. Fish oil replacement in finfish nutrition [J]. Reviews in Aquaculture, 2009, 1(1): 10—57
[8] Izquierdo M S, Watanabe T, Takeuchi T, et al. Requirement of larval red seabream Pagrus major for essential fatty acids [J]. NIppon suisan Gakkaishi, 1989, 55(5): 859—867
[9] Lee S M, Cho S. Influences of dietary fatty acid profile on growth, body composition and blood chemistry in juvenile fat cod (Hexagrammos otakii Jordan et Starks) [J]. Aquaculture Nutrition, 2009, 15(1): 19—28
[10] Kanazawa A, Teshima S I, Ono K. Relationship between essential fatty acid requirements of aquatic animals and the capacity for bioconversion of linolenic acid to highly unsaturated fatty acids [J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1979, 63: 295—298
[11] Tocher D R, Bell J G, McGhee F, et al. Effects of dietary lipid level and vegetable oil on fatty acid metabolism in Atlantic salmon (Salmo salar L.) over the whole production cycle [J]. Fish Physiology and Biochemistry, 2003, 29(3): 193—209
[12] Li S L, Monroig Ó, Navarro J C, et al. Molecular cloning and functional characterization of a putative Elovl4 gene and its expression in response to dietary fatty acid profiles in orange-spotted grouper Epinephelus coioides [J]. Aquaculture Research, 2015: 1—16002E
[13] Takayuki Y N, He W S, Tang C R, et al. The E-box like sterol regulatory element mediates the suppression of human D-6 desaturase gene by highly unsaturated fatty acids [J]. Biochemical and Biophysical Research Communications, 2002, 296: 111—117
[14] Tocher D R, Dick J R. Polyunsaturated fatty acid metabolism in a cell culture model of essential fatty acid deficiency in a freshwater fish, carp (Cyprinus carpio) [J]. Fish Physiology and Biochemistry, 1999, 21(3): 257—267
[15] Tocher D R, Bell J G, MacGlaughlin P, et al. Hepatocyte fatty acid desaturation and polyunsaturated fatty acid composition of liver in salmonids: effects of dietary vegetable oil [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2001, 130(2): 257—270
[16] Leaver M J, Villeneuve L AN, Obach A, et al. Functional genomics reveals increases in cholesterol biosynthetic genes and highly unsaturated fatty acid biosynthesis after dietary substitution of fish oil with vegetable oils in Atlantic salmon (Salmo salar) [J]. BMC Genomics, 2008, 9(1): 1
[17] Zheng X Z, Tocher D R, Dickson C A, et al. Highly unsaturated fatty acid synthesis in vertebrates: new insights with the cloning and characterization of a Δ6 desaturase of atlantic salmon [J]. Lipids, 2005, 40(1): 13—24
[18] 董小敬. 虹鳟、花鲈和大黄鱼Δ6脂肪酸去饱和酶调控差异的研究. 博士学位论文, 中国海洋大学, 青岛. 2015 Dong X J. Comparison study on regulation of Δ6 fatty acyl desaturase among rainbow trout, Japanese seabass and large yellow croaker [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2015
董小敬. 虹鳟、花鲈和大黄鱼Δ6脂肪酸去饱和酶调控差异的研究. 博士学位论文, 中国海洋大学, 青岛. 2015[19] 严晶. 饲料脂肪水平和脂肪酸种类对大黄鱼脂肪沉积的影响. 博士学位论文, 中国海洋大学, 青岛. 2015 Yan J. Effects of dietary lipid levels and types of fatty acids on lipid deposition in large yellow croaker (Larmichthys crocea) [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2015
严晶. 饲料脂肪水平和脂肪酸种类对大黄鱼脂肪沉积的影响. 博士学位论文, 中国海洋大学, 青岛. 2015[20] 李松林. n-3 LC-PUFA对大黄鱼肝脂沉积及脂肪酸延长酶表达的调控. 博士学位论文, 中国海洋大学, 青岛. 2016 Li S L. The regulation of n-3LC-PUFA on lipid deposition and the expression of fatty acid elongases of large yellow croaker (Larimichthys crocea) [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2016
李松林. n-3 LC-PUFA对大黄鱼肝脂沉积及脂肪酸延长酶表达的调控. 博士学位论文, 中国海洋大学, 青岛. 2016[21] 高坚, 李洋, 叶伟钊, 等. 不同脂肪源对泥鳅的生长性能及脂肪酸组成的影响. 水生生物学报, 2016, 40(1): 1—9 Gao J, Li Y, Ye W Z, et al. The growth performance and the fatty acid composition of dojo loach Misgurnus anguillicaudatus fry fed with different lipid sources [J]. Acta Hydrobiologica Sinica, 2016, 40(1): 1—9
高坚, 李洋, 叶伟钊, 等. 不同脂肪源对泥鳅的生长性能及脂肪酸组成的影响. 水生生物学报, 2016, 40(1): 1—9[22] 菜籽油替代鱼油对大菱鲆幼鱼生长、脂肪酸组成及脂沉积的影响. 动物营养学报, 2015, 27(3): 756—765 Peng M, Xu W, Mai K S, et al. Growth, fatty acid composition and lipid deposition of juvenile turbot (Scophthalmus maximus L.) fed diets with fish oil replacement by rapeseed oil [J]. Chinese Journal of Animal Nutrition, 2015, 27(3): 756—765
菜籽油替代鱼油对大菱鲆幼鱼生长、脂肪酸组成及脂沉积的影响. 动物营养学报, 2015, 27(3): 756—765[23] 罗琳, 邢薇, 李铁梁, 等. 亚麻油替代鱼油对杂交鲟生长、脂肪酸组成及脂肪代谢的影响. 水生生物学报, 2017, 41(5): 1010—1019 Luo L, Xing We, Li T L, et al. Growth performance, fatty acid composition, and lipid metabolism in juvenile hybrid sturgeon (Acipenser schrenckⅡ brandt♀×A. Baeri brandt♂) fed diets of fish oil substituted by various levels of linseed oil [J]. Acta Hydrobiologica Sinica, 2017, 41(5): 1010—1019
罗琳, 邢薇, 李铁梁, 等. 亚麻油替代鱼油对杂交鲟生长、脂肪酸组成及脂肪代谢的影响. 水生生物学报, 2017, 41(5): 1010—1019[24] Xu H G, Dong X J, Ai Q H, et al. Regulation of tissue LC-PUFA contents, Δ6 fatty acyl desaturase (FADS2) gene expression and the methylation of the putative FADS2 gene promoter by different dietary fatty acid profiles in Japanese seabass (Lateolabrax japonicus) [J]. PloS One, 2014, 9(1): e87726
[25] 孟玉琼, 苗新, 孙瑞健, 等. 双低菜粕高水平替代饲料鱼粉对大黄鱼潜在风险的评估: 生长、健康和营养价值. 水生生物学报, 2017, 41(1): 127—138 Meng Y Q, Miao X, Sun R J, et al. Potential risks of high level replacement of dietary fish meal by canola meal on large yellow croaker Larimichthys crocea (RICHARDSON, 1846): growth, health and nutritional values as a food fish [J]. Acta Hydrobiologica Sinica, 2017, 41(1): 127—138
孟玉琼, 苗新, 孙瑞健, 等. 双低菜粕高水平替代饲料鱼粉对大黄鱼潜在风险的评估: 生长、健康和营养价值. 水生生物学报, 2017, 41(1): 127—138[26] Zheng X Z, Torstensen B D, Dick J, et al. Environmental and dietary influences on highly unsaturated fatty acid biosynthesis and expression of fatty acyl desaturase and elongase genes in liver of Atlantic salmon (Salmo salar) [J]. Biochimica Et Biophysica Acta, 2005, 1734(1734): 13—24
[27] Piedecausa M A, Mazón M J, García B G, et al. Effects of total replacement of fish oil by vegetable oils in the diets of sharpsnout seabream (Diplodus puntazzo) [J]. Aquaculture, 2007, 263(1–4): 211—219
[28] 王骥腾, 姜宇栋, 杨云霞, 等. 豆油替代鱼油对赤点石斑鱼(Epinephelus akaara)生长、体组成及体脂肪酸组成的影响. 海洋与湖沼, 2016, 47(3): 640—646 Wang J T, Jiang Y D, Yang Y X, et al. Effects of dietary fish oil replacement by soybean oil on growth performance, body composition and body fatty acid composition of red spotted grouper Epinephelus akaara [J]. Oceanologia et Limnologia Sinica, 2016, 47(3): 640—646
王骥腾, 姜宇栋, 杨云霞, 等. 豆油替代鱼油对赤点石斑鱼(Epinephelus akaara)生长、体组成及体脂肪酸组成的影响. 海洋与湖沼, 2016, 47(3): 640—646[29] Bell J G, Tocher D R, Henderson R J, et al. Altered fatty acid compositions in atlantic salmon (Salmo salar) fed diets containing linseed and rapeseed oils can be partially restored by a subsequent fish oil finishing diet [J]. The Journal of Nutrition, 2003, 133(9): 2793—2801
[30] Turchini G M, Francis D S. Fatty acid metabolism (desaturation, elongation and beta-oxidation) in rainbow trout fed fish oil- or linseed oil-based diets [J]. British Journal of Nutrition, 2009, 102(1): 69—81
[31] Tocher D R, Fonseca-Madrigal J, Bell J G, et al. Effects of diets containing linseed oil on fatty acid desaturation and oxidation in hepatocytes and intestinal enterocytes in Atlantic salmon (Salmo salar) [J]. Fish Physiology & Biochemistry, 2002, 26(2): 157—170
[32] 左然涛. 饲料脂肪酸调控大黄鱼免疫力和脂肪代谢的初步研究. 博士学位论文, 中国海洋大学, 青岛. 2013 Zuo R T. Preliminary study about regulation of dietary fatty acid on immunity and fatty acid metabolism in large yellow croaker (Larmichthys crocea) [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2013
左然涛. 饲料脂肪酸调控大黄鱼免疫力和脂肪代谢的初步研究. 博士学位论文, 中国海洋大学, 青岛. 2013[33] Izquierdo M S, Robaina L, Juárez-Carrillo E, et al. Regulation of growth, fatty acid composition and delta 6 desaturase expression by dietary lipids in gilthead seabream larvae (Sparus aurata) [J]. Fish Physiology andBiochemistry, 2008, 34(2):117—127
[34] Kennedy S R, Leaver, M J, Campbell P J, et al. Influence of dietary oil content and conjugated linoleic acid (CLA) on lipid metabolism enzyme activities and gene expression in tissues of Atlantic salmon (Salmo salar L.) [J]. Lipids, 2006, 41(5): 423—436
-
期刊类型引用(5)
1. 郭祉宾,杨德国,陈亮,颜文斌,朱挺兵. 雅鲁藏布江中游仔稚鱼种类组成与分布特征. 淡水渔业. 2024(02): 13-22 .  百度学术
百度学术
2. 李文康,骆小年,段友健,李姣,吴晨. 鸭绿沙塘鳢仔稚鱼发育观察及饥饿不可逆点的确定. 大连海洋大学学报. 2023(01): 32-42 .  百度学术
百度学术
3. 石叶忠,朱双全,潘月,申屠琰,冯彬彬,程鑫,张克鑫,朱卫东,夏荣兴,张玉明,竺俊全. 宽鳍鱲胚胎发育研究. 浙江海洋大学学报(自然科学版). 2022(04): 308-314 .  百度学术
百度学术
4. 韩军军,贺疆滔,陈朋,胡江伟,祁峰,封永辉,蔡林钢,时春明,张人铭. 扁吻鱼胚胎发育及仔稚鱼形态与生长观察研究. 南方水产科学. 2021(01): 59-66 .  百度学术
百度学术
5. 陈军平,沈方方,武慧慧,张佳鑫,于若梦,付永杰,谢国强,赵道全. 我国鱼类胚胎发育研究进展. 江苏农业科学. 2021(17): 45-52 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: