EFFECTS OF EXOGENOUS FATTY ACID ON THE PROLIFERATION AND DIFFERENTIATION OF NILE TILAPIA PREADIPOCYTES
-
摘要: 为了探究脂肪酸对罗非鱼(Oreochromis niloticus)脂肪细胞增殖和分化的影响, 在体外培养罗非鱼前脂肪细胞, 并在其增殖和分化过程中分别添加100 μmol/L的棕榈酸(Palmitic Acid, PA)、油酸(Oleic Acid, OA), 亚油酸(Linoleic Acid, LA)和α-亚麻酸(α-Linolenic Acid, LNA)进行处理。使用SRB (Sulforhodamine B)染色法和油红O染色法检测外源性脂肪酸对脂肪细胞增殖和分化的影响, Real-time qPCR检测增殖分化过程中基因表达情况。结果显示, 在培养8d时, 外源添加的不饱和脂肪酸可以促进罗非鱼前脂肪细胞增殖, 并且增殖过程中增殖相关基因(c-fos和c-myc)、脂解相关基因(ATGL)和脂合成相关基因(PPARγ和CD36)的表达与对照组相比均显著提高(P<0.05)。此外, 外源脂肪酸的加入可以抑制脂肪细胞的分化。棕榈酸的加入使得脂肪细胞中产生的脂滴面积较少, 数量较多; 分化过程中细胞的β氧化相关基因(CPT-1a)与对照组相比显著上调, 而脂解相关基因(ATGL)则显著下调。外源性不饱和脂肪酸可以促进罗非鱼前脂肪增殖, 而饱和脂肪酸主要抑制细胞分化。在增殖过程中, 过量的脂肪酸先通过脂合成储存在胞内, 再借助脂解等途径进行代谢, 从而帮助细胞适应环境中高浓度的脂肪酸。而在分化过程中, 添加外源脂肪酸, 可能通过抑制脂肪细胞内的脂合成和脂解的发生, 同时促进β氧化等方式来抑制脂肪细胞分化。Abstract: To investigate the effects of fatty acids on the proliferation and differentiation of preadipocytes from Nile tilapia (Oreochromis niloticus), 100 μmol/L Palmitic acid (PA), Oleic acid (OA), Linoleic acid (LA) and α-Linolenic acid (LNA) were used. SRB (Sulforhodamine B) staining and oil red O staining were used to detect cell proliferation and preadipocyte differentiation. The expression level of genes related to proliferation and differentiation was detected by Real-time qPCR. The results showed that exogenous fatty acids promoted the preadipocyte proliferation in 8 days, and significantly increased the expression level of proliferation related genes (c-fos and c-myc), lipolysis related genes (ATGL) and adipogenesis related genes (PPAR, CD36 and FAS) (P<0.05). In addition, fatty acid inhibited preadipocyte differentiation into adipocyte by decreasing lipid droplets area and increasing the lipid droplets number. During differentiation, expression level of β-oxidation related gene (CPT-1a) significantly increased (P<0.05), while the expression level of lipolysis related genes (ATG) and adipogenesis related genes (PPARγ and FAS) declined. Our results showed that exogenous fatty acid promoted the proliferation and inhibited preadipocyte differentiation. In the process of proliferation, excess fatty acids stored in the preadipocyte that could be metabolized by lipolysis and β-oxidation during adipogenesis to help cells adapt to high concentrations of fatty acids in the environment. While during the differentiation, the exogenous fatty acids can inhibit adipogenesis and lipolysis of adipocyte and promote β-oxidation to reduce adipocyte differentiation.
-
Keywords:
- Tilapia /
- Adipocyte /
- Fatty acid /
- Proliferation /
- Differentiation
-
高脂饲料虽然在一定程度上可以起到促进鱼体增长, 节约蛋白的作用, 但也带来了鱼体脂肪堆积, 免疫力下降[1]等问题, 严重制约了水产养殖的可持续发展[2]。因此, 研究鱼类的脂代谢过程, 改善养殖鱼的脂肪沉积情况, 已成为当前鱼类营养生理学研究的热点。众所周知, 脂肪组织沉积主要是由于脂肪细胞增生(增殖)和脂肪细胞肥大(分化)造成的[3]。因而, 脂肪细胞体外培养技术的建立对于鱼类脂代谢研究具有重要的意义。与哺乳动物相比, 鱼类细胞体外培养的研究工作起步较晚。鱼类脂肪细胞体外培养更是近几年才展开。迄今为止, 国外主要进行了虹鳟(Oncorhynchus mykiss)[4]、大黄鱼(Larimichthys crocea)[5]和真鲷(Pagrosomus major)[6, 7]等脂肪细胞培养的研究, 国内主要是吉红等[8]于2009年建立了草鱼脂肪细胞体外培养模型。
脂肪酸对脂肪细胞增殖分化的影响主要集中在哺乳动物上。研究人员发现DHA可以促进人体脂肪细胞中甘油的释放; 而3T3-L1的脂代谢又受到EPA的调控。Azain等[9]的研究表明, 共轭亚油酸可以对小鼠脂肪细胞起到促进增殖, 抑制分化的作用。相比较来说, 脂肪酸对鱼类脂肪细胞增殖与分化影响的研究相对较少。目前已见报道的是, n-3系不饱和脂肪酸可以调控草鱼脂肪细胞脂解, 并且这一过程与脂解相关基因和炎症基因的表达有关[10]。而脂肪酸对罗非鱼(Oreochromis niloticus)脂肪细胞增殖和分化影响的研究尚未见报道。
本文首次建立了罗非鱼脂肪细胞体外培养模型, 为研究罗非鱼脂代谢提供了新的技术和方法。在脂肪细胞增殖和分化过程中, 分别加入100 μmol/L的棕榈酸(PA)、油酸(OA)、亚油酸(LA)和亚麻酸(LNA), 分析比较外源性脂肪酸对罗非鱼脂肪细胞增殖和分化的影响。
1. 材料与方法
1.1 材料
仪器与试剂 仪器: 酶标仪(BIO-TEK), 普通PCR仪(My-Cycler, BIO-RAK), qPCR仪(CFX Connect, BIO-RAD), 微量紫外分光光度计(Thermo Nanodrop 2000), 全自动样品快速研磨仪(上海净信科技有限公司), 冷动离心机(Eppendorf centrifuge 5415R), SW-CJ-2FD型双人单面净化工作台(苏州净化设备有限公司), 荧光倒置显微镜(日本Nikon)。
主要试剂: DMEM/F12, 100×双抗母液(10000 U/mL青霉素和10000 μg/mL链霉素), 1 mg/mL胰岛素, 胎牛血清(FBS): 美国Gibco公司; 牛血清白蛋白(BSA), Ⅱ型胶原酶, Krebs-Henseleit, 二甲基亚砜(DMSO), 棕榈酸(PA), 油酸(OA), 亚油酸(LA), α-亚麻酸(LNA): 美国Sigma公司; 吲哚美辛(Indomethacin), 地塞米松(Dexamethasone), 3-异丁基-1-甲基黄嘌呤(3-Isobutyl-1-methylxanthine), 油红O干粉, 异丙醇, 甲醛: 大连美伦生物技术有限公司。
实验材料 实验所用的罗非鱼购自上海市闵行区沧源水产市场, 体重约700—900 g。选择体质健壮, 游动活泼, 腹部饱满的罗非鱼作为实验鱼。
主要试剂的配制 (1)脂肪酸配制: 4种脂肪酸用无水乙醇稀释配制成100 mmol/L的母液, 并于–20℃保存备用。(2)消化液: 称取50 mg Ⅱ型胶原酶, 加入0.5 g牛血清白蛋白融入50 mL不含血清的DMEM/F12培养基中。(3)诱导剂配制: 吲哚美辛: 称取一定量吲哚美辛溶于DMSO致终浓度为0.2 mmol/L, –20℃保存备用。地塞米松: 称取一定量地塞米松溶于DMSO致终浓度为1 mmol/L, –20℃保存备用。3-异丁基-1-甲基黄嘌呤: 称取一定量3-异丁基-1-甲基黄嘌呤溶于DMSO致终浓度为0.5 mmol/L, –20℃保存备用。(4)诱导培养基成分: 诱导培养基1: 用15%FBS-DMEM/F12培养基配制终浓度为15 μg/mL胰岛素、0.2 μmol/L吲哚美辛、1 μmol/L地塞米松以及0.5 μmol/L 3-异丁基-1-甲基黄嘌呤的诱导培养; 诱导培养基2: 用15%FBS-DMEM/F12培养基配制终浓度为15 μg/mL胰岛素的诱导培养基; 诱导培养基3: 15%FBS-DMEM/F12培养基。(5)油红O: 称取0.5 g油红O粉末溶于100 mL异丙醇中配成5 g/L的母液, 置于4℃避光长期保存, 用时以母液与水体积比为3﹕2稀释过滤后为工作液备用。
1.2 方法
罗非鱼脂肪细胞体外培养及分化模型的建立 无菌分离出罗非鱼腹腔脂肪组织, 于Krebs-Henseleit缓冲液(1% BSA)中剪碎并加入消化液, 28℃水浴震荡消化1.5h。分离除去结缔组织, 1000 r/min离心5—10min, 弃上清。用DMEM/F12缓冲液(1% BSA, pH 7.4), 洗3遍。裂解去除红细胞之后, 加入15%FBS-DMEM/F12培养基重悬剩余的细胞, 并接种到细胞板中, 密度为(2—3)×105个/mL, 28℃, 在5%CO2条件下培养7d细胞即可长至汇合阶段, 更换诱导培养基, 进行诱导分化。在诱导过程中, 先用诱导培养基1培养4d (第4天); 之后更换诱导培养基2继续培养4d (第8天); 最后更换诱导培养基3培养4d (第12天), 分化结束。诱导期间每2天换1次液。
脂肪酸对前脂肪细胞增殖的影响 将前脂肪细胞(2—3)×105个/mL培养在96孔板中, 添加100 μmol/L的PA、OA、LA、LNA检测脂肪酸对细胞增殖的影响。同时在增殖培养基中添加1%BSA以保护细胞。对照组添加等体积的无水乙醇与等质量的BSA。在培养的第2、第4、第6、第8天, 借助SRB方法检测细胞增殖情况。具体方法为, 用50% (v/v) TCA (三氯乙酸)固定细胞。加入0.4% (w/v) SRB溶液对细胞中的蛋白进行染色。之后加入100 μL的10 mmol/L Tris溶解细胞中的染料。读取515 nm处的吸光度值(Optical Density)。每个处理4个重复, 实验重复3次; 通过SRB实验确定对脂肪细胞的增殖影响后, qPCR检测脂代谢及增殖相关基因的表达。
脂肪酸对前脂肪细胞分化的影响 将前脂肪细胞(2—3)×105个/mL培养在48孔板中, 培养1周后进行诱导分化: 分别添加100 μmol/L的PA、OA、LA、LNA作用12d (第0至第12天), 每次换液均补充等量脂肪酸。分化结束用油红O染色检测罗非鱼脂肪细胞分化情况, 用Image Pro Plus6.0(IPP 6.0)测量胞内脂滴的数量和面积。qPCR检测分化过程中脂代谢基因的表达水平。
油红O染色 用4%的甲醛固定细胞, 60%异丙醇(v/v)润洗并晾干。加入油红O染料静置10min, 弃去油红O, 充分用清洗残余的染料。晾干, 加入200 μL的超纯水, 最后将细胞于显微下观察染色情况并拍照。
为了对以上的染色结果进行定量分析, 拍照后将细胞晾干, 加入100%异丙醇溶解油红O染料, 500 nm处用100%异丙醇调零检测吸光度值。
Real-time qPCR 操作方法 将前脂肪细胞(5—6)×105个/mL培养在6孔板中, 培养1周后进行诱导分化, 每次换液均补充等量脂肪酸。分化结束收后收集细胞, 使用Trizol法提取总RNA, 微量紫外分光光度计检测RNA纯度后, 保存在–80℃中。使用Prime Script RT Reagent Kit (Takara)试剂盒反转得到cDNA, 具体方法参考说明书。在NCBI上查找相应基因序列, 用primer 5.0设计引物, 由铂尚生物技术(上海)有限公司合成引物。引物设计如表 1所示。根据试剂盒说明书进行Real-time qPCR, 以β-actin为内参。
表 1 罗非鱼脂肪细胞增殖分化相关基因表达所用引物Table 1. Primers used in quantitative PCR引物名称
Primer引物序列
Sequence (5′—3′)c-fos ACACCACATTCAGCAAGAGGA
GCCACGAGTAGCAGAACCTc-myc GTATGAGTGGAAGGAGCGTCTA
CGGCGGTAGGTGATGTAGATCPT-1a TTTCCAGGCCTCCTTACCCA
TTGTACTGCTCATTGTCCAGCAGACPT-1b AAGGGACGTTACTTCAAGGTG
TCCGACTTGTCTGCCAAGATFAS TCATCCAGCAGTTCACTGGCATT
TGATTAGGTCCACGGCCACAATGL AAAACGTCCTGGTGACCCAGT
TAGGAGGAATGATGCCACAGTACAHSL AACCTGGATGTCCATTTCTGGAAG
TCGGTTTACCTTGACTTGAGTGGAMGL ACATCGTCAACGCAGACGGATT
CACAATGTTCCCCAGCTCCATCD36 ATCTTCGAACCATCCATGTCAGTG
GATATGTGATGCTGGAGGAAGCAAPPARγ TGGACTACACAAACATGCACAGC
CACGGGACTATCTGAGTACTGTGGAβ-actin CAGGATGCAGAAGGAGATCACA
CGATCCAGACGGAGTATTTACG采用公式处理qPCR结果: 目的基因mRNA相对表达量=2–ΔΔCt, 其中ΔΔCt=[Ct (目的基因)–Ct (β-actin)]。
1.3 数据统计分析
实验结果用平均值±标准差(Mean±SD)(n=3)来表示。使用SPSS19.0对数据进行单因素方差分析(one-way ANOVA)用于揭示不同脂肪酸处理对细胞影响的差异, 字母(a、b、c)表示不同脂肪酸处理组之间存在显著性差异(P<0.05)。Studentt test用于检测脂肪酸处理组与对照组之间的差异, * 表示脂肪酸处理组与对照组之间存在显著性差异(P<0.05)。
2. 结果
2.1 罗非鱼腹腔脂肪细胞的增殖及分化过程中的形态学观察
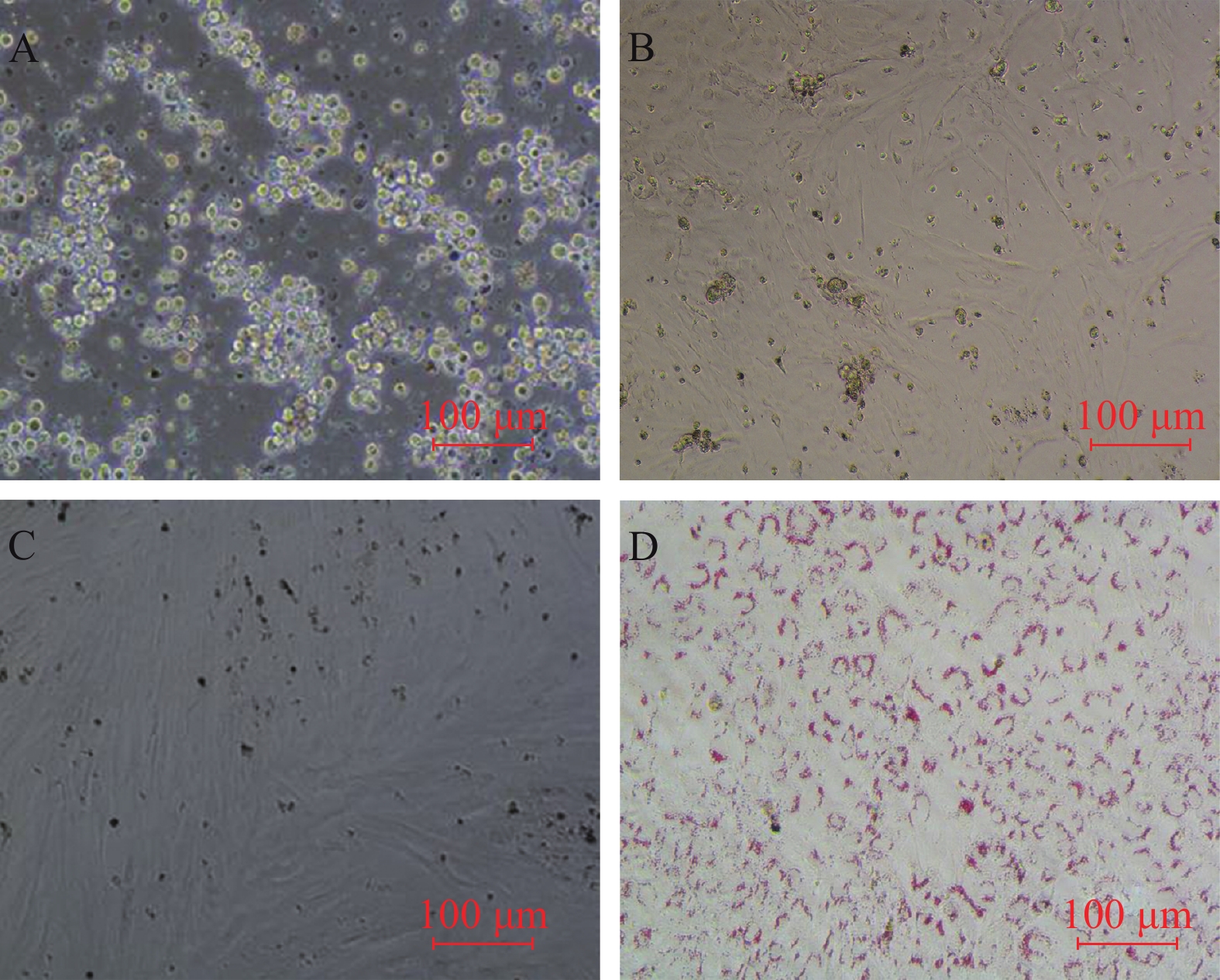
如图 1所示, 刚接种贴壁的罗非鱼前脂肪细胞呈现透明圆形, 胞内无明显脂滴, 均匀分散在细胞板底部, 具有增殖和分化功能。中性脂肪细胞中脂滴明显, 无增殖功能, 在培养过程中, 会因通过裂解而分离出去(图 1A)。前脂肪细胞增殖培养3d, 形态发生变化并呈现梭形, 占据细胞板底一半的面积(图 1B)。培养7d后, 细胞边缘模糊, 增殖的脂肪细胞铺满整个细胞板底, 中性脂肪细胞大量减少(图 1C)。对细胞进行诱导分化, 12d后诱导结束, 进行油红O染色, 对细胞内的脂滴进行染色观察。镜下可见胞内被染为红色的清晰脂滴(图 1D)。
![]() 图 1 脂肪细胞增殖及分化过程中的形态变化A. 开始贴壁的细胞; B. 培养3d细胞呈现不规则的梭形; C. 培养7d细胞铺满整个板底; D. 诱导培养12d油红O染色的细胞Figure 1. Morphology of preadipocyte and differentiated adipocytesA. Adherent cell; B. The cell began changing into unregulation shape of fusiform at day 3; C. The cells covered the entire bottom plate at day 7; D. Morphology of adipocytes at day 12 stained with oil red O
图 1 脂肪细胞增殖及分化过程中的形态变化A. 开始贴壁的细胞; B. 培养3d细胞呈现不规则的梭形; C. 培养7d细胞铺满整个板底; D. 诱导培养12d油红O染色的细胞Figure 1. Morphology of preadipocyte and differentiated adipocytesA. Adherent cell; B. The cell began changing into unregulation shape of fusiform at day 3; C. The cells covered the entire bottom plate at day 7; D. Morphology of adipocytes at day 12 stained with oil red O2.2 不同脂肪酸对罗非鱼脂肪细胞增殖水平的影响
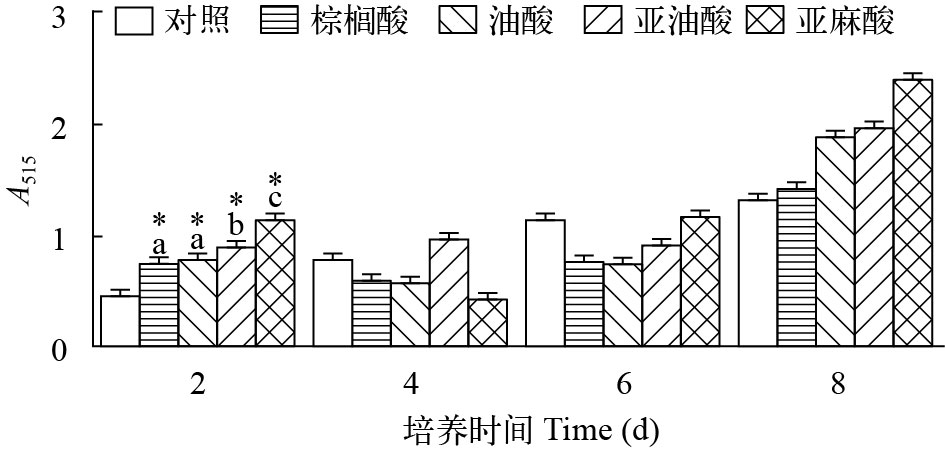
本实验采用SRB染色法检测外源性脂肪酸对罗非鱼脂肪细胞增殖的影响。如图 2所示, 4种脂肪酸在实验浓度条件下(100 μmol/L)对脂肪细胞的增殖起到不同程度的影响。由于在培养1周之后细胞数量处于相对稳定的状态, 所以我们检测脂肪酸处理8d后细胞的增殖情况, 结果表明, 不饱和脂肪酸(OA、LA、LNA)对脂肪细胞的促增殖作用较为显著, 饱和脂肪酸(PA)的促增殖能力较低。其中100 μmol/L的LNA对脂肪细胞的增殖效果最为明显。
2.3 不同脂肪酸对脂肪细胞增殖和脂代谢相关基因表达的影响
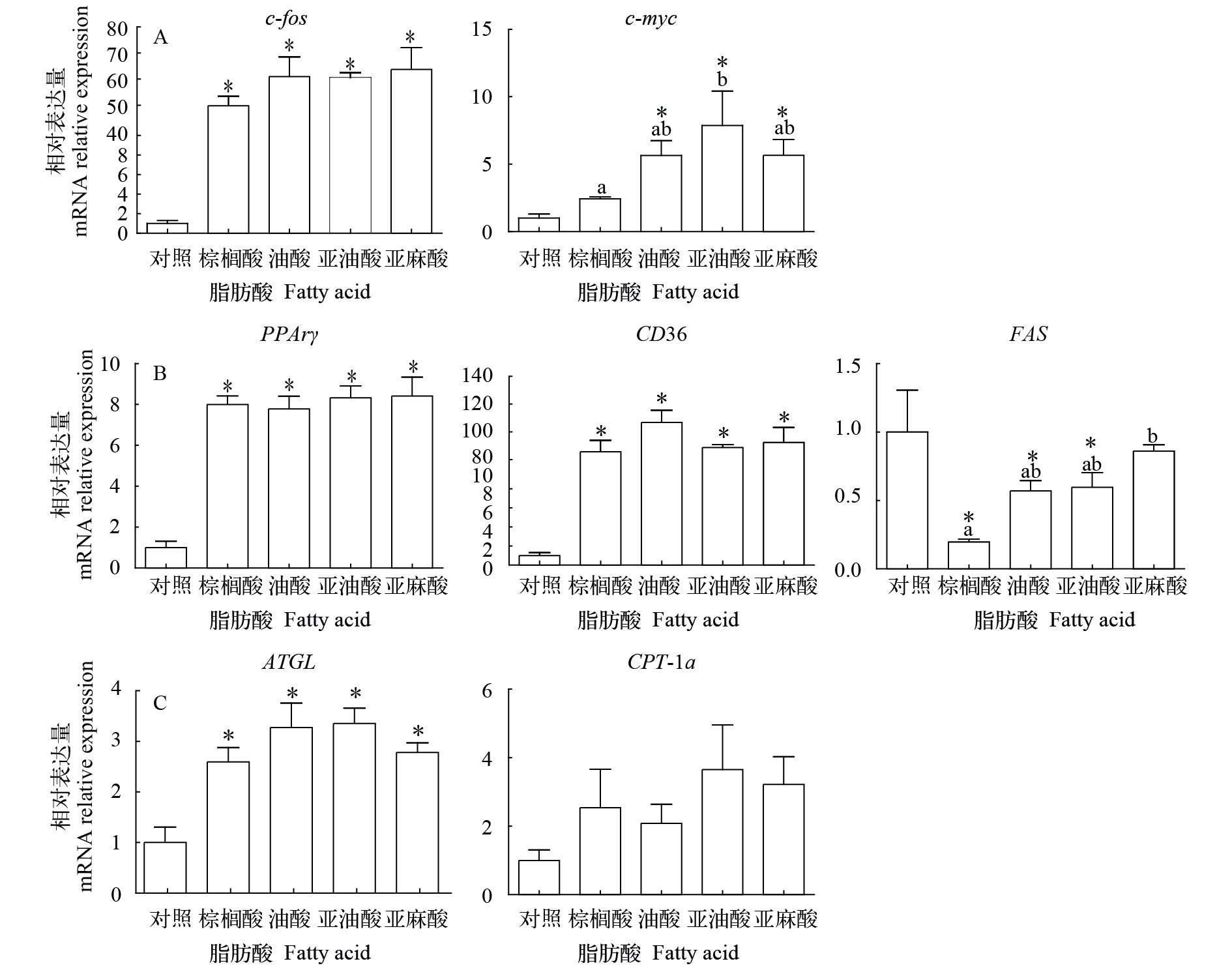
如图 3所示, 培养8d后, 细胞增殖相关基因, c-myc和c-fos的表达显著性增高(P<0.05), 即细胞处于增殖活跃状态, 并且不饱和脂肪酸如油酸, 亚油酸和亚麻酸对前脂肪细胞的促增殖作用优于棕榈酸; 脂合成相关基因PPARγ和CD36的表达上调; 而脂肪酸合成基因FAS的表达下调, 且下调幅度随着脂肪酸不饱和程度的上升而增大; 值得注意的是, 脂解相关基因ATGL的表达显著上升(P<0.05), 同时,CPT-1a的表达也出现上调的趋势。
2.4 脂肪酸对脂肪细胞分化的影响
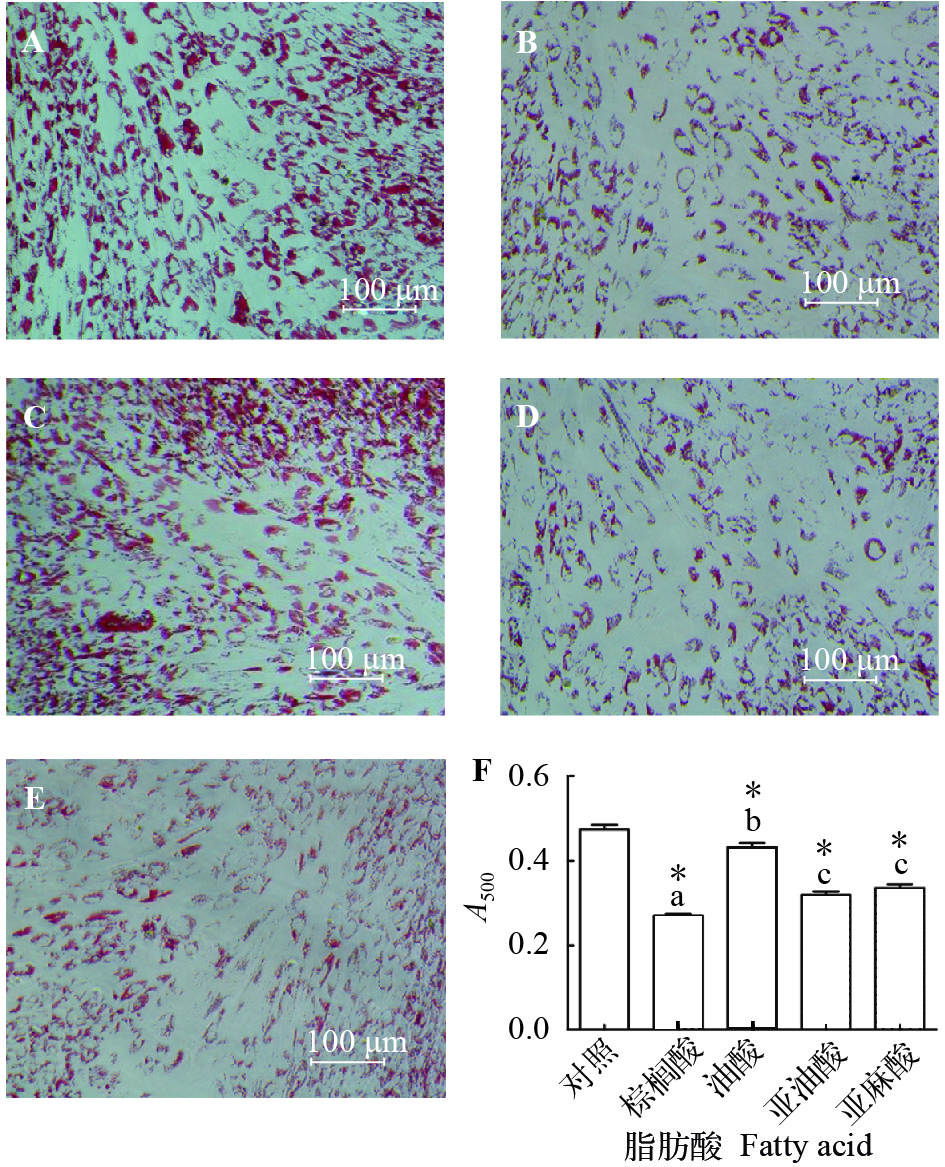
油红O染色检测罗非鱼前脂肪细胞分化情况。如图 4所示, 脂肪酸对脂肪细胞分化存在抑制作用, 且饱和脂肪酸(PA)的抑制作用最强。
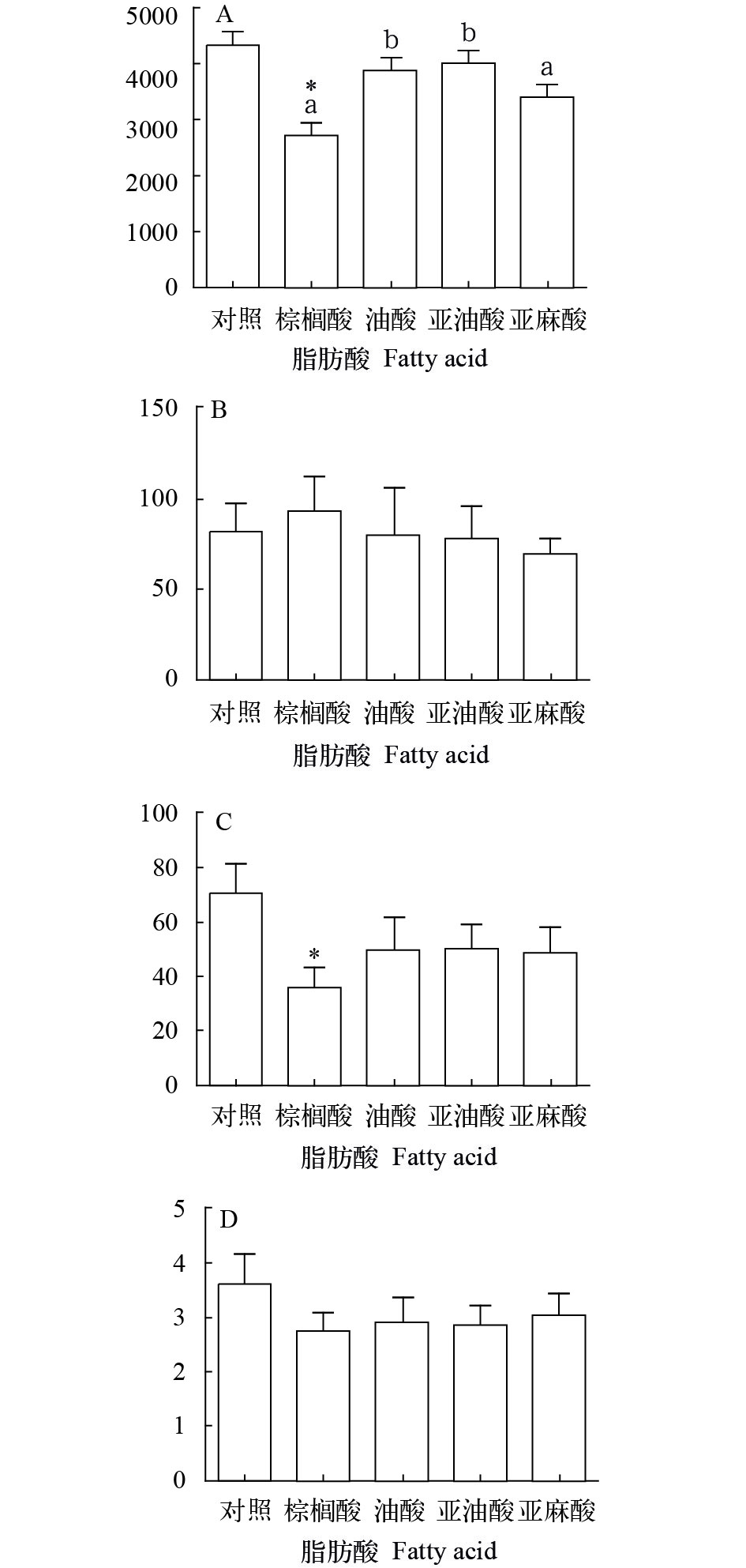
为了进一步分析脂肪酸抑制脂肪细胞分化的机制, 我们采用软件IPP 6.0对脂肪细胞中的脂滴面积、数量及面积进行定量计算。如图 5A、B, 加入外源性脂肪酸, 细胞中的脂滴面积有下降趋势, 而数量出现上升的趋势。另外, 将细胞内的单个脂滴的直径和面积进行比较, 我们发现脂肪酸处理组的细胞中脂滴的平均直径和面积均有下降的趋势, 而棕榈酸处理对细胞分化的抑制效果更加显著(图 5C、D)。
2.5 脂肪酸对脂肪细胞分化相关基因表达的影响
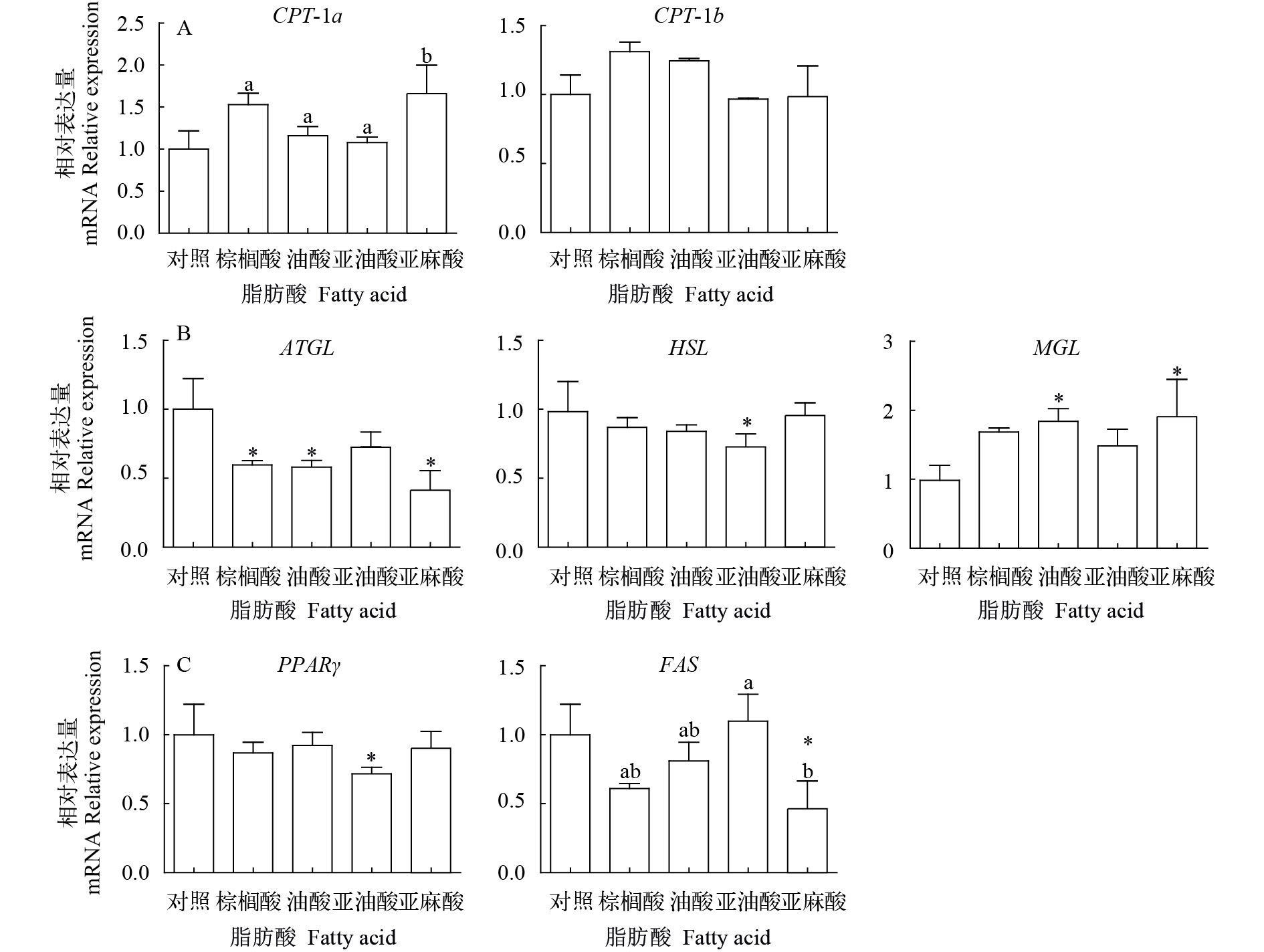
采用qPCR检测分化过程中相关基因表达。如图 6所示, 加入棕榈酸后, CPT-1a (P<0.05)和CPT-1b等β氧化相关基因的表达出现上调的趋势; 脂解相关基因ATGL显著下降; 而脂合成相关基因(FAS)的表达也出现下调的趋势。
3. 讨论
3.1 罗非鱼脂肪细胞体外培养模型的建立
影响脂肪细胞增殖分化效果的因素主要包括提取方法, 培养基成分和培养及诱导时间。不同物种脂肪细胞的提取及培养条件各不相同。以哺乳动物为例, 人和牛脂肪细胞的消化时间通常为1.5h[12, 13], 而猪脂肪细胞则通常为1h[14]; 在鱼类中, 草鱼脂肪细胞的消化时间是50min[8], 大黄鱼脂肪细胞消化时间为1h[5]。本文罗非鱼脂肪细胞消化时间为1.5h。在培养基方面, 吉红等[8]在草鱼前脂肪细胞培养中, 使用含20% FBS的DMEM/F12培养基对脂肪细胞进行培养和诱导, 本文采用含15% FBS的DMEM/F12培养基, 而哺乳动物脂肪细胞培养基大多使用含10% FBS的DMEM/F12培养基。在细胞培养温度方面, 哺乳动物大多为37℃, 大西洋鲑的脂肪细胞通常培养在13℃中[15], 而虹鳟脂肪细胞为18℃[16], 草鱼脂肪细胞为28℃[8], 大黄鱼脂肪细胞也是28℃[5]。本文的罗非鱼脂肪细胞培养于28℃。因此本文在前人的基础上进一步摸索, 成功的构建了罗非鱼脂肪细胞体外培养模型。
3.2 脂肪酸对罗非鱼脂肪细胞增殖分化的影响
在建立罗非鱼脂肪细胞体外培养模型的基础上, 本文探讨不同脂肪酸对脂肪细胞增殖分化的影响。SRB染色实验证实, 脂肪酸可以促进脂肪细胞增殖, 且促增殖作用随着脂肪酸的不饱和程度的增加而增大。其中, 100 μmol/L的LNA的对前脂肪细胞的促增殖作用最为显著。相关基因表达数据表明, 细胞增殖基因c-myc和c-fos的表达量在外源脂肪酸的刺激下显著上升。孙超等[17]在哺乳动物上发现, 短链脂肪酸可以抑制3T3-L1的增殖, 长链脂肪酸对3T3-L1的增殖无显著影响; 陈蓉等[18]发现在一定浓度范围内的多不饱和脂肪酸可以抑制3T3-L1的增殖。而吉红等[19]证明不同浓度的EPA在2d内均能显著促进草鱼前体脂肪细胞增殖, 这与本研究的结果相一致。因此, 脂肪酸对细胞增殖的影响不但与脂肪酸的种类有关, 也与细胞的来源有关, 这也提示我们在鱼类的营养学研究中, 不能完全依赖哺乳动物的细胞系。
值得注意的是, 脂肪酸对前脂肪细胞增殖过程中脂代谢影响机制的研究相对较少。目前只有Distel等[20]的研究可以证明, 脂肪酸可以提高3T3-L1在增殖过程中的脂肪酸结合蛋白(FABP)的表达。这表明, 前脂肪细胞在增殖过程确实存在吸收胞外脂肪酸, 在胞内进行转化分解的可能。而我们的研究结果表明在外源性脂肪酸刺激下, 脂合成相关基因PPARγ和CD36的表达也出现了上调, 脂解相关基因CPT-1和ATGL表达上调, ATGL的表达量甚至出现显著性上升(P<0.05), 表明在增殖过程中, 脂肪细胞可以吸收环境中的脂肪酸, 用于自身代谢活动, 胞内脂质合成与分解都比较活跃, 有效促进细胞增殖。同时, 我们也注意到脂肪酸合成基因PPARγ与FAS表达出现相反趋势, 这有可能是因为细胞可以通过吸收外源脂肪酸以维持自身代谢, 因此脂质合成相关的过程没有被完全启动, 但其中的具体机制仍需进一步探讨。
在探究脂肪酸对脂肪细胞分化影响的实验中, 油红O染色结果显示, 脂肪酸对脂肪细胞分化起抑制作用, 且饱和脂肪酸的抑制作用要强于不饱和脂肪酸。使用IPP 6.0对细胞中脂滴数量和面积进行测量, 我们发现脂肪酸对胞内脂滴形成具有抑制作用。具体表现为加入脂肪酸处理的细胞, 脂滴的面积较小, 而数量较多。Manickam等[21]发现EPA可以显著降低3T3-L1脂肪细胞中脂滴的大小及脂质含量。这与我们的结果一致。因此, 我们认为脂肪酸抑制脂肪细胞分化, 可能是通过抑制脂滴体积的增大, 从而阻止较小脂滴融合为较大脂滴。
而定量PCR结果表明, 在细胞分化过程中添加脂肪酸, 细胞中β氧化相关基因表达水平有所上调, 而脂解基因ATGL表达下调。与我们的结果类似, Flachs等[22]发现DHA和EPA可以促进小鼠白色脂肪组织中线粒体生成和β氧化的进行。吉红等[19]发现EPA处理的草鱼脂肪细胞分化能力下降, 且PGC-1α的表达被激活, PGC-1α的高表达可以提高细胞线粒体的增殖发育, 进而促进胞内脂肪酸的氧化分解。这些结果表明, 罗非鱼脂肪细胞分化过程中, 脂肪酸通过加快胞内β氧化的进行, 减少胞内脂滴积累, 进而抑制细胞的分化, 但具体的信号通路还需进一步研究。
本研究建立了罗非鱼脂肪细胞作为模型, 同时发现不同饱和度的外源性脂肪酸对于细胞的增殖和分化有不同的效应, 其中饱和脂肪酸更倾向于促进细胞分化, 而高不饱和脂肪酸则倾向于促进细胞的增殖。这也为我们解释不同鱼体对于脂质的利用策略提供了必要的细胞学数据。
-
图 1 脂肪细胞增殖及分化过程中的形态变化
A. 开始贴壁的细胞; B. 培养3d细胞呈现不规则的梭形; C. 培养7d细胞铺满整个板底; D. 诱导培养12d油红O染色的细胞
Figure 1. Morphology of preadipocyte and differentiated adipocytes
A. Adherent cell; B. The cell began changing into unregulation shape of fusiform at day 3; C. The cells covered the entire bottom plate at day 7; D. Morphology of adipocytes at day 12 stained with oil red O
表 1 罗非鱼脂肪细胞增殖分化相关基因表达所用引物
Table 1 Primers used in quantitative PCR
引物名称
Primer引物序列
Sequence (5′—3′)c-fos ACACCACATTCAGCAAGAGGA
GCCACGAGTAGCAGAACCTc-myc GTATGAGTGGAAGGAGCGTCTA
CGGCGGTAGGTGATGTAGATCPT-1a TTTCCAGGCCTCCTTACCCA
TTGTACTGCTCATTGTCCAGCAGACPT-1b AAGGGACGTTACTTCAAGGTG
TCCGACTTGTCTGCCAAGATFAS TCATCCAGCAGTTCACTGGCATT
TGATTAGGTCCACGGCCACAATGL AAAACGTCCTGGTGACCCAGT
TAGGAGGAATGATGCCACAGTACAHSL AACCTGGATGTCCATTTCTGGAAG
TCGGTTTACCTTGACTTGAGTGGAMGL ACATCGTCAACGCAGACGGATT
CACAATGTTCCCCAGCTCCATCD36 ATCTTCGAACCATCCATGTCAGTG
GATATGTGATGCTGGAGGAAGCAAPPARγ TGGACTACACAAACATGCACAGC
CACGGGACTATCTGAGTACTGTGGAβ-actin CAGGATGCAGAAGGAGATCACA
CGATCCAGACGGAGTATTTACG -
[1] Schaffer J E. Lipotoxicity: when tissues overeat [J]. Current Opinion in Lipidology, 2003, 14(3): 281—287
[2] 麦康森. 水产动物营养与饲料学. 北京: 中国农业出版社. 2011, 4 Mai K S. Aquatic Animal Nutrition and Feed Science [M]. Beijing: China Agriculture Press. 2011, 4
麦康森. 水产动物营养与饲料学. 北京: 中国农业出版社. 2011, 4[3] Ravussin E, Smith S R. Increased fat intake, impaired fat oxidation, and failure of fat cell proliferation result in ectopic fat storage, insulin resistance, and type 2 diabetes mellitus [J]. Annals of the New York Academy of Sciences, 2002, 967(1): 363—378
[4] Bouraoui L, Gutiérrez J, Navarro I. Regulation of proliferation and differentiation of adipocyte precursor cells in rainbow trout (Oncorhynchus mykiss) [J]. The Journal of endocrinology, 2008, 198(3): 459—469
[5] Wang X, Huang M, Wang Y. The Effect of Insulin, TNFα and DHA on the proliferation, differentiation and lipolysis of preadipocytes isolated from Large Yellow Croaker (Pseudosciaena crocea R.) [J]. PLoS One, 2012, 7(10): e48069
[6] Oku H, Tokuda M, Okumura T, et al. Effects of insulin, triiodothyronine and fat soluble vitamins on adipocyte differentiation and LPL gene expression in the stromal-vascular cells of red sea bream, Pagrus major [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2006, 144(3): 326—333
[7] Oku H, Tokuda M, Umino T. The effects of 2-bromopalmitate on the fatty acid composition in differentiating adipocytes of red sea bream (Pagrus major)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2009, 152(4): 370—375
[8] 吉红, 曹艳姿, 林亚秋, 等. 草鱼前体脂肪细胞的原代培养. 水生生物学报, 2009, 33(6): 1226—1230 Ji H, Cao Y Z, Lin Y Q, et al. Primary culture of grass carp preadipocyte in vitro [J]. Acta Hydrobiologica Sinica, 2009, 33(6): 1226—1230
吉红, 曹艳姿, 林亚秋, 等. 草鱼前体脂肪细胞的原代培养. 水生生物学报, 2009, 33(6): 1226—1230[9] Azain M J. Role of fatty acids in adipocyte growth and development12 [J]. Journal of Animal Science, 2004, 82(3): 916—924
[10] Liu P, Li C, Huang J, et al. Regulation of adipocytes lipolysis by n-3 HUFA in grass carp (Ctenopharyngodon idellus) in vitro and in vivo[J]. Fish Physiology and Biochemistry, 2014, 40(5): 1447—1460
[11] Albalat A, Gutiérrez J, Navarro I. Regulation of lipolysis in isolated adipocytes of rainbow trout (Oncorhynchus mykiss): The role of insulin and glucagon[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2005, 142(3): 347—354
[12] 王竹晨 刘建中, 李燕, 等. 人前脂肪细胞的原代培养. 中山医科大学学报, 2000, 22(6): 443—446 Wang C, Liu J, Li Y, et al. Primary culture of human preadipocyte [J]. Academic Journal of Sun Yat-Sen University of Medical Sciences, 2000, 22(6): 443—446
王竹晨 刘建中, 李燕, 等. 人前脂肪细胞的原代培养. 中山医科大学学报, 2000, 22(6): 443—446[13] 夏成, 王哲, 朱淑玲, 等. 犊牛前脂肪细胞的培养及其增殖与分化模型的建立. 中国兽医科技, 2004, 5(34): 25—30 Xia C, Wang Z, Zhu S, et al. Culture of calf preadipocyte and establishment of its proliferation and differentiation model [J]. Chinese Journal of Veterinary Science and Technology, 2004, 5(34): 25—30
夏成, 王哲, 朱淑玲, 等. 犊牛前脂肪细胞的培养及其增殖与分化模型的建立. 中国兽医科技, 2004, 5(34): 25—30[14] 屈长青, 张国华, 陈粉粉, 等. 猪前体脂肪细胞的原代培养. 农业生物技术学报, 2005, 13(5): 649—653 Qu C Q, Zhang G H, Chen F F, et al. Primary culture of porcine preadipocyte [J]. Journal of Agricultural Biotechnology, 2005, 13(5): 649—653
屈长青, 张国华, 陈粉粉, 等. 猪前体脂肪细胞的原代培养. 农业生物技术学报, 2005, 13(5): 649—653[15] Vegusdal A, Sundvold H, Gjøen T, et al. An in vitro method for studying the proliferation and differentiation of Atlantic salmon preadipocytes [J]. Lipids, 2003, 38(3): 289—296
[16] Bouraoui L, Gutierrez J, Navarro I. Regulation of proliferation and differentiation of adipocyte precursor cells in rainbow trout (Oncorhynchus mykiss) [J]. The Journal of Endocrinology, 2008, 198(3): 459—469
[17] 孙超, 刘春伟. 脂肪酸对小鼠前体脂肪细胞增殖分化及OLR1基因转录表达的作用. 西北农林科技大学学报自然科学版, 2009, 37(3): 1—6 Sun C, Liu C W. Effect of fatty acids on the proliferation and differentiation of mouse adipocytes as well as transcriptional expression of OLR1 [J]. Journal of Northwest Agriculture and Forestry University (Natural Science Edition), 2009, 37(3): 1—6
孙超, 刘春伟. 脂肪酸对小鼠前体脂肪细胞增殖分化及OLR1基因转录表达的作用. 西北农林科技大学学报自然科学版, 2009, 37(3): 1—6[18] 陈蓉, 郭莉霞, 殷钟意, 等. 多不饱和脂肪酸对小鼠3T3-L1前脂肪细胞增殖和分化的影响. 现代食品科技, 2014, 30(7): 16—22 Chen R, Guo L X, Yin Z Y, et al. Effect of n-3/n-6 Polyunsaturated fatty acid on the proliferation and differentiation of 3T3-L1 preadipocytes [J]. Modern Food Science and Technology, 2014, 30(7): 16—22
陈蓉, 郭莉霞, 殷钟意, 等. 多不饱和脂肪酸对小鼠3T3-L1前脂肪细胞增殖和分化的影响. 现代食品科技, 2014, 30(7): 16—22[19] 刘品, 吉红, 李超, 等. EPA对草鱼前体脂肪细胞增殖分化的影响. 水生生物学报, 2013, 37(3): 418—424 Liu P, Ji H, Li C, et al. Regulation of adipocytes lipolysis by n-3 HUFA in grass carp (Ctenopharyngodon idellus) in vitro and in vivo [J]. Fish Physiology and Biochemistry, 2013, 37(3): 418—424
刘品, 吉红, 李超, 等. EPA对草鱼前体脂肪细胞增殖分化的影响. 水生生物学报, 2013, 37(3): 418—424[20] Clarke S D, Daniela G, Carolanne N, et al. Fatty acid regulation of gene expression[J]. Annals of the New York Academy of Sciences, 2002, 967(1): 283
[21] Manickam E, Sinclair A J, Cameronsmith D. Suppressive actions of eicosapentaenoic acid on lipid droplet formation in 3T3-L1 adipocytes [J]. Lipids in Health & Disease, 2010, 9(1): 57
[22] Flachs P, Horakova O, Brauner P, et al. Polyunsaturated fatty acids of marine origin upregulate mitochondrial biogenesis and induce β-oxidation in white fat [J]. Diabetologia, 2005, 48(11): 2365—2375
-
期刊类型引用(2)
1. 柯轶雄,毛孝江,任惠娟,张春晓,王玲,宋凯,李学山,鲁康乐. 花鲈前脂肪细胞系的建立及油酸诱导分化. 水生生物学报. 2024(07): 1102-1110 .  本站查看
本站查看
2. 卢美琳,阿尔祖古丽,李自良,敖慧娟,乔自林,阿依木古丽. 多不饱和脂肪酸对小尾寒羊前体脂肪细胞增殖的影响. 黑龙江畜牧兽医. 2020(15): 7-12+168-169 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载: