GENE CLONING OF GPR43 AND ITS DISTRIBUTION IN THE TISSUE OF BLUNT SNOUT BREAM AND THE EFFECT OF BERBERINE ON ITS MRNA EXPRESSION
-
摘要: 试验采用RACE技术克隆了团头鲂(Megalobrama amblycephala)G蛋白偶联受体43(GPR43)基因的cDNA序列, 并探究了不同组织中的GPR43 mRNA表达量及黄连素对其表达量的影响。结果显示, 克隆得到的团头鲂GPR43基因的cDNA序列全长为2026 bp, 含有1个长度为 981 bp的开放阅读框, 编码了326个氨基酸。RT-PCR检测发现GPR43在团头鲂的肠道、肌肉、鳃和肝胰腺中具有较高的表达。为期8周的养殖试验选取均重为(80.00±0.90) g的团头鲂320尾, 随机分于16个网箱中, 饲喂4种不同的试验日粮, 分别为正常日粮(脂肪含量为5%)、正常日粮+50 mg/kg黄连素、高脂日粮(脂肪含量为10%)、高脂日粮+50 mg/kg黄连素。结果显示: 在肠道组织中, 与正常日粮组相比, 高脂组的GPR43表达量降低, 添加黄连素能够显著升高其表达水平(P<0.05)。与正常日粮组相比, 高脂组的胆固醇(CHO)含量以及细胞分裂素蛋白激酶(p38)的表达量均呈现了显著上升(P<0.05)的趋势, 添加黄连素后其含量及表达量显著下降(P<0.05)。肝胰腺组织和肌肉组织中的多不饱和脂肪酸(PUFA)含量变化也有着相似的趋势, 而肉碱棕榈酰基转移酶Ⅰ(CPT Ⅰ)、过氧化物酶体增值因子α&β (PPARα&β)、AMP依赖性蛋白激酶(AMPK)的表达量以及2个组织中的饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)含量呈现出了相反的趋势。此外, 在正常日粮中添加黄连素并不能对上述各指标产生明显的调控效应, 有时反而会导致轻微的负调控效应。综上结果表明, 黄连素能够显著上调GPR43在高脂抑制下的表达量, 同时能够缓解高脂诱导的团头鲂肝胰腺脂肪沉积, 改善其脂肪代谢性能。黄连素对于脂肪代谢的调控作用可能通过GPR43受体来实现。Abstract: This study was conducted to explore the effects of berberine on the mRNA expression of G protein coupled receptors 43 (GPR43) and the lipid metabolism performance of blunt snout bream fed with high-fat diet. GPR43 in blunt snout bream was cloned and sequenced with a RACE assays. The effects of berberine on GPR43 mRNA expression in tissues were also investigated. The obtained full-length nucleotide sequence covers 2026 bp, which has an open reading frame of 981 bp, and translates a total of 326 amino acids. Moreover, GPR43 mRNAs were detected in different tissues of blunt snout bream. In blunt snout bream, the expression of GPR43 in intestine, hepatopancreas, gill and white muscle were the highest. 320 fish (80.00±0.90) g were randomly divided into four trial groups (each has four replicates) and fed with 4 diets (normal diet, normal diet with 50 mg/kg berberine, high-fat diet, and high-fat diet with 50 mg/kg berberine, among which normal diet has 5% lipid and high-fat diet has 10% lipid), respectively. The expression of GPR43 mRNA in the high-fat diet group decreased compared with control group, while it significantly increased (P<0.05) after adding in berberine. Compared with the control group, the contents of free fatty acids (FFA), triglycerides (TG), cholesterol (CHO), and mRNA expressions of Cytokinins protein kinase (p38), and Peroxidase value-added factor (PPARγ) all increased (P<0.05) in the high-fat group, but a dramatic decrease (P<0.05) happened after adding in berberine. The same result was found on the composition of Polyunsaturated fatty acids (PUFA) in hepatopancreas and muscle tissues. A completely inverse variation was presented on the mRNA expressions of Carnitine palm acyltransferaseⅠ (CPTⅠ), Peroxidase value-added factor (PPARα&β) and AMP dependent protein kinase (AMPK), as well as on the compositions of Saturated fatty acids (SFA) and Monounsaturated fatty acids (MUFA) in both tissues. Nevertheless, the difference between berberine supplemental normal diet group and control group was out of regular pattern. So further work is still needed to explore the role of berberine in normal circumstances. Overall, the results showed the supplement of berberine could slow down lipid deposition in hepatopancreas, and restore lipid homeostasis which has been damaged by continuous high-fat diet feeding.
-
作为小肠中厌氧细菌发酵的主要产物, 短链脂肪酸(SCFA)是动物有机体中的主要能量来源[1]。短链脂肪酸在多核细胞(PMNC)中发挥许多与免疫相关的生物学功能[2]。据最新研究报道, G蛋白偶联受体家族的GPR43能够与短链脂肪酸特异性结合, 这表明短链脂肪酸在多核细胞(PMNC)中的生物学信号传递可能是通过与GPR43的结合来实现的[3]。研究表明, 作为短链脂肪酸受体的GPR43在调节体脂代谢以及对相关病征防治机制的调控方面都有着不可或缺的作用[4], 而这些作用通常是通过调整胃肠肽的分泌与调节细胞癌变通路[5]。由于该受体在糖脂代谢的调控作用中扮演着重要角色, 已然成为药物筛选新靶点的重要一员。目前, 关于鱼类GPR43的分子生物学研究仅在牙鲆上有序列报道, 在其他鱼种上有关GPR43的研究尚且寥寥可数。本试验克隆了GPR43基因的cDNA序列并进行了相关的同源性比对, 同时分析了GPR43在相关代谢因子作用下的表达特征, 旨在探讨鱼体GPR43的代谢调节机制, 为研究鱼类营养性代谢机理提供部分参考依据。
随着这些年来水产养殖业的疾速发展, 伴随集约化和高密度养殖, 生产周期的锐缩、过量采食以及水质恶化等问题的层层涌现, 鱼体脂肪代谢紊乱和健康机能障碍等现象便时有发生。同时在实际生产中, 高脂肪饲料已经越来越多地被养殖者使用, 因为适当地提高饲料中的脂肪水平能够有效地节约蛋白质[6], 进而提高饲料利用效率[7]。但是, 脂质的过量摄入必然会导致脂肪在机体肝胰腺中过量地沉积, 增加脂肪肝发生的可能, 进而引发一系列的健康问题[8, 9]。为了解决这些问题, 本研究选择了名为黄连素的中草药, 并添加到饲料中以期改善鱼类的脂肪代谢, 黄连素中含有的盐酸盐已经被证实具有调控脂肪代谢的功能, 并已用于治疗高脂血症和肝胰腺功能障碍[10]。
团头鲂(Megalobrama amblycephala)是世界上重要的水产养殖品种。由于其良好的性能和肉质, 在中国更是受到了广大界内人士的喜爱并且被广泛地养殖。然而, 与其他养殖鱼类相比, 团头鲂更容易患有脂肪肝类病征[11]。因此, 在本研究中, 我们使用团头鲂作为模型动物, 经为期8周的高脂饲料投喂试验来探究黄连素调节脂肪代谢和缓解脂肪沉积的机制。
1. 材料与方法
1.1 试验设计及饲料配方
试验设计4种等氮饲料, 分别为正常日粮(脂肪水平5%, ND组)、高脂日粮(脂肪水平10%, HD组)、添加50 mg/kg黄连素的正常日粮(NDB组)和高脂日粮(HDB组), 饲料配方和营养成分分析见表 1。根据饲料配方将各个原料粉碎、称重, 按照先小料后大料的方式, 逐级混匀, 加适量水, 使用小型饲料颗粒机制成粒径2 mm水稳性良好的沉性颗粒料, 于通风处晾干后置于–20℃冰箱保存备用。
表 1 试验所用饲料的配方及营养组成Table 1. Formulation and composition of experimental diets原料
Ingredient正常日粮
Normal diet (%)高脂日粮
High-fat diet (%)鱼粉Fish meal 5.00 5.00 豆粕Soybean meal 26.00 25.82 菜粕Rapeseed meal 11.86 11.86 棉粕Cottonseed meal 12.58 12.58 麸皮Wheat bran 10.00 4.00 面粉Wheat meal 28.50 28.50 猪油Lard oil 1.33 4.42 豆油Soybean oil 1.33 4.42 磷酸二氢钙Calciumbiphosphate 2.00 2.00 复合预混料aPremix 1.00 1.00 食盐Salt 0.40 0.40 饲料营养组成Proximate composition (%) 水分Moisture 13.90 11.22 粗蛋白Crude protein 29.64 29.38 粗脂肪Crude Lipid 4.77 10.10 能量Energy (MJ/kg) 17.05 18.80 注: a 每千克预混料中含有:CuSO4·5H2O 2.0 g;FeSO4·7H2O 25 g;ZnSO4·7H2O 22 g;MnSO4·4H2O 7 g;Na2SeO3 0.04 g;KI 0.026 g;CoCl2·6H2O 0.1 g;维生素A 900000 IU;维生素D 200000 IU; 维生素E 4500 mg; 维生素K 3220 mg; 维生素B1 320 mg; 维生素B2 1090 mg; 烟酸2000 mg; 维生素B6 500 mg; 维生素B12 1.6 mg; 维生素C 5000 mg; 泛酸1000 mg; 叶酸165mg; 胆碱60000 mg; 生物素1.2 mg;肌醇15000 mg Note: aPremix supplied the following minerals (g/kg) and vitamins (IU or mg/kg): CuSO4·5H2O, 2.0 g; FeSO4·7H2O, 25 g; ZnSO4·7H2O, 22 g; MnSO4·4H2O, 7 g; Na2SeO3, 0.04 g; KI, 0.026 g; CoCl2·6H2O, 0.1 g; Vitamin A, 900000 IU; Vitamin D, 200000 IU; Vitamin E, 4500 mg; Vitamin K, 3220 mg; Vitamin B1, 320 mg; Vitamin B2, 1090 mg; Niacin, 2000 mg; Vitamin B6, 500 mg; Vitamin B12, 1.6 mg; Vitamin C, 5000 mg; Pantothenate, 1000 mg; Folic acid, 165 mg; Choline, 60000 mg; Biotin, 1.2 mg; Myoinositol 15000 mg 1.2 试验鱼与养殖管理
养殖试验在江苏省南京市浦口水产营养研究试验基地进行, 试验所用团头鲂幼鱼取自江苏扬州国家级水产原种场。驯化1周后, 选取外表健康、活力稳定、规格整齐, 质量为(80.00±0.90) g的团头鲂320尾, 随机均分入16个网箱(规格: 2.0 m×1.0 m×1.0 m)中。在为期8周的养殖期间, 每天定时饱食投喂3次(7:30h、12:00h和16:30h)。早晚定时测定水温、水中的溶氧及pH。在整个养殖试验期中, 水温25—32℃, pH 7.0—7.6, 溶氧保持在5.0 mg/L以上。
1.3 样品采集与分析
基因克隆所用团头鲂取自江苏省南京市浦口区南京农业大学水产系试验基地。以团头鲂肝胰腺为模板进行GPR43基因的cDNA克隆, 并采集肝胰腺、肠道、肌肉等10个常见组织于–80℃保存, 以备后续组织表达分析测定。
在养殖试验结束后, 将鱼饥饿24h以排空其肠道内容物, 每个网箱随机取鱼5尾, 取样均在冰袋上进行。用浓度为80 mg/L的MS-222麻醉, 从尾静脉采血, 血液采集后置于预先制好的抗凝管中, 3000 r/min离心10min (4℃), 制得血浆。解剖后分离内脏团和胴体, 然后分离出肝胰脏, 用4℃预冷的生理盐水清洗肝胰腺组织后用滤纸吸干水分, 供测定相关的脂肪代谢指标。用于制作组织学切片的肝胰腺样品分别用1%的甲醛或2.5%的戊二醛固定。
1.4 GPR43基因的cDNA克隆与测序
GPR43基因3′ RACE扩增及5′ RACE扩增 团头鲂总RNA提取采用Trizol® Plus RNA Purification Kit (Invitrogen货号: 12183-555)进行, 具体提取过程参照该试剂盒的说明书。提取后分光光度计和电泳分析, 模板采用GeneRacer TM Kit (Invitrogen, 货号: L1500-01)进行合成。在PCR结束后, 采用1.2%琼脂糖凝胶电泳进行分析, 切胶回收后, 连接pUCm载体, 转化高效化学感受态细胞DH5α, 进行测序。
目的基因PCR扩增及回收 以团头鲂肝胰腺cDNA为模板进行PCR扩增。在PCR结束后, 采用1.5%琼脂糖凝胶电泳进行分析, PCR产物呈现出一条特异性条带, 大小约400 bp左右, 切胶回收后, 连接pUCm-T载体, 转化高效化学感受态细胞DH5α, 进行测序。
1.5 血浆生化指标测定
血浆中总胆固醇、甘油三酯及游离脂肪酸水平均使用南京建成试剂盒测定, 详细测定方法见于该试剂盒说明书。
1.6 肝胰腺基因表达的测定
肝胰腺总RNA提取: 取大约100 mg的肝胰腺样品迅速转移至液氮预冷的研钵中, 用研杵迅速研磨组织, 期间不断加入液氮, 直至研磨成粉末状。向研钵中加入适量的RNAiso Plus, 按照RNAiso Plus试剂盒中说明书操作, 提取总RNA。
反转录: 采用Takara Prime Script® RT reageat Kit反转录试剂盒说明书进行操作, 所得cDNA保存于–20℃待用。
定量PCR: (1) 引物设计: 根据Genbank数据库中的序列, 利用Primer 5.0软件设计内参基因β-actin、肉碱棕榈酰基转移酶Ⅰ(CPTⅠ)、过氧化物酶体增值因子(PPARs)、AMP依赖性蛋白激酶 (AMPK)及细胞分裂素蛋白激酶(p38), 引物序列参见表 2, 引物由上海Invitrogen公司合成。(2) 根据TaKaRa公司生产的SYBR® Premix Ex Taq TM II试剂盒说明书进行加样上机。
表 2 定量PCR引物序列Table 2. Nucleotide sequences of the primers used to assay gene expression by real-time PCR目的基因
Target gene序列
Sequence (5′—3′)CPTⅠ-F TACTTCCAAAGCGGTGAG CPTⅠ-R AGAGGTATTGTCCGAGCC PPAR α-F GTGCCAATACTGTCGCTTTCAG PPAR α-R CCGCCTTTAACCTCAGCTTCT PPAR β-F CATCCTCACGGGCAAGAC PPAR β-R CACTGGCAGCGGTAGAAG PPAR γ-F AGCTTCAAGCGAATGGTTCTG PPAR γ-R AGGCCTCGGGCTTCCA AMPK-F GCGACGGACAAACAGAAACA AMPK-R TTCCCCACCACATCCAGACT p38-F CACTCGCATTCCAAGCAGAC p38-R GCATCAAACGCAGAGCAAAC β-actin-F CGGACAGGTCATCACCATTG β-actin-R CGCAAGACTCCATACCCAAGA 1.7 肝胰腺超微结构的观察
肝胰腺样品在用2.5%的戊二醛固定24h后, OsO4固定1h, 切成70 nm厚度的切片, 染色后用透射电子显微镜(Hitachi H-7650)观察。
1.8 组织脂肪含量及脂肪酸组成测定
脂肪酸组成采用气相色谱法测定(岛津GC-201), 用氯仿和甲醇混合液提取组织中脂肪后, 0.5 mol/L氢氧化钾-甲醇溶液使其甲酯化后, 上机测定。脂肪酸分析条件: cross-linked 5% phenylmethyl silicone毛细管色谱柱, 柱长为30 m, 内径0.32 mm, 膜厚0.25 mm。FID检测器, 气化温度250℃; 检测温度270℃; 柱流量110 mL/min, 载气为N2, 流量29 mL/min, 氢气燃烧气流量30 mL/min, 空气助燃气流量300 mL/min; 采取程序升温: 起始柱温100℃; 以5℃/min速度升至200℃, 保持5min; 以2℃/min速度升至225℃, 保持2min; 分析时间39.5min。
1.9 数据统计与分析
试验结果采用平均值±标准误(Mean±SEM)进行表示。数据在Excel 2010中作初步处理后, 用SPSS 17.0软件进行单因素方差分析(One-Way ANOVA), 之后使用Duncan’s分析法比较以上结果的显著差异性, 差异显著性水平为P<0.05。
2. 结果
2.1 团头鲂GPR43基因cDNA全长克隆及序列分析
对团头鲂GPR43基因cDNA核心序列进行扩增, 分别得到2段核苷酸片段, 组装去掉重复序列后, 得到GPR43(Genbank: MH157215)基因全长cDNA序列。该cDNA全长为2026 bp, 包含一个长度为981 bp的开放阅读框(Open reading frame), 编码了326个氨基酸。
2.2 团头鲂GPR43同源性分析
克隆得到的GPR43 cDNA序列含有6段跨膜区域, 分别在6—34、41—68、77—116、122—148、170—204、214—245位置, 在8—280位置有一个7tmA-FFAR2-FFAR3蛋白质结构域。
2.3 系统进化树分析
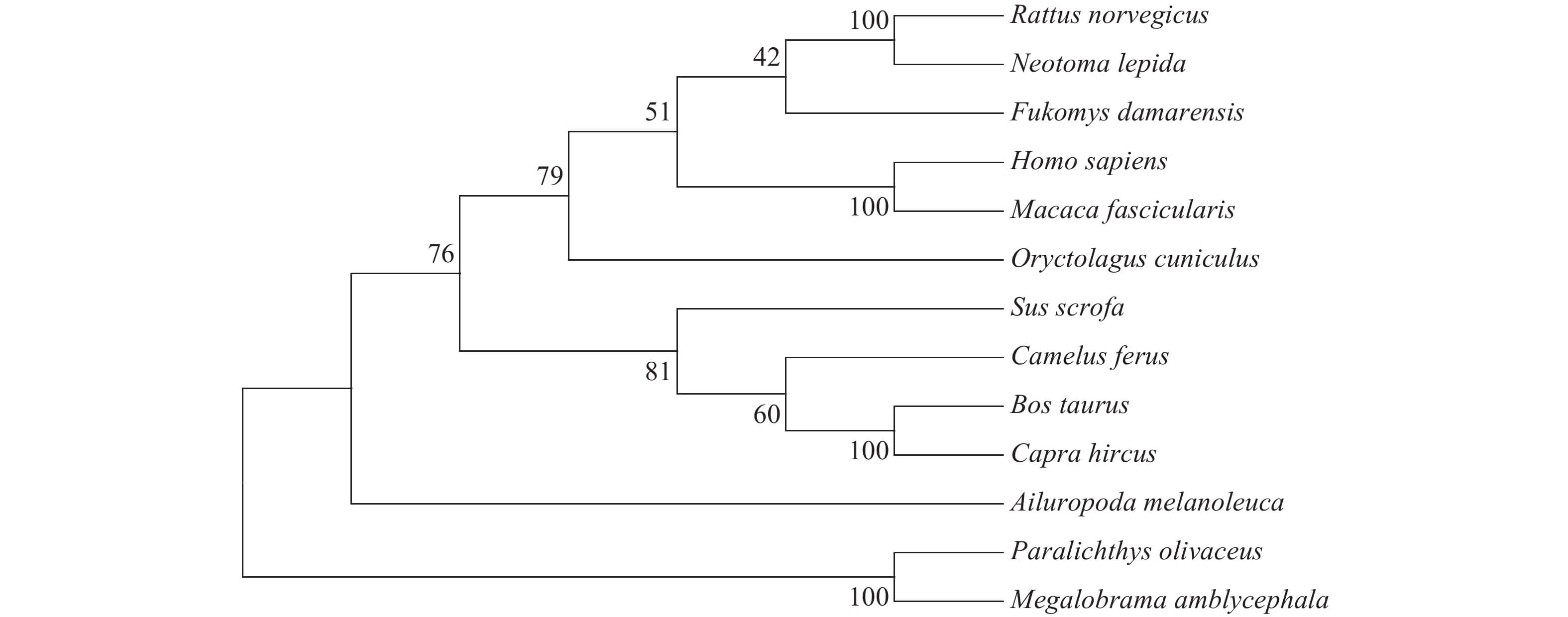
如图 1所示, 通过MEGA 4.0软件中的NJ法将以上氨基酸序列构建系统进化树。结果显示, 团头鲂的GPR43序列与牙鲆的GPR43序列相似性最高, 二者聚为一支。此外, 作为灵长类的人和猕猴聚为一支, 作为反刍类的牛和山羊聚为一支, 而作为啮齿类的家鼠和漠林鼠则聚为一支。这与传统的形态学和生化特征分类进化地位也基本一致。
![]() 图 1 根据NJ法构建的GPR43氨基酸序列系统进化树每个节点处的数字表示自展支持率, 自展值检验为1000次重复抽样。GenBank序列号分别为: 大鼠(BAD02826.1)、沙漠林鼠(OBS72789.1)、达马拉鼹鼠(KFO32380.1)、人类(AAB86713.1)、食蟹猴(EHH59466.1)、家兔(AOE47572.1)、猪(NP_001265687.1)、骆驼 (EPY81301.1)、牛 (ACM07438.1)、山羊(NP_001272584.1)、熊猫(EFB29861.1)、牙鲆(ALJ30163.1)Figure 1. Phylogenetic tree of the GPR43 amino acid sequence with Neighbour-Joining methodNumbers at nodes indicate the bootstrap value (%) that obtained from 1000 replicates. GenBank Accession No.: Rattus norvegicus (BAD02826.1), Neotoma lepida (OBS72789.1), Fukomys damarensis (KFO32380.1), Homo sapiens (AAB86713.1), Macaca fascicularis (EHH59466.1), Oryctolagus cuniculus (AOE47572.1), Sus scrofa (NP_001265687.1), Camelus ferus (EPY81301.1), Bos taurus (ACM07438.1), Capra hircus (NP_001272584.1), Ailuropoda melanoleuca (EFB29861.1), Paralichthys olivaceus (ALJ30163.1)
图 1 根据NJ法构建的GPR43氨基酸序列系统进化树每个节点处的数字表示自展支持率, 自展值检验为1000次重复抽样。GenBank序列号分别为: 大鼠(BAD02826.1)、沙漠林鼠(OBS72789.1)、达马拉鼹鼠(KFO32380.1)、人类(AAB86713.1)、食蟹猴(EHH59466.1)、家兔(AOE47572.1)、猪(NP_001265687.1)、骆驼 (EPY81301.1)、牛 (ACM07438.1)、山羊(NP_001272584.1)、熊猫(EFB29861.1)、牙鲆(ALJ30163.1)Figure 1. Phylogenetic tree of the GPR43 amino acid sequence with Neighbour-Joining methodNumbers at nodes indicate the bootstrap value (%) that obtained from 1000 replicates. GenBank Accession No.: Rattus norvegicus (BAD02826.1), Neotoma lepida (OBS72789.1), Fukomys damarensis (KFO32380.1), Homo sapiens (AAB86713.1), Macaca fascicularis (EHH59466.1), Oryctolagus cuniculus (AOE47572.1), Sus scrofa (NP_001265687.1), Camelus ferus (EPY81301.1), Bos taurus (ACM07438.1), Capra hircus (NP_001272584.1), Ailuropoda melanoleuca (EFB29861.1), Paralichthys olivaceus (ALJ30163.1)2.4 团头鲂GPR43基因组织表达差异分析
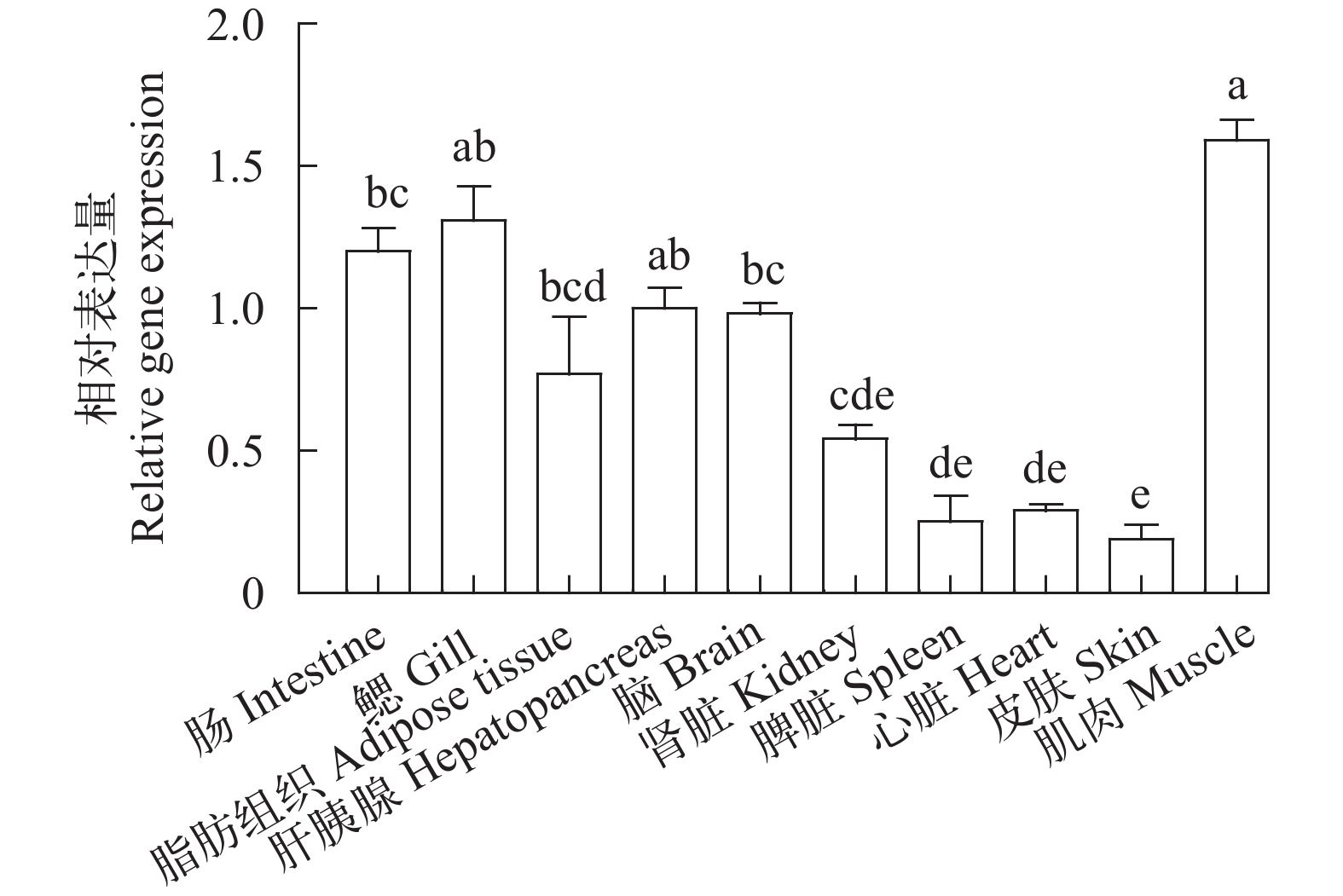
如图 2所示, 通过实时荧光定量PCR测定团头鲂的各组织(肠道、鳃、脂肪组织、肝胰腺、脑、肾脏、脾脏、心脏、皮肤、肌肉)中GPR43的表达情况。结果显示, 在肠道、鳃、肝胰腺、和肌肉组织中的表达量显著高于其他组织, 其次表达量相对较高的组织为脂肪组织、脑和肾脏, 脾脏、心脏和皮肤中表达量最低(P<0.05)。
2.5 不同日粮组成对团头鲂各组织GPR43表达的影响
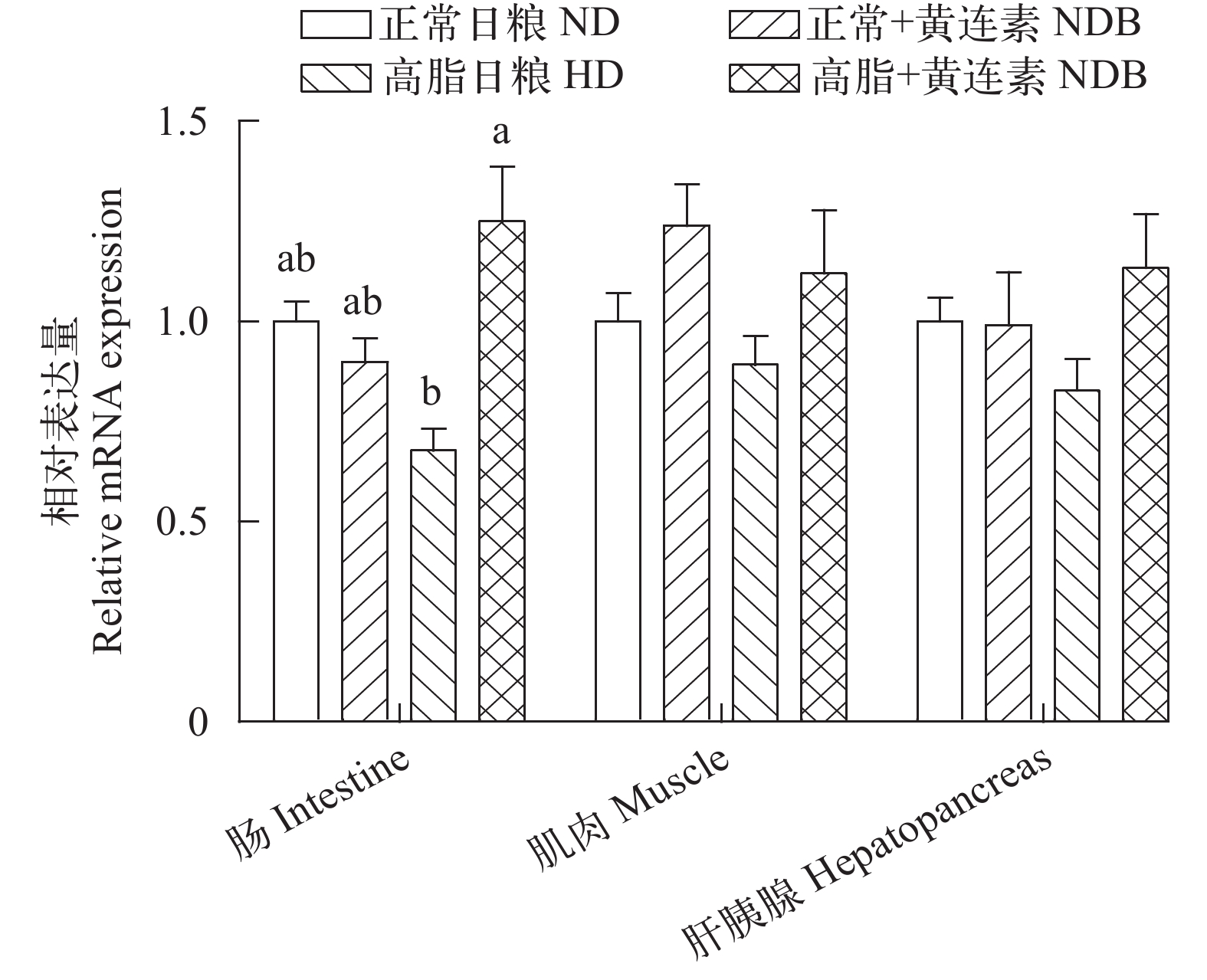
如图 3所示, 在肠道组织中, 高脂+黄连素组的GPR43表达量显著高于高脂组(P<0.05), 与其他各组间差异不显著(P>0.05)。GPR43表达量在肝胰腺和肌肉组织中的表达量差异不显著(P>0.05)。
2.6 血浆生化指标
如表 3所示, 各组之间的TG含量无显著变化(P>0.05)。与正常日粮组相比, 高脂组中的FFA和TC含量均有上升的趋势。高脂+黄连素组的FFA和TC含量均显著低于高脂组(P < 0.05)。
表 3 不同日粮投喂对团头鲂血浆生化指标的影响Table 3. Results of blood biochemistry in blunt snout bream fed with different diets组别
Group游离脂肪酸
FFA (mmol/L)总胆固醇
TC (mmol/L)甘油三酯
TG (mmol/L)正常日粮ND 0.77±0.04ab 7.81±0.34ab 3.06±0.33 正常+黄连素NDB 0.73±0.06b 8.91±0.37ab 3.20±0.49 高脂日粮HD 0.83±0.10a 9.64±0.98a 3.64±0.19 高脂+黄连素HDB 0.73±0.06b 7.40±0.63b 3.02±0.19 注: 所有数值均以均值±标准误(Mean±SEM)进行表示; 每一列数据中标有不同字母者即为差异显著(P<0.05); 下同 Note: All values are expressed as Means±SEM Data in the same line with different letters showed significantly difference (P<0.05); the same applies below 2.7 肝胰腺脂代谢相关基因表达
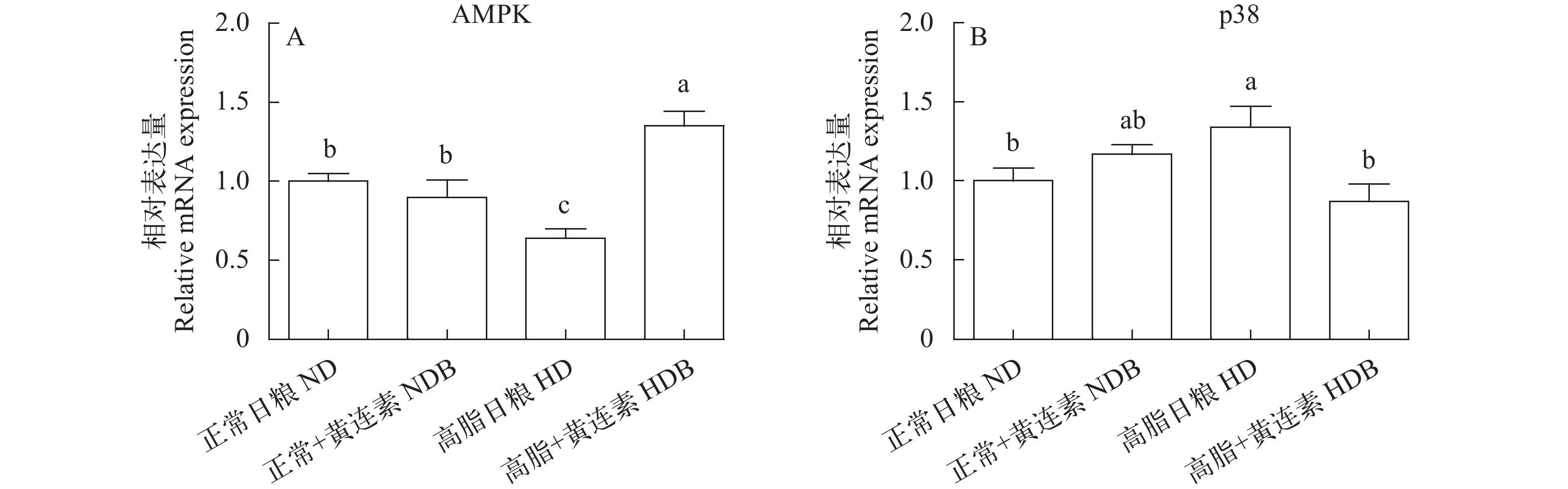
如表 4和图 4所示, 与正常日粮组相比, 高脂组中的CPTⅠ和AMPK mRNA表达量显著降低(P<0.05), 高脂+黄连素组的AMPK mRNA表达量显著升高(P<0.05)。高脂+黄连素组的PPARα和PPARβ的mRNA表达量显著高于高脂(P<0.05)。各组间PPARγ mRNA表达量差异不显著(P>0.05)。高脂组的p38 mRNA表达量显著高于正常日粮组和高脂+黄连素组(P<0.05)。
表 4 不同日粮投喂下团头鲂肝胰腺脂代谢因子的相对表达量Table 4. Relative gene expression for lipid metabolic genes in hepatopancreas of blunt snout bream fed with different diets组别Group 肉碱棕榈酰基转移酶ⅠCPTⅠ 过氧化物酶体增值因子 PPARα PPARβ PPARγ 正常日粮ND 1.00±0.07a 1.00±0.06b 1.00±0.08b 1.00±0.08 正常+黄连素NDB 0.99±0.06a 0.83±0.06b 0.78±0.12b 1.02±0.09 高脂日粮HD 0.75±0.10b 0.83±0.08b 0.78±0.14b 0.86±0.06 高脂+黄连素HDB 1.17±0.11a 1.59±0.16a 1.60±0.08a 1.01±0.02 2.8 肝细胞超微结构
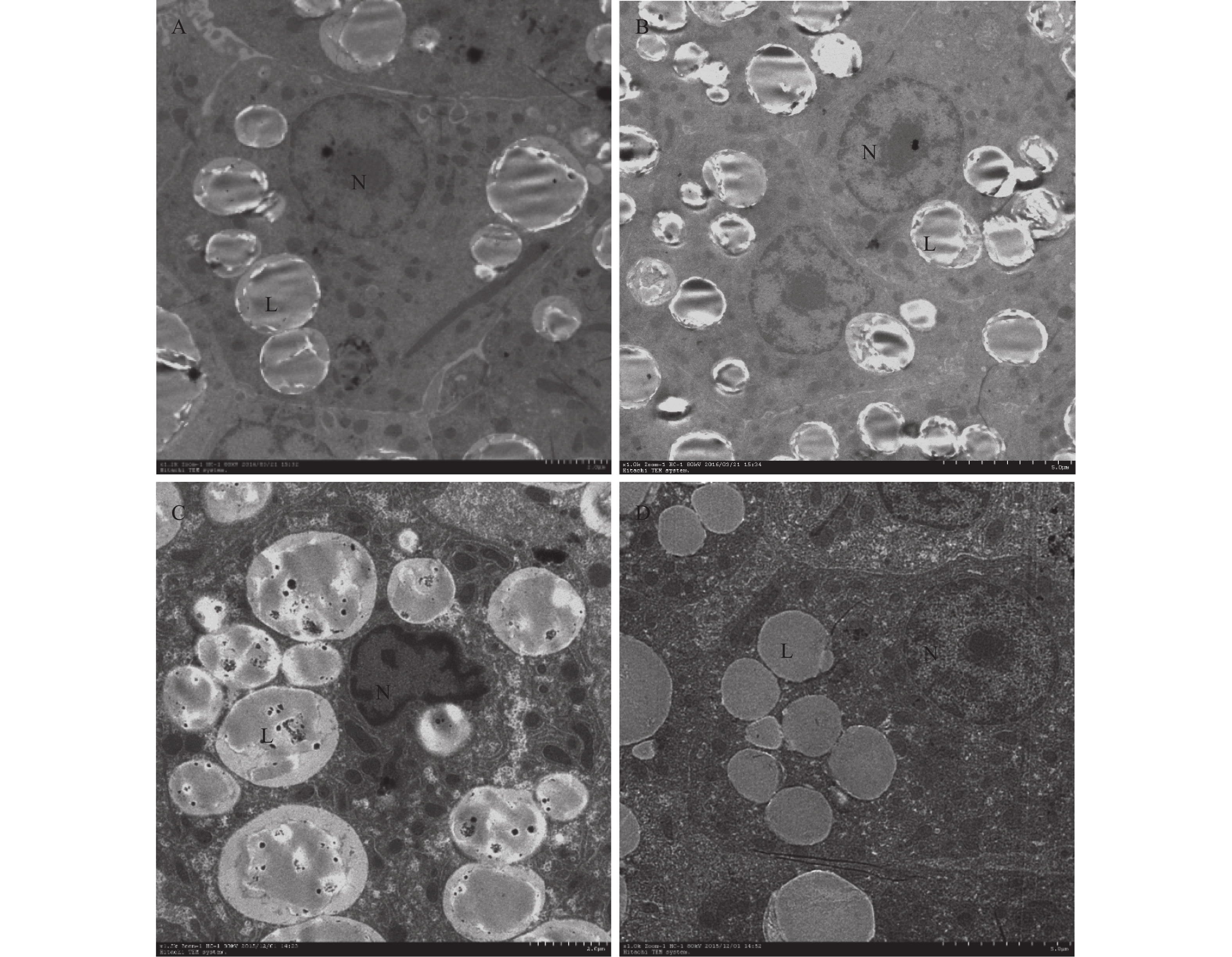
正常日粮组的团头鲂肝细胞肝小叶完整并排列有序, 同时细胞核位于细胞体中央位置(图 5A)。然而, 高脂组的肝细胞发现大量脂滴, 细胞内的脂滴导致细胞核偏移到细胞边缘以及细胞质流失(图 5C)。黄连素的添加可以显著地改善这些异常状态并使肝细胞恢复到较为正常的状态(图 5D)。在添加黄连素的正常日粮组的肝细胞中, 脂滴数量和脂质空泡化略微增多(图 5B)。
![]() 图 5 团头鲂肝细胞的透射电镜图A. 正常日粮饲喂的团头鲂的肝细胞具有正常的细胞结构; B. 正常日粮与黄连素饲喂的团头鲂的肝细胞中出现了较多的脂滴; C. 高脂日粮饲喂的团头鲂的肝细胞中形成了大量的大脂滴; D. 高脂日粮与黄连素饲喂的团头鲂的肝细胞脂滴数量明显减少; N表示细胞核, L表示脂肪滴Figure 5. Transmission electron microscope (TEM) images of hepatocytes in blunt snout breamA. Normal structure hepatocytes in fish fed control diet; B. Hepatocytes with a lot more lipid droplets exist in the fish fed with the supplement of berberine in normal diet; C. extensive intracellular lipid droplets present in the hepatocytes of fish fed with high-fat diet; D. Hepatocytes structural abnormalities of high-fat status alleviating with berberine; N represented Nucleus, L represented lipid droplet
图 5 团头鲂肝细胞的透射电镜图A. 正常日粮饲喂的团头鲂的肝细胞具有正常的细胞结构; B. 正常日粮与黄连素饲喂的团头鲂的肝细胞中出现了较多的脂滴; C. 高脂日粮饲喂的团头鲂的肝细胞中形成了大量的大脂滴; D. 高脂日粮与黄连素饲喂的团头鲂的肝细胞脂滴数量明显减少; N表示细胞核, L表示脂肪滴Figure 5. Transmission electron microscope (TEM) images of hepatocytes in blunt snout breamA. Normal structure hepatocytes in fish fed control diet; B. Hepatocytes with a lot more lipid droplets exist in the fish fed with the supplement of berberine in normal diet; C. extensive intracellular lipid droplets present in the hepatocytes of fish fed with high-fat diet; D. Hepatocytes structural abnormalities of high-fat status alleviating with berberine; N represented Nucleus, L represented lipid droplet2.9 肝胰腺和肌肉的脂肪酸组成
如表 5所示, 肝胰腺和肌肉组织的脂肪酸组成差异显著。在肝胰腺中, 与正常日粮组相比, 高脂组的C18: 0和 C18: 1n-9含量显著降低(P<0.05), 而C18: 2n-6、C18: 3n-3、C20: 5n-3、C22: 5n-3、C22: 6n-3、n-3 LC-PUFA和n-6 LCPUFA含量显著升高(P<0.05);高脂+黄连素组的C18: 0、C18: 1n-9、C18: 2n-6、C18: 3n-3、C20: 5n-3、C22: 5n-3、C22: 6n-3和n-3LC-PUFA含量差异不显著。在肌肉组织中, 与正常日粮组相比, 高脂组的C16:1n-9和C18:1n-9显著降低(P<0.05),C18: 2n-6、 C22: 6n-3、n-3 LC-PUFA和n-6LC-PUFA含量显著升高(P<0.05);高脂+黄连素组的C16:1n-9和 C18:1n-9显著降低(P<0.05), 但是C18: 2n-6、C22: 6n-3、n-3 LC-PUFA和n-6 LC-PUFA含量差异不显著(P>0.05)。
表 5 团头鲂肝胰腺及肌肉脂肪酸组成Table 5. The composition of fatty acid, hepatopancreas and muscles of blunt snout bream fed with different diets脂肪酸
Fatty acid肝胰腺Hepatopancreas 肌肉Muscle 正常日粮
ND正常+黄连素
NDB高脂日粮
HD高脂+黄连素
HDB正常日粮
ND正常+黄连素
NDB高脂日粮
HD高脂+黄连素
HDBC14: 0 1.26±0.06 1.00±0.16 1.28±0.23 1.08±0.03 0.90±0.09a 0.83±0.08ab 0.99±0.06a 0.67±0.04b C16: 0 20.64±0.61 20.39±0.41 19.81±0.47 21.26±1.11 20.93±0.71a 21.40±0.93a 20.33±0.69ab 19.33±0.40b C18: 0 16.56±0.45a 16.34±0.53a 14.77±0.72b 15.85±0.89ab 10.36±0.42ab 10.09±0.69ab 9.61±0.68b 11.11±0.81a C20: 0 0.12±0.02 0.14±0.01 0.13±0.01 0.12±0.01 0.12±0.01 0.13±0.01 0.16±0.01 0.16±0.02 ∑SFA 38.60±1.68 38.28±0.77 36.77±1.47 38.57±1.61 32.60±0.30 31.80±0.45 31.36±0.61 31.61±1.03 C16: 1n-9 2.62±0.07 2.80±0.22 2.33±0.16 2.25±0.17 3.36±0.26a 2.52±0.22ab 1.96±0.22b 1.81±0.21b C18: 1n-9 46.28±1.06a 41.70±2.21b 41.58±1.54b 42.95±2.16ab 33.86±0.34a 28.04±0.64b 27.68±1.02b 28.06±1.97b C20: 1n-9 1.25±0.03ab 1.35±0.03ab 1.40±0.03a 1.14±0.03b 1.08±0.07 0.95±0.05 0.82±0.07 1.05±0.12 ∑MUFA 50.08±0.66 46.38±2.73 45.68±1.80 46.36±3.87 38.46±0.17a 32.64±1.09b 30.57±3.21b 31.80±1.31b C18: 2n-6 3.13±0.24c 6.68±0.17bc 8.62±0.14a 7.68±0.39ab 16.18±0.26b 15.80±1.16b 19.29±0.76a 17.80±0.81ab C18: 3n-3 0.19±0.04b 0.32±0.09ab 0.44±0.06a 0.36±0.06ab 1.10±0.05ab 1.08±0.05ab 1.21±0.03a 0.89±0.07b C20: 5n-3EPA 0.13±0.02b 0.18±0.04ab 0.21±0.01a 0.10±0.02b 0.81±0.02 0.83±0.11 0.89±0.10 0.78±0.08 C22: 5n-3 0.06±0.01b 0.09±0.02ab 0.11±0.01a 0.05±0.02b 0.29±0.02b 0.45±0.04a 0.37±0.03ab 0.26±0.05b C22: 6n-3 2.36±0.12b 2.73±0.32ab 3.18±0.22a 2.80±0.17ab 3.22±0.07b 6.22±0.57a 6.28±0.30a 4.69±0.69ab ∑PUFA 11.85±1.60b 15.52±2.83ab 17.51±1.63a 15.73±1.80ab 28.89±0.32b 35.56±1.50a 38.06±3.29a 36.49±0.81a ∑n-3 2.76±0.41b 3.32±0.59ab 3.95±0.47a 3.31±0.77ab 5.43±0.11b 8.57±1.08a 8.75±2.72a 6.62±0.90b ∑n-6 3.13±0.24c 6.68±0.17bc 8.62±0.14a 7.68±0.39ab 16.18±0.26b 15.80±1.16b 19.29±0.76a 17.80±0.81ab 3. 讨论
3.1 GPR43基因cDNA全长的克隆及序列分析
G蛋白偶联受体(G protein-coupled receptors, GPCR)是一大类具有7次跨膜α螺旋结构的膜蛋白受体的统称[12], 这类受体家族的大部分成员均能介导各类神经和激素传导引起的细胞应答, 参与众多细胞信号转导过程, 具有广泛的生物学功能[13]。GPR43(G protein coupled receptor 43)即为该受体(GPCRs)家族中的一员, 已有众多研究显示, GPR43对于肥胖、糖尿病等常见代谢性疾病的防治均能起到关键性的作用。从1997年Sawzdargo等[14]发现GPR43基因以来, 关于它的研究还主要集中在大型哺乳动物、反刍动物和啮齿动物等物种上, 而水产动物上有关GPR43基因的相关研究寥寥无几。从高等动物体上的研究得知, GPR43基因主要分布在机体的肠道上皮组织、脂肪组织、免疫组织、淋巴组织以及嗜中性粒细胞等部分[15]。本研究首次克隆了团头鲂GPR43基因的cDNA序列, 并采用RT-PCR技术探讨了该基因在团头鲂各个组织中的表达情况, 结果显示表达量相对较高的组织为肠道、肌肉、鳃和肝胰腺, 其次是脑、肾脏和腹脂, 表达较低的则是脾脏、心脏和皮肤。Dass等[16]在对大鼠(Rattus norvegicus)的研究中也发现了GPR43在整个大鼠的胃肠道中都有表达, 其中在结肠中表达量最高。
3.2 GPR43基因在团头鲂不同组织中的表达分析
王永安等[17]在高脂饲喂小鼠(Mus musculus)的研究中发现, 短链脂肪酸能够在GPR43的帮助下有效抑制脂肪细胞中异丙肾上腺素介导的有关脂解作用; 而在丙酸盐处理的3T3-L1脂肪细胞的诱导分化的过程中[18], GPR43的表达量会随着PPARγ表达量的增加而增加, 当使用siRNA技术沉默了GPR43的表达后, 脂肪细胞的分化进程也受到了明显的阻碍。以上研究结果充分表明, GPR43受体在脂肪细胞的增殖与分化过程中都有着不可或缺的作用[19]。本实验通过养殖试验探究了高脂环境与黄连素的作用对该基因表达的影响, 结果表明, 在高脂投喂团头鲂的肠道、肝胰腺和肌肉组织中, GPR43的表达量均有所降低, 功能性饲料添加剂黄连素的使用则有效提高了GPR43在这些组织中的表达量[17]。
3.3 黄连素对团头鲂肝胰腺脂肪代谢相关基因的分析
肝胰腺内脂肪代谢平衡是一个极其复杂的过程, 包括脂质的分泌, 转运和摄取。在自然生理条件下, 脂肪的分泌和摄取之间存在动态平衡[20]。在小鼠中, 肝胰腺脂质分泌的阻塞是肝胰腺脂肪沉积的主要原因[21]。在本研究中, 与对照组相比, 高脂组的血浆甘油三酯浓度显著增加, 这表明了内源性脂肪转运处于活跃状态。肉碱棕榈酰转移酶Ⅰ(CPTⅠ)是肝胰腺组织细胞中长链脂肪酸β-氧化的关键调节酶和限速酶, 其活性是影响脂肪酸氧化的关键因素。而过氧化物酶体增殖因子(PPARs)对CPTⅠ在转录水平的调控对脂肪代谢有着非常重要的意义, 在一定条件下可以调控CPTⅠ的表达, 其中PPARα与CPTⅠ在肝胰腺中的表达呈线性关系[10]。PPARα具有改善脂代谢紊乱的作用, PPARβ亦是目前预防和治疗肥胖病症的潜在靶标, 在脂代谢中具有重要调节作用,PPARγ则主要分布于脂肪组织, 能够诱导脂肪细胞的分化与形成[22]。我们的研究结果显示, 高脂组的CPTⅠ、PPARα与PPARβ 的mRNA表达量低于对照组, 表明当脂肪摄入过量时, 肝胰脏脂肪生成减少, 添加黄连素可以显著地提高其mRNA表达。与前人的研究相似, 当脂肪摄入量增多时, 上述基因表达就会被抑制[23]。一个可能的原因是高脂组中外源性脂肪摄入量的增加抑制了内源性合成, 以维持从饲料中吸收的外源性脂肪和内源性脂肪合成之间的动态平衡[24]。
AMP-依赖性蛋白激酶(AMPK)是细胞能量状态和压力传感器, 能促进脂肪酸转运到线粒体[25]。AMPK通过激活ATP产生途径来调节能量代谢, 这些途径主要包括糖酵解, 脂肪酸氧化以及抑制ATP消耗途径(脂肪酸和胆固醇合成)。激活AMPK可能作为缓解脂质沉积的重要途径[26]。丝裂原活化蛋白激酶(MAPK)是一种丝氨酸/苏氨酸蛋白激酶[27], 在有机体的细胞中具有不可或缺的作用, 参与细胞增殖、分化、转化和凋亡的调节, 同时与炎症的发生过程以及肿瘤等相关疾病的形成均有联系。p38是MAPKs家族的主要成员之一[28]。研究表明, p38介导的信号通路也参与肝胰腺脂肪的沉积[29]。本研究发现, 与对照组相比, 高脂组的p38
mRNA表达量显著升高, 这表明有过多脂肪在肝胰腺中沉积。在高脂日粮中添加黄连素可以明显降低p38的mRNA表达量, 表明黄连素能够有效地缓解高脂诱导的脂肪沉积。相应地, AMPK的mRNA表达量与p38呈现了相反的趋势, 这也进一步验证了黄连素对肝胰脏组织的保护作用。 3.4 黄连素对团头鲂肝细胞超微结构的分析
一般来说, 某些异常情况会存在于患有脂肪肝的鱼体肝胰腺中, 这不仅反映在会有大量的脂滴形成, 同时也反映在肝细胞超微结构的异常变化。这些异常情况不仅意味着肝功能损伤, 还体现了机体的异常代谢状态[30]。在本研究中, 对照组中能观察到正常的肝细胞(图 5A), 该细胞含有均匀的细胞质, 清晰的核膜和较少的脂滴。高脂组肝细胞的异常结构(图 5C)包括: 脂滴过度积累, 肝细胞变形以及细胞核的偏移和塌陷。这些异常证实了肝胰腺中的脂质过量沉积可导致肝细胞的损伤。此外, 添加黄连素可以有效地缓解这些异常病变, 高脂组添加黄连素后脂滴结构变小(图 5D), 肝细胞并未被脂滴所挤压, 呈现出较为健康的形态, 核仁与核膜亦是清晰可见, 与上述研究一致。值得注意的是, 在正常日粮组中添加黄连素却会导致更多的脂滴形成(图 5B), 表明黄连素在正常日粮中的添加作用是有异于高脂日粮的, 这种不同的代谢作用机制还有待进一步研究。
3.5 黄连素对团头鲂肝脏和肌肉脂肪酸的分析
脂肪酸的组成情况能够在一定程度上体现出鱼体的脂肪代谢状态, 饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)均为脂肪酸β氧化循环中的最适底物[31], 因此, 当底物足够时, 它们将优先用于氧化产能[32]。在我们的试验中, 高脂组肝胰腺和肌肉组织中的SFA和MUFA含量均低于对照组, 这可能与上述原因有关。多不饱和脂肪酸(PUFA)则主要通过脂蛋白外向转运[33]。我们通过对脂肪酸组成分析发现, 肌肉中的DHA含量显著高于肝胰腺中的DHA含量, 这表明肝胰腺中的DHA很少用于氧化产能, 而是主要由脂蛋白转运出肝胰腺。因此, 一旦脂蛋白的分泌被阻断, DHA就容易在肝胰腺中积累。我们的研究结果表明黄连素能够减少肝胰腺和肌肉组织中的DHA沉积, 改善高脂条件下鱼体组织的脂肪酸代谢异常。
4. 结论
在本研究中, 我们通过RACE技术克隆得到了团头鲂GPR43基因的全长cDNA序列, 并且考查了该基因在相关组织中不同条件作用下的表达变化, 结果显示黄连素的作用能够明显上调GPR43在高脂抑制下的表达量, 同时结合脂肪代谢酶活、组织学观察、脂肪酸组成以及相关基因表达的结果发现, 黄连素能够缓解过多脂肪摄入导致的肝胰腺损伤。因此我们进一步推测, 黄连素对于脂肪代谢的调控作用是通过GPR43受体来实现的。此外, 关于黄连素在正常脂肪环境中的可能作用机制还需要更多的研究来阐明。
-
图 1 根据NJ法构建的GPR43氨基酸序列系统进化树
每个节点处的数字表示自展支持率, 自展值检验为1000次重复抽样。GenBank序列号分别为: 大鼠(BAD02826.1)、沙漠林鼠(OBS72789.1)、达马拉鼹鼠(KFO32380.1)、人类(AAB86713.1)、食蟹猴(EHH59466.1)、家兔(AOE47572.1)、猪(NP_001265687.1)、骆驼 (EPY81301.1)、牛 (ACM07438.1)、山羊(NP_001272584.1)、熊猫(EFB29861.1)、牙鲆(ALJ30163.1)
Figure 1. Phylogenetic tree of the GPR43 amino acid sequence with Neighbour-Joining method
Numbers at nodes indicate the bootstrap value (%) that obtained from 1000 replicates. GenBank Accession No.: Rattus norvegicus (BAD02826.1), Neotoma lepida (OBS72789.1), Fukomys damarensis (KFO32380.1), Homo sapiens (AAB86713.1), Macaca fascicularis (EHH59466.1), Oryctolagus cuniculus (AOE47572.1), Sus scrofa (NP_001265687.1), Camelus ferus (EPY81301.1), Bos taurus (ACM07438.1), Capra hircus (NP_001272584.1), Ailuropoda melanoleuca (EFB29861.1), Paralichthys olivaceus (ALJ30163.1)
图 5 团头鲂肝细胞的透射电镜图
A. 正常日粮饲喂的团头鲂的肝细胞具有正常的细胞结构; B. 正常日粮与黄连素饲喂的团头鲂的肝细胞中出现了较多的脂滴; C. 高脂日粮饲喂的团头鲂的肝细胞中形成了大量的大脂滴; D. 高脂日粮与黄连素饲喂的团头鲂的肝细胞脂滴数量明显减少; N表示细胞核, L表示脂肪滴
Figure 5. Transmission electron microscope (TEM) images of hepatocytes in blunt snout bream
A. Normal structure hepatocytes in fish fed control diet; B. Hepatocytes with a lot more lipid droplets exist in the fish fed with the supplement of berberine in normal diet; C. extensive intracellular lipid droplets present in the hepatocytes of fish fed with high-fat diet; D. Hepatocytes structural abnormalities of high-fat status alleviating with berberine; N represented Nucleus, L represented lipid droplet
表 1 试验所用饲料的配方及营养组成
Table 1 Formulation and composition of experimental diets
原料
Ingredient正常日粮
Normal diet (%)高脂日粮
High-fat diet (%)鱼粉Fish meal 5.00 5.00 豆粕Soybean meal 26.00 25.82 菜粕Rapeseed meal 11.86 11.86 棉粕Cottonseed meal 12.58 12.58 麸皮Wheat bran 10.00 4.00 面粉Wheat meal 28.50 28.50 猪油Lard oil 1.33 4.42 豆油Soybean oil 1.33 4.42 磷酸二氢钙Calciumbiphosphate 2.00 2.00 复合预混料aPremix 1.00 1.00 食盐Salt 0.40 0.40 饲料营养组成Proximate composition (%) 水分Moisture 13.90 11.22 粗蛋白Crude protein 29.64 29.38 粗脂肪Crude Lipid 4.77 10.10 能量Energy (MJ/kg) 17.05 18.80 注: a 每千克预混料中含有:CuSO4·5H2O 2.0 g;FeSO4·7H2O 25 g;ZnSO4·7H2O 22 g;MnSO4·4H2O 7 g;Na2SeO3 0.04 g;KI 0.026 g;CoCl2·6H2O 0.1 g;维生素A 900000 IU;维生素D 200000 IU; 维生素E 4500 mg; 维生素K 3220 mg; 维生素B1 320 mg; 维生素B2 1090 mg; 烟酸2000 mg; 维生素B6 500 mg; 维生素B12 1.6 mg; 维生素C 5000 mg; 泛酸1000 mg; 叶酸165mg; 胆碱60000 mg; 生物素1.2 mg;肌醇15000 mg Note: aPremix supplied the following minerals (g/kg) and vitamins (IU or mg/kg): CuSO4·5H2O, 2.0 g; FeSO4·7H2O, 25 g; ZnSO4·7H2O, 22 g; MnSO4·4H2O, 7 g; Na2SeO3, 0.04 g; KI, 0.026 g; CoCl2·6H2O, 0.1 g; Vitamin A, 900000 IU; Vitamin D, 200000 IU; Vitamin E, 4500 mg; Vitamin K, 3220 mg; Vitamin B1, 320 mg; Vitamin B2, 1090 mg; Niacin, 2000 mg; Vitamin B6, 500 mg; Vitamin B12, 1.6 mg; Vitamin C, 5000 mg; Pantothenate, 1000 mg; Folic acid, 165 mg; Choline, 60000 mg; Biotin, 1.2 mg; Myoinositol 15000 mg 表 2 定量PCR引物序列
Table 2 Nucleotide sequences of the primers used to assay gene expression by real-time PCR
目的基因
Target gene序列
Sequence (5′—3′)CPTⅠ-F TACTTCCAAAGCGGTGAG CPTⅠ-R AGAGGTATTGTCCGAGCC PPAR α-F GTGCCAATACTGTCGCTTTCAG PPAR α-R CCGCCTTTAACCTCAGCTTCT PPAR β-F CATCCTCACGGGCAAGAC PPAR β-R CACTGGCAGCGGTAGAAG PPAR γ-F AGCTTCAAGCGAATGGTTCTG PPAR γ-R AGGCCTCGGGCTTCCA AMPK-F GCGACGGACAAACAGAAACA AMPK-R TTCCCCACCACATCCAGACT p38-F CACTCGCATTCCAAGCAGAC p38-R GCATCAAACGCAGAGCAAAC β-actin-F CGGACAGGTCATCACCATTG β-actin-R CGCAAGACTCCATACCCAAGA 表 3 不同日粮投喂对团头鲂血浆生化指标的影响
Table 3 Results of blood biochemistry in blunt snout bream fed with different diets
组别
Group游离脂肪酸
FFA (mmol/L)总胆固醇
TC (mmol/L)甘油三酯
TG (mmol/L)正常日粮ND 0.77±0.04ab 7.81±0.34ab 3.06±0.33 正常+黄连素NDB 0.73±0.06b 8.91±0.37ab 3.20±0.49 高脂日粮HD 0.83±0.10a 9.64±0.98a 3.64±0.19 高脂+黄连素HDB 0.73±0.06b 7.40±0.63b 3.02±0.19 注: 所有数值均以均值±标准误(Mean±SEM)进行表示; 每一列数据中标有不同字母者即为差异显著(P<0.05); 下同 Note: All values are expressed as Means±SEM Data in the same line with different letters showed significantly difference (P<0.05); the same applies below 表 4 不同日粮投喂下团头鲂肝胰腺脂代谢因子的相对表达量
Table 4 Relative gene expression for lipid metabolic genes in hepatopancreas of blunt snout bream fed with different diets
组别Group 肉碱棕榈酰基转移酶ⅠCPTⅠ 过氧化物酶体增值因子 PPARα PPARβ PPARγ 正常日粮ND 1.00±0.07a 1.00±0.06b 1.00±0.08b 1.00±0.08 正常+黄连素NDB 0.99±0.06a 0.83±0.06b 0.78±0.12b 1.02±0.09 高脂日粮HD 0.75±0.10b 0.83±0.08b 0.78±0.14b 0.86±0.06 高脂+黄连素HDB 1.17±0.11a 1.59±0.16a 1.60±0.08a 1.01±0.02 表 5 团头鲂肝胰腺及肌肉脂肪酸组成
Table 5 The composition of fatty acid, hepatopancreas and muscles of blunt snout bream fed with different diets
脂肪酸
Fatty acid肝胰腺Hepatopancreas 肌肉Muscle 正常日粮
ND正常+黄连素
NDB高脂日粮
HD高脂+黄连素
HDB正常日粮
ND正常+黄连素
NDB高脂日粮
HD高脂+黄连素
HDBC14: 0 1.26±0.06 1.00±0.16 1.28±0.23 1.08±0.03 0.90±0.09a 0.83±0.08ab 0.99±0.06a 0.67±0.04b C16: 0 20.64±0.61 20.39±0.41 19.81±0.47 21.26±1.11 20.93±0.71a 21.40±0.93a 20.33±0.69ab 19.33±0.40b C18: 0 16.56±0.45a 16.34±0.53a 14.77±0.72b 15.85±0.89ab 10.36±0.42ab 10.09±0.69ab 9.61±0.68b 11.11±0.81a C20: 0 0.12±0.02 0.14±0.01 0.13±0.01 0.12±0.01 0.12±0.01 0.13±0.01 0.16±0.01 0.16±0.02 ∑SFA 38.60±1.68 38.28±0.77 36.77±1.47 38.57±1.61 32.60±0.30 31.80±0.45 31.36±0.61 31.61±1.03 C16: 1n-9 2.62±0.07 2.80±0.22 2.33±0.16 2.25±0.17 3.36±0.26a 2.52±0.22ab 1.96±0.22b 1.81±0.21b C18: 1n-9 46.28±1.06a 41.70±2.21b 41.58±1.54b 42.95±2.16ab 33.86±0.34a 28.04±0.64b 27.68±1.02b 28.06±1.97b C20: 1n-9 1.25±0.03ab 1.35±0.03ab 1.40±0.03a 1.14±0.03b 1.08±0.07 0.95±0.05 0.82±0.07 1.05±0.12 ∑MUFA 50.08±0.66 46.38±2.73 45.68±1.80 46.36±3.87 38.46±0.17a 32.64±1.09b 30.57±3.21b 31.80±1.31b C18: 2n-6 3.13±0.24c 6.68±0.17bc 8.62±0.14a 7.68±0.39ab 16.18±0.26b 15.80±1.16b 19.29±0.76a 17.80±0.81ab C18: 3n-3 0.19±0.04b 0.32±0.09ab 0.44±0.06a 0.36±0.06ab 1.10±0.05ab 1.08±0.05ab 1.21±0.03a 0.89±0.07b C20: 5n-3EPA 0.13±0.02b 0.18±0.04ab 0.21±0.01a 0.10±0.02b 0.81±0.02 0.83±0.11 0.89±0.10 0.78±0.08 C22: 5n-3 0.06±0.01b 0.09±0.02ab 0.11±0.01a 0.05±0.02b 0.29±0.02b 0.45±0.04a 0.37±0.03ab 0.26±0.05b C22: 6n-3 2.36±0.12b 2.73±0.32ab 3.18±0.22a 2.80±0.17ab 3.22±0.07b 6.22±0.57a 6.28±0.30a 4.69±0.69ab ∑PUFA 11.85±1.60b 15.52±2.83ab 17.51±1.63a 15.73±1.80ab 28.89±0.32b 35.56±1.50a 38.06±3.29a 36.49±0.81a ∑n-3 2.76±0.41b 3.32±0.59ab 3.95±0.47a 3.31±0.77ab 5.43±0.11b 8.57±1.08a 8.75±2.72a 6.62±0.90b ∑n-6 3.13±0.24c 6.68±0.17bc 8.62±0.14a 7.68±0.39ab 16.18±0.26b 15.80±1.16b 19.29±0.76a 17.80±0.81ab -
[1] 李明秀, 石元刚. 膳食纤维与肠道功能. 第三军医大学学报, 1999, 21(8): 69—70 Li M X, Shi G Y. Dietary fiber and the function of intestine [J]. Acta Academiae Medicinae Militaris Tertiae, 1992, 21(8): 69—70
李明秀, 石元刚. 膳食纤维与肠道功能. 第三军医大学学报, 1999, 21(8): 69—70[2] 詹彦, 支兴刚. 短链脂肪酸的再认识. 实用临床医学, 2007, 8(1): 134—135 Zhan Y, Zhi X G. Re-understanding of short-chain fatty acids [J]. Practical Clinical Medicine, 2007, 8(1): 134—135
詹彦, 支兴刚. 短链脂肪酸的再认识. 实用临床医学, 2007, 8(1): 134—135[3] 曾军英, 孙志洪, 谭支良. 游离脂肪酸受体蛋白研究进展. 生命科学, 2008, 20(3): 472—476 Zeng J Y, Sun, Z H, Tan Z L. G protein-coupled receptors for free fatty acids [J]. Chinese Bulletin of Life Sciences, 2008, 20(3): 472—476
曾军英, 孙志洪, 谭支良. 游离脂肪酸受体蛋白研究进展. 生命科学, 2008, 20(3): 472—476[4] 黄巧艳. 中链脂肪酸受体Gpr84基因在斑马鱼中的时空表达及免疫功能研究. 硕士学位论文, 中国海洋大学. 2014 Huang Q Y. A medium-chain fatty acid receptor Gpr84 in zebrafish: expression pattern and roles in immune regulation [D]. Thesis for Master of Science. Ocean University of China. 2014
黄巧艳. 中链脂肪酸受体Gpr84基因在斑马鱼中的时空表达及免疫功能研究. 硕士学位论文, 中国海洋大学. 2014[5] 王永安. 黄牛GPR41和GPR43基因多态性及其与生长性状相关性研究. 硕士学位论文, 江苏师范大学. 2014 Wang Y A. The polymorphisms of bovine GPR41 and GPR43 gene and their associations with growth traits [D]. Thesis for Master of Science. Jiangsu Normal University. 2014
王永安. 黄牛GPR41和GPR43基因多态性及其与生长性状相关性研究. 硕士学位论文, 江苏师范大学. 2014[6] Li X F, Jiang Y Y, Liu W B, et al. Protein-sparing effect of dietary lipid in practical diets for blunt snout bream (Megalobrama amblycephala) fingerlings: effects on digestive and metabolic responses [J]. Fish Physiology & Biochemistry, 2012, 38(2): 529—541
[7] 杨建梅, 王安利, 霍湘, 等. 鱼类利用脂肪节约蛋白的研究进展. 水利渔业, 2007, 26(1): 74—76 Yang J M, Wang A L, Huo X, et al. The research in fish utilization of fat-saving proteins [J]. Water Fisheries, 2007, 26(1): 74—76
杨建梅, 王安利, 霍湘, 等. 鱼类利用脂肪节约蛋白的研究进展. 水利渔业, 2007, 26(1): 74—76[8] Li J Y, Zhang D D, Xu W N, et al. Effects of dietary choline supplementation on growth performance and hepatic lipid transport in blunt snout bream (Megalobrama amblycephala) fed high-fat diets [J]. Aquaculture, 2014, 434: 340—347
[9] Lu, K L, Xu, W N, Li, X F, et al. Hepatic triacylglycerol secretion, lipid transport and tissue lipid uptake in blunt snout bream (Megalobrama amblycephala) fed high-fat diet [J]. Aquaculture, 2013, 408(9): 160—168
[10] 鲁康乐. 高脂日粮诱导团头鲂脂肪肝发生机制及黄连素调控的研究. 博士学位论文, 南京农业大学. 2014 Lu K L. Formation mechanism and regulation of berberine for Fatty liver induced by high-fat diet in blunt snout bream Megalobrama amblycephala [D]. Thesis for Doctor of Science, Nanjing Agriculture University. 2014
鲁康乐. 高脂日粮诱导团头鲂脂肪肝发生机制及黄连素调控的研究. 博士学位论文, 南京农业大学. 2014[11] 闫亚楠, 夏斯蕾, 田红艳, 等. 白藜芦醇对高脂胁迫团头鲂抗氧化能力、非特异免疫机能和抗病力的影响. 水生生物学报, 2017, 41(1): 155—164 Yan Y N, Xia S L, Tian H Y, et al. Effects of resveratrol supplementation on growth performance, immunity, antioxidant capability and disease resistance of blunt snout bream fed high-fat diet [J]. Acta Hydrobiologica Sinica, 2017, 41(1): 155—164
闫亚楠, 夏斯蕾, 田红艳, 等. 白藜芦醇对高脂胁迫团头鲂抗氧化能力、非特异免疫机能和抗病力的影响. 水生生物学报, 2017, 41(1): 155—164[12] 石琳. 猪GHSR基因的克隆及其突变体的药理学特性初探. 博士学位论文, 扬州大学. 2014 Shi L. Molecular cloning of pig ghrelin receptor gene and pharmacological characterization of its mutants [D]. Thesis for Doctor of Science, Yangzhou University. 2014
石琳. 猪GHSR基因的克隆及其突变体的药理学特性初探. 博士学位论文, 扬州大学. 2014[13] 刘永学, 余少平. 孤儿G蛋白偶联受体及其作为新药靶点的重要意义. 中国药理学通报, 2003, 19(6): 601—604 Liu Y X, Yu S P. Orphan G protein-coupled receptors and their significance as novel drug targets [J]. Chinese Pharmacological Bulletin, 2003, 19(6): 601—604
刘永学, 余少平. 孤儿G蛋白偶联受体及其作为新药靶点的重要意义. 中国药理学通报, 2003, 19(6): 601—604[14] Sawzdargo M, Nguyen T, Nguyen T. A cluster of four novel human G protein-coupled receptor genes occurring in close proximity to CD22 gene on chromosome 19q13.1 [J]. Biochemical & Biophysical Research Communications, 1997, 239(2): 543—547
[15] 苏浩. 兔短链脂肪酸受体GPR41和GPR43基因的鉴定. 博士学位论文, 南京农业大学. 2013 Su H. Identification of the short-chain fatty acid receptor GPR41 and GPR43 genes of rabbit [D]. Thesis for Doctor of Science, Nanjing Agriculture University. 2013
苏浩. 兔短链脂肪酸受体GPR41和GPR43基因的鉴定. 博士学位论文, 南京农业大学. 2013[16] Dass N B, John A K, Bassil A K, et al. The relationship between the effects of short-chain fatty acids on intestinal motility in vitro and GPR43 receptor activation [J]. Neurogastroenterology and Motility: the Official Journal of the European Gastrointestinal Motility Society, 2007, 19(1): 66—74
[17] 王永安, 张春雷, 王艳红, 等. 短链脂肪酸受体GPR41、GPR43的信号通路及生理功能. 中国牛业科学, 2013, 39(6): 49—53 Wang Y A, Zhang C L, Wang Y H, et al. Signal pathway and physiological functions of short chain fatty acid receptor GPR41 and GPR43 [J]. China Cattle Science, 2013, 39(6): 49—53
王永安, 张春雷, 王艳红, 等. 短链脂肪酸受体GPR41、GPR43的信号通路及生理功能. 中国牛业科学, 2013, 39(6): 49—53[18] 王毅飞, 伊娜, 邢飞跃, 等. 亮氨酸拉链蛋白对前脂肪细胞增殖、分化及相关基因表达的影响. 广州医学院学报, 2015, (2): 5—9 Wang Y F, Yi N, Xing F Y, et al. Effect of GILZ on preadipocytes proliferation, differentiation and related adipocytes gene expressions [J]. Academic Journal of Guangzhou Medical College, 2015, (2): 5—9
王毅飞, 伊娜, 邢飞跃, 等. 亮氨酸拉链蛋白对前脂肪细胞增殖、分化及相关基因表达的影响. 广州医学院学报, 2015, (2): 5—9[19] 向钊, 龙火生, 庞卫军, 等. IGF对前体脂肪细胞增殖分化影响的研究进展. 四川畜牧兽医, 2002, 29(9): 29—30 Xiang Z, Long H S, Pang W J, et al. Advance of IGF effect on Preadipocytes' proliferation and differentiation [J]. Sichuan Animal & Veterinary Sciences, 2002, 29(9): 29—30
向钊, 龙火生, 庞卫军, 等. IGF对前体脂肪细胞增殖分化影响的研究进展. 四川畜牧兽医, 2002, 29(9): 29—30[20] 胡克章, 黄正明. 脂肪肝的发病机制与防治. 解放军药学学报, 2008, 24(5): 433—436 Hu K Z, Huang Z M. Pathogenesis and prevention of fatty liver [J]. Pharmaceutical Journal of Chinese People’s Liberation Army, 2008, 24(5): 433—436
胡克章, 黄正明. 脂肪肝的发病机制与防治. 解放军药学学报, 2008, 24(5): 433—436[21] 杜慧. 高脂高胆固醇饮食喂养的apoE小鼠肝脏脂代谢相关基因的表达研究. 硕士学位论文, 山东师范大学. 2009 Du H. Expression of lipid metabolism related genes in liver tissue of ApoE mice fed with high fat and high cholesterol diet [D]. Thesis for Master of Science, Shandong Normal University. 2009
杜慧. 高脂高胆固醇饮食喂养的apoE小鼠肝脏脂代谢相关基因的表达研究. 硕士学位论文, 山东师范大学. 2009[22] 崔立坤. 新型PPARβ/δ激动剂改善脂代谢紊乱和胰岛素耐受性的药理学作用及机制研究. 沈阳药科大学. 2009 Cui L K. The Pharmacology effect and mechanism of PPAR delta Agonists improving lipid metabolism disorder [D]. Thesis for Master of Science, Shenyang Pharmaceutical University. 2009
崔立坤. 新型PPARβ/δ激动剂改善脂代谢紊乱和胰岛素耐受性的药理学作用及机制研究. 沈阳药科大学. 2009[23] 施军平, 陈芝芸, 包剑锋, 等. 高脂饮食诱导的非酒精性脂肪性肝病大鼠肝组织PPARα和CPT-I mRNA的表达. 浙江中医药大学学报, 2007, 31(1): 52—55 Shi J P, Chen Z Y, Bao J F, et al. Expression of PPARα and CPT-I mRNA in liver of rats with nonalcoholic fatty liver disease induced by highly fat-enriched diet [J]. Journal of Zhejiang University of Traditional Chinese Medicine, 2007, 31(1): 52—55
施军平, 陈芝芸, 包剑锋, 等. 高脂饮食诱导的非酒精性脂肪性肝病大鼠肝组织PPARα和CPT-I mRNA的表达. 浙江中医药大学学报, 2007, 31(1): 52—55[24] 燕琼, 张木勋, 张建华. PPAR-α激动剂增加脂肪酸氧化改善高脂诱导的胰岛素抵抗. 中国现代医学杂志, 2004, 14(12): 1—4 Yan Q, Zhang M Y, Zhang J H, et al. PPAR-α activator increases fatty acid oxidation and protects against high fat induced insulin resistance [J]. China Journal of Modern Medicine, 2004, 14(12): 1—4
燕琼, 张木勋, 张建华. PPAR-α激动剂增加脂肪酸氧化改善高脂诱导的胰岛素抵抗. 中国现代医学杂志, 2004, 14(12): 1—4[25] 王艳, 黄德强, 罗志军. AMPK对线粒体功能的调节. 中国细胞生物学学报, 2013, 35(10): 1434—1443 Wang Y, Huang D Q, Luo Z J, et al. AMPK regulate mitochondrial function [J]. Chinese Journal of Cell Biology, 2013, 35(10): 1434—1443
王艳, 黄德强, 罗志军. AMPK对线粒体功能的调节. 中国细胞生物学学报, 2013, 35(10): 1434—1443[26] 王斐. 二甲双胍对高脂饲养大鼠肝胰脏AMPK和PPARs活性影响-改善脂肪肝的可能机制. 山东大学. 2008 Wang F. Non-Aleoholic fatty liver disease is associated with body mass index, waist circumference and fasting plasma glucose in Chinese adults [D]. Thesis for Master of Science, Shandong University. 2008
王斐. 二甲双胍对高脂饲养大鼠肝胰脏AMPK和PPARs活性影响-改善脂肪肝的可能机制. 山东大学. 2008[27] Shackel D B, Shaw R J. The LKB1-AMPK pathway: metabolism and growth control in tumour suppression [J]. Nature Reviews Cancer, 2009, 9(8): 563
[28] Wagner E F, Ángel R. Nebreda. Signal integration by JNK and p38 MAPK pathways in cancer development [J]. Nature Reviews Cancer, 2009, 9(8): 537
[29] Yonezawa T, Kobayashi Y, Obara Y. Short-chain fatty acids induce acute phosphorylation of the p38 mitogen-activated protein kinase/heat shock protein 27 pathway via GPR43 in the MCF-7 human breast cancer cell line [J]. Cellular Signalling, 2007, 19(1): 185—193
[30] 唐传核, 徐建祥, 彭志英. 脂肪酸营养与功能的最新研究. 中国油脂, 2000, 25(6): 20—23 Tang C H, Xu J X, Peng Z Y. A new study on fatty acid nutrition and function [J]. China Oils and Fats, 2000, 25(6): 20—23
唐传核, 徐建祥, 彭志英. 脂肪酸营养与功能的最新研究. 中国油脂, 2000, 25(6): 20—23[31] 罗永康. 7种淡水鱼肌肉和内脏脂肪酸组成的分析. 中国农业大学学报, 2001, 6(4): 108—111 Luo Y K. Fatty acid composition of muscle and guts in seven freshwater fishes [J]. Journal of China Agricultural University, 2001, 6(4): 108—111
罗永康. 7种淡水鱼肌肉和内脏脂肪酸组成的分析. 中国农业大学学报, 2001, 6(4): 108—111[32] 赵林山, 郑海洪, 张淑芹, 等. 脂肪酸与基因表达. 黑龙江畜牧兽医, 2001, (9): 33—34 Zhao L S, Zheng H H, Zhang S Q, et al. Fatty acid and gene expression[J]. Heilongjiang Journal of Animal Science and Veterinary Medicine, 2001, (9): 33—34
赵林山, 郑海洪, 张淑芹, 等. 脂肪酸与基因表达. 黑龙江畜牧兽医, 2001, (9): 33—34[33] 顾国妹, 杨栓平, 邱夏地, 等. 大鼠高脂饮食性和酒精性脂肪肝超微结构比较. 山西医科大学学报, 2001, 32(1): 1—3 Gu G M, Yang S P, Qiu X D, et al. Ultrastructural comparison between high fat diet and alcoholic fatty liver in rats [J]. Journal of Shanxi Medical University, 2001, 32(1): 1—3
顾国妹, 杨栓平, 邱夏地, 等. 大鼠高脂饮食性和酒精性脂肪肝超微结构比较. 山西医科大学学报, 2001, 32(1): 1—3 -
期刊类型引用(2)
1. 刘雅荣,夏耘,魏东,张凯,谢骏,王广军,龚望宝,郁二蒙,孙金辉. 黄连素与聚β-羟基丁酸酯对大口黑鲈生长、免疫和肠道菌群的影响. 南方农业学报. 2024(02): 378-387 .  百度学术
百度学术
2. 魏宇,鲁康乐,王玲,宋凯,张春晓. 饲料中添加黄连素对花鲈生长及脂肪代谢的影响. 动物营养学报. 2021(09): 5193-5202 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: