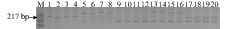MICROSATELLITE MARKERS ANALYSIS OF TWO HYBIRDS OF MEGALOBRAMA TERMINALIS×ERYTHROCULTER ILISHAE- FORMIS, MEGALOBRAMA AMBLYCEPHALA×ERYTHROCULTER ILISHAEFORMIS
-
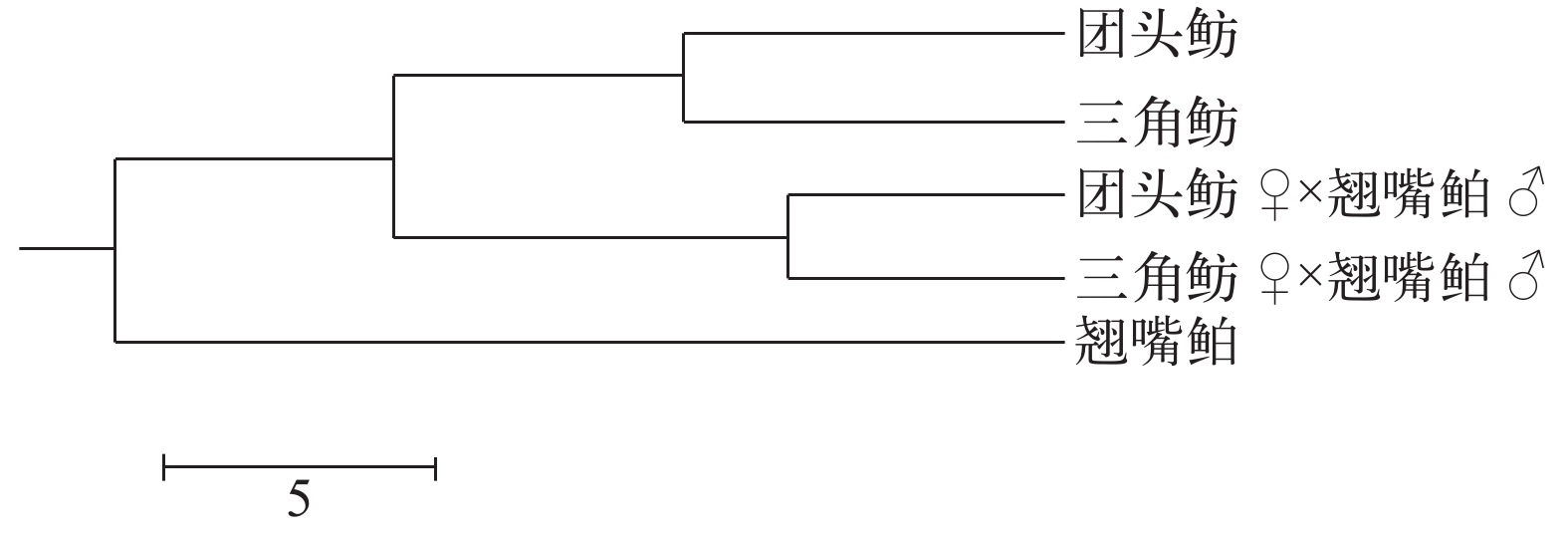
摘要: 为了指导三角鲂(Megalobrama terminalis)、团头鲂(Megalobrama amblycephala) 与翘嘴鲌(Erythroculter ilishaeformis)的杂交育种工作, 利用筛选出的16对微卫星引物, 比较分析了团头鲂、三角鲂、翘嘴鲌、团头鲂♀×翘嘴鲌♂、三角鲂♀×翘嘴鲌♂后代群体的遗传结构; 结果显示, 平均等位基因数(Na)分别为3.56、3.63、3.44、4.00和4.31, 平均观测杂合度(Ho)分别为0.3510、0.3757、0.3175、0.3818和0.4079, 平均期望杂合度(He)分别为0.6182、0.6290、0.5921、0.6490和0.6825, 平均多态信息含量(PIC)分别为0.5354、0.5367、0.5258、0.5785和0.6067。杂交群体的平均多态信息含量均大于他们的亲本团头鲂、三角鲂和翘嘴鲌, 表明杂交亲群体的遗传多样性较高。聚类分析显示团头鲂与三角鲂首先聚类, 团头鲂♀×翘嘴鲌♂与三角鲂♀×翘嘴鲌♂首先聚类, 然后这2大类聚为一支, 最后与翘嘴鲌聚类。其中团头鲂与翘嘴鲌遗传距离最远, 为0.5204, 团头鲂和三角鲂遗传距离最近, 为0.0853, 结合遗传相似度分析表明2种杂交子代均具有母本效应。基因型分析表明, 2种杂交后代的等位基因均来自于父母本。引物TTF3、TTF4、TTF10以及Mam25在5个群体中均可产生特异性条带, 可区分5个群体。研究结果对三角鲂×翘嘴鲌和团头鲂×翘嘴鲌的良种选育、种质资源保存以及种群鉴定具有重要意义。Abstract: To guide breeding of Megalobrama terminalis, Megalobrama amblycephala and Erythroculter ilishaeformis, two hybrids Megalobrama amblycephala×Erythroculter ilishaeformis, Megalobrama terminalis×Erythroculter ilishaeformisand their parents were analyzed using sixteen microsatellite markers. The mean value of number of alleles (Na) were 3.56, 3.63, 3.44, 4.00 and 4.31, respectively. The mean value of observed heterozygosity (Ho) were 0.3510, 0.3757, 0.3175, 0.3818, and 0.4079, respectively. The mean value of expected heterozygosity (He) were 0.6182, 0.6290, 0.5921, 0.6490 and 0.6825, respectively. And the average value of polymorphism information content (PIC) were 0.5354, 0.5367, 0.5258, 0.5785, and 0.6067, respectively. The average value of polymorphism information content (PIC) of two hybrid population were higher than their parent Megalobrama amblycephala, Megalobrama terminalis and Erythroculter ilishaeformis, indicating a high genetic diversity. The unweighted pair-group method with arithmetic means (UPGMA) showed that populations of the Megalobrama amblycephalaand Megalobrama terminalisfirst grouped together, and that Megalobrama amblycephala♀×Erythroculter ilishaeformis♂ andMegalobrama terminalis♀×Erythroculter ilishaeformis♂ first grouped together, and then they clustered with the Erythroculter ilishaeformis. In addition, the farthest genetic distance (0.5204) was between Megalobrama amblycephala and Erythroculter ilishaeformis, and the nearest genetic distance (0.0853) was between Megalobrama amblycephalaand Megalobrama terminalis. According to the genetic identity analysis, two hybirds groups showed the maternal effect. The alleles of two hybirds were from their parents based on genetic analysis. Particularly, microsatellite primers TTF3, TTF4, TTF10, and Mam25 identified 5 groups. Our results provide important value in breeding, germplasm resources preservation, and germplasm identification of Megalobrama terminalis×Erythroculter ilishaeformis andMegalobrama amblycephala×Erythroculter ilishaeformis.
-
游泳运动是鱼类逃逸、捕食、繁殖等活动行为的重要实现方式, 为其生存生长及种群繁衍提供了基本保证。依据对氧气的需求, 鱼类游泳运动分为有氧运动和无氧运动2种类型, 前者反映有氧代谢能力, 与日常活动(如巡游、自发运动)和洄游等有关, 常以临界游泳速度(Ucrit)[1, 2]或步法转换速度(Ugt)评价[2], 而后者则反映无氧代谢能力, 与捕食活动、逃逸敌害、穿越激流等相关, 常用匀加速游泳速度(Ucat)或爆发游泳速度评估[3]; 鱼类的有氧和无氧运动能力可能存在权衡[3—5]。自Ucat用于衡量鱼类无氧运动能力起, 不同研究采用加速度均是0.167 cm/s2 [即10 (cm/s)/min][3—8]。采用单一加速度考察不同鱼类Ucat的方式可能具有局限性, 因为不同鱼类的生物学特征(如发育阶段、体重大小、游泳能力及性别等)差异较大, 将影响游泳能力的测定结果。因此, 不同加速度与鱼类Ucat关系的相关研究十分迫切。
鱼类表型存在种内个体变异并且在不同环境条件下维持稳定, 具有重要进化生物学和生态学意义[9]。鱼类处于静止状态、无食物消化吸收时的最低能量消耗称作为静止代谢率(Resting metabolic rate, RMR), 代表了机体基本功能的维持水平和有氧代谢能力的下限, RMR与标准代谢率(Standard metabolic rate, SMR)有相近的内涵, 本研究统一使用RMR; 高强度有氧运动对鱼类施加巨大的生理负荷, 使其对氧的需求达到最大, 表现出最大代谢率(Maximum metabolic rate, MMR), 代表了机体有氧代谢能力的上限, 二者的差值为鱼类的有氧代谢空间(Aerobic scope, AS=MMR–RMR), 它表示为其他生理功能提供的最大代谢潜能[10]。鱼类MMR和AS的测量方法通常包括两种, 一种是Ucrit法[11—14], 别一种则是人为诱导运动力竭的过量耗氧(Excess post-exercise oxygen consumption, EPOC)法[11, 15, 16]。2种方法的本质都是通过高强度游泳运动对机体施加最大生理负荷, 诱导机体产生最强有氧代谢水平。然而, 由于实验方法的操作性及其相应的生态学意义不尽相同, 比较不同研究结果时可能面临一定的方法学局限性, 有关鱼类有氧代谢能力特征诱导方法的比较研究十分匮乏[11]。
鲫(Carassius auratus Linnaeus)是我国常见的鲤科鱼类, 广泛分布于江河湖泊、池塘沼泽等水域中。为考察鲤科鱼类运动能力的个体变异和表型特征的生态关联, 以及不同加速度对匀加速能力测定的影响, 本研究以鲫幼鱼为实验对象, 通过2种方法分别测定该种鱼的有氧代谢参数(RMR、MMR、AS及FAS)和有氧运动能力(Ucrit), 同时也测量在不同加速度(0.083、0.167、0.250、0.333 cm/s2)条件下鲫幼鱼的Ucat, 在Ucrit和Ucat测定过程中分别录像以分析获取相应的Ugt, 分析比较鲫幼鱼的有氧和无氧运动能力特征及表型关联, 比较匀加速游泳能力在不同加速度条件下的响应特征, 为鱼类匀加速游泳能力测定加速度的合理选择提供有益参考, 同时也为我国过渔设施(如鱼道)工程的设计开发提供重要的运动生理学资料。
1. 材料与方法
1.1 实验鱼及其驯化
鲫幼鱼购自于重庆市北碚区歇马人工养殖基地, 运回后将鱼放置于3个实验室循环控温水槽(约250 L)中驯化3周。驯化期间, 每天以商业饲料(中国通威公司)饱足投喂1次, 投喂0.5h后用虹吸法清除残饵和粪便以维持水体环境。驯化水槽的日换水量约为水体的10%, 实验用水为曝气后控温的自来水, 用充气泵不断向驯化水槽充气使溶氧水平大于7 mg/L, 驯化水温为(25.0±0.5)℃(与当时季节水温相近), 光周期为光照14 L﹕10 D。
1.2 实验设计
在驯化结束后, 挑选鱼体健康、体重相近的鲫幼鱼[n=30, 体重(13.08±0.41) g, 体长(7.52±0.08) cm]作为实验对象, 并将实验鱼移入已编号的30个养殖单元格中以便辨别实验鱼。实验之前, 对鱼禁食24h。在第1天先测量实验鱼的RMR, 随后采用游泳代谢仪测定鱼的Ucrit、Ugt和MMR并计算获取AS, 测定完毕后将鱼放回至养殖单元格中并投喂一次约0.5%体重的饵料[17], 以维持实验鱼的体重和生理恢复; 第3天测定EPOC法诱导鲫幼鱼的MMR并在运动力竭后连续测定鱼的恢复代谢率, 共计算10min的过量耗氧(EPOC), 在测定完毕后将鱼放回至养殖单元格中并投喂一次约0.5%体重的饵料; 从第5天开始随后的连续4d中, 于每天上午只测定一个加速度条件下实验鱼的Ucat和Ugt, 本研究设定的加速度包括0.083、0.167、0.250、0.333 cm/s2, 每天测定完毕后对单尾鱼投喂一次约0.5%体重的饵料。对于单尾鱼而言, 在Ucrit和EPOC测定时均有48h机体恢复时间, 在不同加速度条件下测量Ucat的恢复时间也达24h, 并在每次饵料投喂过程中所有实验鱼全部表现快速摄食, 但由于体重控制要求仅对每尾鱼投喂约0.5%体重的饵料。根据研究报道, 在运动力竭1h后鱼类白肌的三磷酸腺苷和磷酸肌酸恢复到运动前水平[17], 力竭运动后8h后机体的乳酸水平也恢复运动前水平[18]。本研究实验参数测定时间的间隔明显长于上述重要能量物质恢复和产物清除时间, 不影响鲫幼鱼游泳能力的测定。实验期间所有环境条件(如温度、溶氧、光周期等)与驯化期间保持一致。
1.3 RMR的测定
本研究采用流水式呼吸代谢仪测定实验鱼的RMR。将鱼从养殖单元格转移至呼吸代谢仪的呼吸室驯化24h, 以消除转移过程带来的影响。驯化结束后, 采用溶氧仪(HQ30d, 美国哈希公司)在第2 天的9:00、11:00、13:00、15:00、17:00、19:00和21:00测定实验鱼的耗氧率。呼吸代谢仪的环境条件(如水温、溶氧和光周期等)与驯化期间保持一致; 测定过程中实验室保持安静, 以减少声音对实验鱼生理状态造成影响。将7个时间点的耗氧率取平均值用来表征实验鱼的RMR [mg O2/(kg·h)], 计算公式如下:
${\rm{RMR}} = \Delta {{\rm{O}}_2} \times v/m$


式中, ΔO2是实验呼吸室(有鱼)出水口与空白呼吸室(无鱼)出水口的溶氧差值(mg O2/L), v是呼吸室流速(L/h), 由呼吸室出水口装满50 mL容量瓶所需时间计算获得, m为实验鱼的体重(kg)。由于实验鱼的体重十分相近, 无需进行代谢率的体重校正。
1.4 Ucrit和MMR的测定
(1) Ucrit测定法: 采用鱼类游泳代谢仪同时测定实验鱼的运动代谢率和Ucrit, 同时通过摄像系统拍摄实验鱼的游泳行为。先将实验鱼装入游泳代谢仪的游泳管中驯化1h, 驯化流速为6 cm/s; 随后每隔20min增加6 cm/s, 直至实验鱼运动力竭。力竭标准: 实验鱼因运动力竭不能抵抗水流而后退停靠于游泳管的尾端筛板, 并且在尾端筛板的停靠时间达20s以上[19]。Ucrit(cm/s)的计算公式如下:
${U_{{\rm{crit}}}} = V + \left( {t/\Delta T} \right) \times \Delta V$


式中, V是实验鱼能够完成20min游泳运动的最大流速, ΔV是流速增量(6 cm/s), ΔT是时间间隔(20min), t是在最高流水速度下实验鱼的游泳历时(持续时间短于20min)。
在测定Ucrit过程中, 同时测量实验鱼的运动代谢率。游泳代谢仪装有1个连接溶氧仪外部水循环系统(流量约为500 mL/min), 当溶氧仪探头连接该系统时游泳代谢仪形成封闭状态, 可监测游泳代谢仪内部水体溶氧水平。每隔20min, 打开游泳仪谢仪尾盖20s随后关闭, 该时间足以保证代谢仪内部与外部之间水体的充分置换, 溶氧水平可迅速恢复至正常状态。通过设定好的电脑程序控制目标流速, 用溶氧仪每隔2min测定一次游泳代谢仪内部水体的溶氧水平(mg/L), 连续测定10次。实验鱼的运动代谢率[MO2, mg O2/(kg·h)]的计算公式如下:
$M{{\rm{O}}_2} = \left( {{S_{\rm{t}}} - {S_{\rm{b}}}} \right) \times 60 \times V/m$


This page contains the following errors:
error on line 1 at column 1: Start tag expected, '<' not foundBelow is a rendering of the page up to the first error.
在Ucrit测定过程中, 在游泳管正上方安置一台高清摄像机, 录像单尾鱼Ucrit游泳行为。随流速的逐渐增加, 由于鱼类开始动用白肌(无氧代谢)提供游泳动力而打破体内乳酸平衡, 使得体内的乳酸积累一定程度时, 鱼类开始出现“爆发–滑行”的游泳行为变化并且摆尾频率变化明显, 该游泳行为被称为步法转换, 首次出现“爆发–滑行”游泳行为时的游泳速度称作为步法转换速度(Ugt), 评价最大有氧运动能力[2, 20]。虽然Ucrit测定过程中涉及到无氧代谢且饱受争议, 但现有研究仍采用Ucrit或Ugt评价鱼类的有氧运动能力[2]。
(2) EPOC测定法: 通过力竭运动诱导实验鱼的MMREPOC [mg O2/(kg·h)]并计算代谢空间(ASEPOC=MMREPOC–RMR)。EPOC的简要步骤[15]: 将鱼从养殖单元格中转移至力竭运动驱赶装置(Φ外=56 cm, Φ内=33 cm, 水深15 cm)的环行水道(流速~60 cm/s)中; 在环形水道中实验鱼逆流快速游泳, 一段时间后鱼体因高流速无法保持相对稳定游泳而后退, 此时人工连续驱赶实验鱼向前游泳直至其运动力竭; 处于力竭状态的鱼通常失去平衡且用手接触尾部时不再有明显应激反应, 整个过程一般在5min之内完成[21]; 然后将鱼迅速(10s之内完成)转移至呼吸代谢仪的呼吸室中进行30min的恢复代谢测定。溶氧数据采集时间分别为0、1、2、3、4、5、6、7、8、9、10、15、20、25、30min。在恢复代谢测定过程中, 呼吸室流速约为500 mL/min。经计算, 在此流速条件下呼吸室水体置换率达99%的历时小于1min[22]。因此, 将随后数分钟出现的最大耗氧率作为实验鱼的MMR, 其计算公式与RMR一样。鱼类的EPOC是指其在运动恢复期内超过静止状态耗氧水平的额外耗氧量, 在一定程度上反映了鱼类的最大无氧代谢能力, 计算恢复期内高于运动前的差值在时间上的总和即为该时期的EPOC[15]。为便于比较不同鲫个体的代谢恢复特征, 本研究仅选取前10min的EPOC用于数据分析。
1.5 Ucat的测定
本研究共采用了4个加速度(0.083、0.167、0.250、0.333 cm/s2), 每天只测定1个加速度下实验鱼的Ucat。将鱼放入游泳代谢仪的游泳管中驯化1h, 管内流速为6.0 cm/s。驯化结束后, 流速从6.0 cm/s开始按照某一加速度(每秒种递增)逐渐增加游泳代谢仪的流速, 直至实验鱼运动力竭, 该力竭状态被认为是鱼类的最大匀加速游泳能力, 此时对应的流速即为实验鱼的Ucat。游泳代谢仪的流速控制由电脑软件完成, 可即时观察游泳管中即时流速及其变化特征。在测定过程中, 在游泳管正上方安装一台高清摄像机, 录像单尾鱼整个的匀加速游泳过程。对获取的视频资料分析确定实验鱼首次“爆发–滑行”游泳行为的出现时间并结合摆尾频率的变化特征, 以确定在Ucat测定过程中实验鱼的Ugt。
1.6 数据处理与统计分析
采用Excel (2003)软件对所有实验数据作常规计算, 统计软件为SPSS (19.0)软件。实验数据均以“平均值±标准误”(Means±SE)表示, 显著水平为P<0.05。Ucrit测定中的能量代谢参数与游泳能力的关系及Ucat与无氧代谢(Ucat–Ugt)的关系均采用一般线性回归方程。两种方法诱导MMR和AS的比较采用T-检验, 能量代谢参数之间的相关性采用Pearson相关分析。采用单因素方差分析考察不同加速度对游泳能力参数的影响, 若组间存在显著差异则采用最小显著性差异法(Least significant difference, LSD)检验组间数据差异。采用组内相关系数(Intraclass correlation coefficient, ICC)和肯德尔和谐系数(Kendall concordance coefficient, KCC)考察匀加速游泳能力参数在不同加速度条件下的重复性。
2. 结果
2.1 Ucrit中能量代谢与游泳速度的关系
在Ucrit法中鲫幼鱼的MMR和AS均与Ucrit呈正相关, 但RMR与Ucrit不相关(图 1A)。此外, 鲫幼鱼的能量代谢参数(MMR、AS、RMR)与Ugt不相关(图 1B, 所有P>0.05)。
![]() 图 1 鲫幼鱼能量代谢与游泳速度的关系MMR=最大代谢率; AS=代谢空间; RMR=静止代谢率; 游泳速度与代谢率的回归方程如下: MMR=10.678×Ucrit+219.677, R2=0.445, P<0.001; AS=10.898×Ucrit+3.823, R2=0.443, P<0.001Figure 1. The relationships between metabolic rates and swimming velocity in juvenile crucian carpMMR=maximum metabolic rate; AS=aerobic scope; RMR=resting metabolic rate. Regressions equations between swimming velocities and metabolic rates as follows: MMR=10.678×Ucrit+219.677, R2=0.445, P<0.001; AS=10.898×Ucrit+3.823, R2=0.443, P<0.001
图 1 鲫幼鱼能量代谢与游泳速度的关系MMR=最大代谢率; AS=代谢空间; RMR=静止代谢率; 游泳速度与代谢率的回归方程如下: MMR=10.678×Ucrit+219.677, R2=0.445, P<0.001; AS=10.898×Ucrit+3.823, R2=0.443, P<0.001Figure 1. The relationships between metabolic rates and swimming velocity in juvenile crucian carpMMR=maximum metabolic rate; AS=aerobic scope; RMR=resting metabolic rate. Regressions equations between swimming velocities and metabolic rates as follows: MMR=10.678×Ucrit+219.677, R2=0.445, P<0.001; AS=10.898×Ucrit+3.823, R2=0.443, P<0.0012.2 两种方法中鲫幼鱼能量代谢参数的比较及相关性
本研究采用了2种常规诱导鱼类最大代谢率的方法, 分别为Ucrit法和EPOC法。结果发现, 两种方法获取鲫幼鱼的MMR和AS均无显著性差异(图 2A, MMR: T=0.200, P=0.843; AS: T=0.220, P=0.827); 同样, 2种方法获得的FAS (Ucrit法: 4.84±0.38; EPOC法: 4.98±0.36)也无明显差异(T=0.593, P=0.558)。虽然2种方法获得能量代谢参数的平均值无差异, 但2种方法的能量代谢参数(MMR、AS和FAS)仍保持较高的重复性(图 2B, MMR: r=0.434, P=0.017; 图 2C, AS: r=0.493, P=0.006; 图 2D, FAS: r=0.808, P<0.001)。
![]() 图 2 两种运动方式诱导鲫幼鱼有氧代谢能力的比较及相关性MMR=最大代谢率; AS=代谢空间; Ucrit=临界游泳速度; EPOC=运动后过量耗氧; FAS=相对代谢空间Figure 2. The comparison and relationship in aerobic capacities induced by two methods in juvenile crucian carpMMR=Maximum metabolic rate; AS =Aerobic scope; Ucrit=Critical swimming speed; EPOC=Excess post-exercise oxygen consumption; FAS=Factorial aerobic scope
图 2 两种运动方式诱导鲫幼鱼有氧代谢能力的比较及相关性MMR=最大代谢率; AS=代谢空间; Ucrit=临界游泳速度; EPOC=运动后过量耗氧; FAS=相对代谢空间Figure 2. The comparison and relationship in aerobic capacities induced by two methods in juvenile crucian carpMMR=Maximum metabolic rate; AS =Aerobic scope; Ucrit=Critical swimming speed; EPOC=Excess post-exercise oxygen consumption; FAS=Factorial aerobic scope在Ucrit法中, 鲫幼鱼的RMR与MMR及AS均不相关, 但与FAS呈负相关; MMR与AS及FAS呈正相关, AS与FAS也呈正相关(表 1)。在EPOC法中, 鲫幼鱼的RMR与MMR不相关, 但与AS、FAS、EPOC均呈负相关, MMR与AS、FAS、EPOC均呈正相关(表 1)。AS、FAS、EPOC三者之间呈正相关(表 1)。
表 1 两种方法中鲫幼鱼能量代谢参数之间的相关性Table 1. Correlations among parameters of metabolic rate induced by two exercised methods in juvenile crucian carp测定方法Method 实验参数Parameter 相关性Correlation Ucrit测定法 最大代谢率MMR 代谢空间AS 相对代谢空间FAS 静止代谢率RMR r=0.043 P=0.820 r= –0.197 P=0.298 r= –0.630** P<0.001 最大代谢率MMR r=0.971** P<0.001 r=0.711** P<0.001 代谢空间AS r=0.850** P<0.001 EPOC测定法 最大代谢率MMR 代谢空间AS 相对代谢空间FAS 过量耗氧EPOC 静止代谢率RMR r= –0.326 P=0.079 r= –0.581** P=0.001 r= –0.800** P<0.001 r= –0.470** P=0.009 最大代谢率MMR r=0.959** P<0.001 r=0.775** P<0.001 r=0.544** P=0.002 代谢空间AS r=0.908** P<0.001 r=0.610** P<0.001 相对代谢空间FAS r=0. 519** P=0.003 注: RMR=静止代谢率; MMR=最大代谢率; AS=代谢空间; Ucrit=临界游泳速度; EPOC=运动后过量耗氧; FAS=相对代谢空间。*表示P<0.05, **表示P<0.01 Note: RMR=Resting metabolic rate; MMR=Maximum metabolic rate; AS =Aerobic scope; Ucrit=Critical swimming speed; EPOC=Excess post-exercise oxygen consumption; FAS=Factorial aerobic scope. * means P<0.05 and ** meansP<0.01 2.3 鲫幼鱼的有氧和无氧运动能力
鲫幼鱼的Ucrit低于不同加速度条件下的Ucat, 但加速度对Ucat测定无显著影响(图 3A, F=9.333, P<0.001)。然而, 随加速度的增加,Ugt呈现先增加后下降的变化规律(图 3B, F=87.386, P<0.001)。与Ugt类似, 运动能力比例(Ugt/Ucrit或Ugt/Ucat)也呈现先递增后降低的变化趋势(图 3C, F=58.797, P<0.001)。
不论是Ucrit法还是Ucat法, 鲫幼鱼在两方法中的Ugt均与Ucrit或Ucat呈现正相关, 并且在不同加速度条件下Ugt与Ucat呈现的正相关方向保持不变(表 2)。此外, 鲫幼鱼的匀加速游泳能力参数[Ucat, Ugt, Ugt/Ucat, Ucat–Ugt, (Ucat–Ugt)/Ucat]在不同加速度条件下均保持较高的重复性(表 3)。
表 2 鲫幼鱼最大游泳能力与步法转换速度的回归方程Table 2. Regressions (±SE) of gait transition speed (x) as a function of swimming velocity (y, Ucrit or Ucat), y=a x+b测定方法Method 加速度
Accelerate rate (cm/s2)a b R2 P Ucrit法 / 0.198±0.080 16.380±5.250 0.177 0.021* Ucat法 0.083 0.367±0.062 11.244±5.120 0.552 <0.001** 0.167 0.514±0.141 22.784±11.637 0.335 0.001** 0.250 0.489±0.181 22.925±15.336 0.212 0.011* 0.333 0.773±0.120 –3.907±9.835 0.608 <0.001** 注: Ucrit=临界游泳速度, Ucat=匀加速游泳速度. *表示P<0.05, **表示P<0.01 Note: Ucrit=critical swimming speed, Ucat=Accelerated swimming speed. * denotes P<0.05, ** denotesP<0.01 表 3 鲫幼鱼匀加速游泳能力参数的重复性Table 3. Repeatability of parameters of acceleration swimming performance in juvenile crucian carp实验参数Parameters 组内相关系数Intraclass correlation coefficient (ICC) 肯德尔和谐系数Kendall concordance coefficient (KCC) Ucat ICC=0.790 P<0.001 KCC=0.028 P = 0.472 Ugt ICC=0.573 P=0.002 KCC=0.476 P <0.001 Ugt/Ucat ICC=0.627 P<0.001 KCC=0.577 P <0.001 Ucat–Ugt ICC=0.626 P<0.001 KCC=0.546 P <0.001 ( Ucat–
Ugt)/UcatICC=0.629 P<0.001 KCC=0.591 P <0.001 从加速度0.083 cm/s2逐渐增加至0.250 cm/s2, 鲫幼鱼Ucat的无氧代谢能力(Ucat–Ugt)与Ucat之间均呈现正相关(图 4A-C, 所有P<0.01), 而在加速度0.333 cm/s2下二者不相关(图 4D, r=0.342, P=0.069)。在匀加速能力测定中, 鲫幼鱼的有氧代谢能力(Ugt)与无氧代谢能力(Ucat–Ugt)呈负相关, 即二者存在权衡(图 5, r= –0.607, P<0.001)。
3. 讨论
3.1 鲫幼鱼有氧运动能力与能量代谢的关系
随着游泳速度逐渐增加至Ucrit时, 鱼类呼吸循环系统的生理功能处于最大负荷状态, 表现出最大有氧代谢水平, 常用来评价鱼类的有氧运动能力[23]。本研究发现, 鲫幼鱼的运动代谢率随游泳速度的增加而呈指数性上升, 并且其MMR和AS与Ucrit均呈现正相关, 即有氧代谢能力越强的个体可以支撑更强水平的有氧运动, 反之亦然。这种现象不仅存在于鲤科鱼类的种间水平[13], 而且也发现于鲤科鱼类的种内水平[7, 24]。本研究还发现鲫幼鱼的RMR与Ucrit不相关, 这与鲤(Cyprinus carpio Linnaeus)[7]和青鱼(Mylopharyngodon piceusRichardson)[24]的正相关报道并不一致。在Ucrit测定过程中, 鲫幼鱼的Ucrit与Ugt呈正相关, 但Ugt与该种鱼的MMR、AS及RMR均不相关, 这可能是因为鲫幼鱼首次出现“爆发–滑行”游泳行为时(Ugt)的有氧代谢水平低于Ucrit时的MMR, 并且这两个代谢水平间的差距因个体而异, 具有明显个体变异; 另一方面由于游泳速度与有氧代谢之间的拟合方程指数不尽相同, 即相同游泳速度的增加, 指数越大的鲫个体其有氧代谢上升更为明显[11, 19]。
本研究采用了Ucrit法和EPOC法诱导鲫幼鱼的MMR和AS, 发现Ucrit法中MMR和AS的平均值与EPOC法的十分相近且无明显差异。然而, 这只是在组间水平的平均值差异检验, 还可以在组内个体水平上对两种方法进行比较。为此, 本研究将Ucrit法的能量代谢参数(MMR、AS和FAS)分别与EPOC法的进行重复性分析。结果发现, 3个能量代谢参数在两种方法之间保持较高的重复性, 即个体的生理表型保持较强的可重复测量水平并且在种群中的表型排序维持稳定, 表明在排除环境因素(如水温、体重和溶氧)后, 不论Ucrit法和EPOC法诱导鱼类的最大有氧代谢能力均可采用并进行比较。值得注意的是, 不论Ucrit法还是EPOC法均是排除实验鱼消化道中食物消化吸收的影响, 但先前研究发现鱼类最大代谢率的诱导与其代谢模式有关, 食物的消化吸收和游泳运动同时进行的方式可诱导某些鱼类(如鲤)的最大代谢率[23], 这种由2种生理活动叠加诱导的最大代谢率明显大于单一生理活动(运动或消化)的诱导值。因此, 在方法采用时还需要考虑实验鱼的代谢模式类型。
3.2 鲫幼鱼RMR与MMR或AS的关系
RMR是鱼类机体的最小维持代谢水平, 而MMR或AS代表了机体的最大有氧代谢能力, 二者的关系引起研究者的广泛关注[25]。如果自然选择倾向于动物既具有较低的能量维持消耗又具有较强的最大代谢能力的表型特征组合, 那么拥有这种最佳表型组合的动物在自然界中具有极高的适合度[25], 然而这种最佳表型关联的进化结果可能是不存在的[26, 27]。根据内温动物有氧代谢能力的进化理论, 自然选择在倾向于选择个体拥有较强的最大有氧代谢能力同时也会倾向于选择较高的维持代谢, 因为具备较强功能的器官(如发达的呼吸循环系统和运动系统)的机体相应具有更多收益(即具有更高的最大代谢率), 但这些器官也具有相应的代价(即相应较高的能量消耗)[28]。因此, 维持代谢消耗与最大代谢率在理论上将呈正相关。支持该假说的鱼类实验证据已见报道, 例如鲤[7]、青鱼[24]和鳟(Salmo trutta Linnaeus)[25]的RMR与MMR呈现正相关。
对于鱼类种内RMR与MMR呈正相关而言, 在排除体重差异和发育因素外迄今还未找到与之有关器官形态学的证据, 但在生化水平上发现证据: 如鳟肝脏上两种有氧代谢关键酶的活性与RMR及MMR均呈正相关[25]。然而, 也有研究发现南方鲇(Silurus meridionalis Chen)的RMR与MMR及AS不相关[14]; 欧鲈(Dicentrarchus labrax Linnaeus)[5]、鲫[15]和鳊(Parabramis pekinensisBasilewsky)[16]的RMR与MMR不相关, 与AS呈负相关; 大西洋鲑(Salmo salar Linnaeus)的RMR与FAS呈现负相关[29], 暗示该种鱼的RMR与MMR也不相关; 上述研究表明不同鱼类的研究结果差异甚大, 但可总结为两种类型: 一是正相关, 二是不相关。本研究发现, 两种运动法中鲫幼鱼RMR与MMR均不相关, EPOC法中RMR与AS呈负相关, 符合第二种相关类型。在自然界中, 假定自然选择会使鱼类同时具有较强的有氧代谢能力和较高的代谢维持, 并且较强的有氧代谢能力有助于个体的生存、生长和繁衍[30], 理论上拥有该表型个体会获得较高的适合度。因此, 在长进化时间尺度上, 自然选择结果是该鱼类种群的有氧代谢能力表型峰值更高且表型维度变异较窄。然而, 这种理论推测并未得到野外和实验室观测数据的支持, 因为野外和实验室表型特征的个体变异仍然较大[3—5]。另一方面, 在实验室条件下可以获取鱼类的最大有氧代谢能力, 但无法确定鱼类在野外条件下最大有氧代谢能力的使用频率[31], 该功能表型受到自然选择的强度及其与生活史的关联的研究也十分困难, 这也可能是导致维持代谢与最大代谢不相关的原因之一。
3.3 鲫幼鱼的匀加速能力及加速度影响
鱼类匀加速游泳能力的评价研究最早见于2000年报道, 该研究采用的加速度为0.167 cm/s2 [10 (cm/s)/min][3], 但该研究并未对加速度的采用原因进行解释, 即加速度的影响被忽视。本研究发现在4个加速度(0.083、0.167、0.250、0.333 cm/s2)下鲫幼鱼的匀加速能力Ucat不受加速度的影响。同样, 虹鳟(Oncorhynchus mykissWalbaum)[32]和鳊幼鱼的Ucat在较大加速度范围内也保持不变[33, 34], 与本研究结果类似。前期研究发现在较小加度速下的Ucat介于Ucrit与较大加速度下Ucat之间[33, 34], 即加速度越小, Ucat值越接近于Ucrit, 本研究鲫幼鱼Ugt也具有相似变化规律, 该现象可能是因为在较小加速度条件下实验鱼在大部分时间进行有氧运动, Ucrit很大程度上反映了鱼类有氧代谢能力并且可被认为是最小匀加速的特例, 鱼类的低匀加速游泳是一种非常接近有氧运动的游泳类型, 因而低加速度下Ucat值接近Ucrit值[33]。然而, 从另一方面考虑, 如果以过大加速度考察鱼类的匀加速游泳能力, 加速度越快, 实验鱼的运动力竭时间相应越短[33], 那么过高的加速度将影响鱼类匀加速游泳能力的准确评估, 因为过快频率的流速变化可能导致实验鱼提前停止游泳而造成假的运动力竭现象。值得注意的是, Farrell研究的加速度递增时间为每分钟[32], 本研究中及实验室前期研究[33, 34]的加速度递增时间为每秒钟。以每秒钟递增的加速度的设定方式对鱼类匀游泳运动的引导作用更为积极连贯, 可更好反映鱼类的匀加速游泳能力, 同时降低了因流速的突然陡增对鱼产生的生理胁迫影响。
研究认为, 鱼类Ucat包括有氧代谢组分(Ugt)和无氧代谢组分(Ucat–Ugt), 并且2个组分间可能存在权衡, 因为前者是由红肌有氧代谢供能而后者是白肌无氧代谢供能[4, 5]。本研究发现鲫幼鱼的Ugt与Ucat–Ugt呈现负相关, 并且Ucat与Ucat–Ugt呈正关, 表明该种鱼在匀加速游泳能力过程中有氧代谢和无氧代谢之间存在权衡。大西洋鳕(Gadus morhua Linnaeus)的研究数据支持上述权衡观点[3], 但欧鲈的实验结果并不支持[4, 5]。上述权衡观点在人类运动员研究中找到了肌肉形态结构的支持证据, 即短跑运动员的腿部快肌(无氧代谢)拥有比例高于慢肌(有氧代谢), 而马拉松运动员的腿部慢肌(有氧代谢)拥有比例高于快肌(无氧代谢)[35]。同样, 大部分鱼类的肌肉组成也包括常见的红肌和白肌两种类型, 二者的解剖学结构差异明显, 是上述功能权衡的形态学基础[36]。随着游泳速度的逐渐增加, 鱼类的游泳行为特征发生相应变化, 例如: 在较高游泳速度下稳定游泳的控制程度下降, 摆尾幅度和频率增加[20]及“爆发–滑行”行为的发生频率上升[10]; 在生化角度上, 无氧代谢大量参与的证据在于鱼类体内重要器官(如肌肉、肝脏和血液)的乳酸水平明显上升, 但是在静止状态下也保持一定的乳酸水平[18, 33, 34], 代谢底物和产物含量的个体差异可能有助于解释上述权衡现象。然而, 验证上述权衡的不同研究结果出现分歧, 仍有必要结合形态学与生化水平进一步探索权衡现象背后的内在机制。
综上所述, 本研究采用2种运动方法诱导鲫幼鱼有氧代谢能力的观测值不论在组间水平还是个体水平均无方法学的差异, 并且能量代谢参数之间存在表型关联; 加速度对鲫幼鱼的Ucat测定无影响, 建议选择较高的加速度, 加速度对Ugt测定有影响, 在不同加速度条件下鲫幼鱼的匀加速游泳能力保持较高的重复性, 并且有氧代谢与无氧代谢存在权衡。
-
图 1 TTF3在5个群体中的PAGE图谱
M. PBR322 DNA/MspΙ; 1-4. 团头鲂; 5-8. 三角鲂; 9-12. 翘嘴鲌; 13-16. 团头鲂♀×翘嘴鲌♂; 17-20. 三角鲂♀×翘嘴鲌♂; 下同
Figure 1. PAGE analysis by primers TTF3 in 5groups
M. PBR322 DNA/MspΙ; 1-4. Megalobrama amblycephala; 5—8. Megalobrama terminalis; 9—12. Erythroculter ilishaeformis; 13—16. Megalobrama amblycephala♀×Erythroculter ilishaeformis♂; 17—20. Megalobrama terminalis ♀×Erythroculter ilishaeformis♂; the same applies below
表 1 微卫星引物特征
Table 1 Characteristics of microsatellite primers
位点
Locus重复序列
Repeat motif引物序列
Primer sequence (5′-3′)退火温度
Tm (℃)等位基因大小范围
Size range (bp)TTF01 (CA)21 TGGAGATGAAAGCTGAAGGAA
ATGCACGAACTGCCACATAA55.9 252—328 TTF02 (CA)5(CT)21 AAACAGCTGCTACCCTTGGA
TTTGCCAGAAGAGCAAATCA55.9 196—228 TTF03 (TC)27 AAGACGCCACGGAAACTTTA
CTGACCGGATAGCAAAGTGA56.4 214—266 TTF04 (CA)14 GACTGGAGTCGTCAGGCTTC
TGCCCCACATTGTTAGACTG60.5 182—222 TTF05 (CA)15 CTAGTGGGTAGGTGGCAGGT
TGACTGGGAGAGACAGAGGAG60.5 164—188 TTF06 (GA)13 GGCAGGTCAGGCACATTTAT
TCTCTACCTCACATTCTCTCATTCT60.5 186—218 TTF07 (GT)13 ATGGGTAAGCCGATGGATTC
GTGTCAGCATTCCAGCTCCT60.5 285—331 TTF08 (GT)18 GGGGAAATAAAGGGAGAAAGTG
TTTCTCCTGATCCGTTGACC60.5 178—224 TTF09 (TC)19 AAGACGCCACGGAAACTTTA
GAGGTGGGACTGTGTGGAAT56.9 269—319 TTF10 (TC)6(TG)5 FAAACAGGCTCGCCAATTTC
TCACCCACACACTCTTATTCTCTC55.9 255—291 EST13 (AC)14 TCTTTCACAAACAAACCCTT
GGATTATCAAACGCGGACT57 209—266 EST23 (AC)12 GCGATCATCAAGGCAACG
AGATTCATCAGCTCCTGTAGTGT55 265—352 EST37 (TG)8 CACAAACCATAAACACAG
AATGCCCATAAAACACAC62 147—216 EST66 (GT)20 TCAATCAGGCATAAACAT
AACTAACTAGCACGCAAA60 290—349 Mam03 (CA)18 TTGCAGGTACTGTGGGAAAA
AGCAACATGCAAACATCAAA60 231—324 Mam25 (AC)5(AC)14 TCACACCAACAACACCGAAT
CCTTGTTTTCTCCAGGCATC62 166—252 注: TTF1—TTF10、Mam03—Mam25和EST13—66分别来源于文献[11]、[12]、[13]Note: TTF1—TTF10, Mam03—Mam25 and EST13—EST66 are microsatellite primers and are respectively from reference [11], [12] and [13] 表 2 五个群体的微卫星位点的等位基因数、多态信息含量
Table 2 Number of alleles (Na) and the polymorphism information content (PIC) of microsatellite loci
位点
Locus等位基因 Na 多态信息含量 PIC A B C D E A B C D E TTF01 4.00 3.00 3.00 5.00 5.00 0.5717 0.5269 0.5269 0.7056 0.7101 TTF02 3.00 4.00 4.00 4.00 5.00 0.4822 0.6075 0.5973 0.6594 0.5714 TTF03 4.00 5.00 3.00 3.00 4.00 0.6387 0.5544 0.5424 0.5713 0.5786 TTF04 4.00 5.00 5.00 5.00 5.00 0.4848 0.7185 0.7220 0.7154 0.6357 TTF05 3.00 4.00 4.00 5.00 4.00 0.4918 0.5637 0.5739 0.6345 0.6799 TTF06 3.00 4.00 3.00 4.00 4.00 0.5599 0.4213 0.4414 0.4848 0.6528 TTF07 3.00 5.00 4.00 4.00 5.00 0.4781 0.6216 0.5039 0.5048 0.5954 TTF08 3.00 1.00 1.00 4.00 5.00 0.4414 0.3750 0.4211 0.4021 0.6765 TTF09 4.00 3.00 3.00 4.00 4.00 0.6038 0.4918 0.4600 0.5882 0.6569 TTF10 3.00 3.00 5.00 4.00 5.00 0.4918 0.4778 0.6254 0.5958 0.6816 EST13 4.00 4.00 4.00 4.00 4.00 0.5747 0.6819 0.6707 0.5945 0.5809 EST23 3.00 5.00 4.00 4.00 3.00 0.5150 0.7185 0.5418 0.5424 0.6207 EST37 5.00 3.00 3.00 4.00 4.00 0.5580 0.5478 0.4414 0.5973 0.5718 EST66 5.00 3.00 3.00 5.00 5.00 0.7427 0.3976 0.4202 0.6454 0.6989 Mam03 3.00 3.00 3.00 3.00 4.00 0.4211 0.4415 0.4414 0.5052 0.4211 Mam25 3.00 3.00 4.00 2.00 3.00 0.5111 0.4414 0.4842 0.5098 0.3750 平均 3.56 3.63 3.44 4.00 4.31 0.5354 0.5367 0.5258 0.5785 0.6067 表 3 五个群体的微卫星位点的观测杂合度、期望杂合度
Table 3 Observed heterozygosity (Ho) and expected heterozygosity (He) of microsatellite loci
位点
Locus观测杂合度Ho 期望杂合度He A B C D E A B C D E TTF01 0.2384 0.3503 0.2328 0.3847 0.3847 0.6153 0.6497 0.6153 0.7616 0.7672 TTF02 0.2740 0.4164 0.3463 0.3294 0.3153 0.6706 0.5836 0.6847 0.7260 0.6537 TTF03 0.3463 0.2989 0.3362 0.3734 0.3638 0.6266 0.7011 0.6362 0.6537 0.6638 TTF04 0.2294 0.4141 0.2972 0.2249 0.2266 0.7751 0.5859 0.7734 0.7706 0.7028 TTF05 0.2972 0.4102 0.2655 0.3486 0.3734 0.6514 0.5898 0.6266 0.7028 0.7345 TTF06 0.4141 0.3576 0.2842 0.4458 0.4610 0.5542 0.6424 0.5390 0.5859 0.7158 TTF07 0.4435 0.4186 0.3294 0.4000 0.3090 0.6000 0.5814 0.6910 0.5565 0.6706 TTF08 0.5175 0.4458 0.2616 0.4599 1.0000 0.5401 0.5542 0.0000 0.4825 0.7384 TTF09 0.3441 0.3181 0.2780 0.4328 0.4102 0.5672 0.6819 0.5898 0.6559 0.7220 TTF10 0.3429 0.4102 0.2565 0.4328 0.4328 0.6944 0.5898 0.5672 0.6571 0.7435 EST13 0.3435 0.3469 0.3407 0.2661 0.2559 0.7339 0.6531 0.7441 0.6565 0.6593 EST23 0.3734 0.3949 0.3023 0.3695 0.2277 0.6305 0.6051 0.7723 0.6266 0.6977 EST33 0.3379 0.3633 0.3503 0.4458 0.3695 0.5542 0.6367 0.6305 0.6621 0.6497 EST66 0.2949 0.2090 0.2480 0.4616 0.5045 0.5384 0.7910 0.4955 0.7051 0.7520 Mam03 0.4006 0.4599 0.4599 0.4458 0.4458 0.5542 0.5401 0.5542 0.5994 0.5401 Mam25 0.4175 0.3972 0.4915 0.4153 0.4458 0.5847 0.6028 0.5542 0.5825 0.5085 平均 0.3510 0.3757 0.3175 0.3818 0.4079 0.6182 0.6290 0.5921 0.6490 0.6825 注: A. 团头鲂; B.三角鲂; C. 翘嘴鲌; D. 团头鲂♀×翘嘴鲌♂; E. 三角鲂♀×翘嘴鲌♂Note: A. Megalobrama amblycephala; B. Megalobrama terminalis; C. Erythroculter ilishaeformis; D. Megalobrama amblycephala♀×Erythroculter ilishaeformis♂; E. Megalobrama terminalis♀×Erythroculter ilishaeformis♂ 表 4 不同群体的Nei’s遗传相似性(对角线上方)和遗传距离(对角线下方)
Table 4 Nei’s genetic identity (above diagonal) and genetic distance (below diagonal)
群体Population A B C D E A **** 0.9183 0.4207 0.7653 0.6661 B 0.0853 **** 0.5984 0.7117 0.7224 C 0.5204 0.5135 **** 0.6566 0.6213 D 0.3252 0.3401 0.4063 **** 0.8784 E 0.3266 0.2676 0.4207 0.1296 **** 注: A. 团头鲂; B. 三角鲂; C. 翘嘴鲌; D. 团头鲂♀×翘嘴鲌♂; E. 三角鲂♀×翘嘴鲌♂Note: A. Megalobrama amblycephala; B. Megalobrama terminalis; C. Erythroculter ilishaeformis; D. Megalobrama amblycephala♀×Erythroculter ilishaeformis♂; E. Megalobrama terminalis♀×Erythroculter ilishaeformis♂ -
[1] 楼允东, 李小勤. 中国鱼类远缘杂交研究及其在水产养殖上的应用. 中国水产科学, 2006, 13(1): 151—158 doi: 10.3321/j.issn:1005-8737.2006.01.024 Lou Y D, Li X Q. Distant hybridization of fish and its application in aquaculture in China [J]. Journal of Fishery Sciences of China, 2006, 13(1): 151—158 doi: 10.3321/j.issn:1005-8737.2006.01.024
[2] Zheng G D, Wang C L, Guo D D, et al. Ploidy level and performance in meiotic gynogenetic offsprings of grass carp using UV-irradiated blunt snout bream sperm [J]. Aquaculture and Fisheries, 2017, 2: 213—219 doi: 10.1016/j.aaf.2017.06.002
[3] 林义浩. 长春蝙、团头鲂及其杂种染色体组型的比较. 动物学研究, 1984, 5(3): 65—67 Lin Y H. A comparative of the karyotypes in Chinese bream, Herbivorous bream and their hybrid [J]. Zoological Research, 1984, 5(3): 65—67
[4] 葛瑞玲. 团头鲂(♀)×翘嘴红鲌(♂)杂交 F1 的生物学特征及遗传分析. 长沙: 湖南师范大学. 2011 Ge L R. The Biological charaeteristics and genetic analysis of the Fl hybrid of Megalobrama amblycephala (♀)×Erythroculter ilishaeformis (♂) [D]. Changsha: Hunan Normal University. 2011
[5] 金万昆, 杨建新, 高永平, 等. 团头鲂(♀)×翘嘴红鲌(♂)杂种 F1 的含肉率、肌肉营养成分及氨基酸含量. 淡水渔业, 2006, 36(1): 50—52 doi: 10.3969/j.issn.1000-6907.2006.01.014 Jin W K, Yang J X, Gao Y P, et al. The rate of flesh content, nutrient composition and the amino acid content of Megalobrama amblycephala (♀)×Erythroculter ilishaeformis (♂) [J]. Freshwater Fisheries, 2006, 36(1): 50—52 doi: 10.3969/j.issn.1000-6907.2006.01.014
[6] 山西大学生物系, 太原市农林水利服务站. 鳊鲂人工杂交的初步研究. 淡水渔业科技动态, 1973, (5): 6—9 Biology, Shanxi University, Taiyuan Agriculture and Forestry Water Service Station. Preliminary study on artificial hybridization of bream [J]. Freshwater Fisheries, 1973, (5): 6—9
[7] 顾志敏, 贾永义, 叶金云, 等. 翘嘴红鲌(♀)×团头鲂(♂)杂种 F1 的形态特征及遗传分析. 水产学报, 2008, 32(4): 533—543 Gu Z M, Jia Y Y, Ye J Y, et al. Studies on morphological characteristics and genetic analysis of the hybrid F1 Erythroculter ilishaeformis (♂)×Megalobrama amblycephala (♀) [J]. Journal of Fisheries of China, 2008, 32(4): 533—543
[8] 郑国栋, 张倩倩, 李福贵, 等. 团头鲂(♀)×翘嘴鲌(♂)杂交后代的遗传特征及生长差异. 中国水产科学, 2015, 22(3): 402—409 Zheng G D, Zhang Q Q, Li F G, et al. Genetic characteristics and growth performance of different Megalobrama amblycephala (♀)×Erythroculter ilishaeformis (♂) hybrids [J]. Journal of Fishery Sciences of China, 2015, 22(3): 402—409
[9] 马恒甲, 刘新轶, 黄辉, 等. 三角鲂(♀)×翘嘴红鲌(♂) F1及其亲本肌肉成分与必需氨基酸组成模式的比较分析. 渔业研究, 2016, 38(4): 281—287 Ma H J, Liu X T, Huang H, et al. Comparative analysis on the composition and composition pattern of essential amino acids in muscle of crossbreed F1[Megalobrama terminalis (♀)×Erythroculter ilishaeformis (♂)]and its parents [J].Journal of Fisheries Research, 2016, 38(4): 281—287
[10] 李思发. 鱼类良种介绍团头鲂浦江1号. 中国水产, 2001, (11): 52 doi: 10.3969/j.issn.1002-6681.2001.11.039 Li S F. Introduction of improved varieties of fish No. 1 PujiangMegalobrama amblycephala [J]. China Fisheries, 2001, (11): 52 doi: 10.3969/j.issn.1002-6681.2001.11.039
[11] Tang S J, Li S F, Cai W Q. Development of microsatellite markers for blunt snout bream Megalobrama amblycephala using 5′-anchored PCR [J]. Molecular Ecology Resources, 2009, 9(3): 971—974 doi: 10.1111/men.2009.9.issue-3
[12] Li W T, Liao X L, Yu X M, et al. Isolation and characterization of polymorphic microsatellite loci in Wuchang bream (Megalobrama amblycephala) [J]. Molecular Ecology Notes, 2007, 7(5): 771—773 doi: 10.1111/men.2007.7.issue-5
[13] Gao Z X, Luo W, Liu H, et al. Transcriptome analysis and SSR/SNP markers information of the blunt snout bream (Megalobrama amblycephala) [J]. PLoS One, 2012, 7(8): e42637 doi: 10.1371/journal.pone.0042637
[14] 张倩倩, 陈杰, 蒋霞云, 等. 不同鳊鲂鱼类群体微卫星DNA指纹图谱的构建和遗传结构分. 水产学报, 2014, 38(1): 15—22 Zhang Q Q, Chen J, Jiang X Y, et al. Establishment of DNA fingerprinting and analysis on genetic structure of different Parabramis and Megalobrama populations with microsatellite [J]. Journal of Fisheries of China, 2014, 38(1): 15—22
[15] Gao D, Du F, Zhu Y Y. Low-background and high-resolution contracted silver-stained method in polyacrylamide gels electrophoresis [J]. Hereditas(
Beijing ) , 2009, 31(6): 668—673 doi: 10.3724/SP.J.1005.2009.00668 [16] 吴旭东, 连总强, 侯玉霞, 等. 大口鲇微卫星标记在三个鲇形目鱼类种群间适用性研究. 水生生物学报, 2011, 35(4): 638—645 Wu X D, Lian Z Q, Hou Y X, et al. Application analysis of microsatellite makers from Silurus meriaionals on three species of siluriformes [J]. Acta Hydrobiologica Sinica, 2011, 35(4): 638—645
[17] 于冬梅, 马海涛, 孙效文. 三个虹鳟养殖群体遗传结构的微卫星分析. 动物学杂志, 2007, 42(4): 8—14 doi: 10.3969/j.issn.0250-3263.2007.04.002 Yu D M, Ma H T, Sun X W. Genetic diversity in three rainbow trout populations as revealed by microsatellite markers [J]. Journal of Zoology, 2007, 42(4): 8—14 doi: 10.3969/j.issn.0250-3263.2007.04.002
[18] 楼允东. 鱼类育种学. 北京: 中国农业出版社. 2001 Lou Y D. Fish Breeding [M]. Beijing: China Agriculture Press. 2001
[19] 北京市水产实验站. 鱼类引种和杂交实验的初步总结. 淡水渔业, 1973, (3): 15—18 Beijing Fisheries Station. Preliminary summary of introduction and hybridization of fish [J]. Freshwater Fisheries, 1973, (3): 15—18
[20] 长江水产研究所. 草鱼和武昌鱼杂交种. 今日科技, 1972, (20): 42—43 Yangtze River Fisheries Research Institute. The hybrids of grass carp and Wuchang fish [J]. Today Sciences and Technology, 1972, (20): 42—43
[21] 长江水产研究所. 几种经济鱼类及其杂种染色体的初步研究. 淡水渔业, 1975, (2): 11—13 Yangtze River Fisheries Research Institute. Preliminary study on several kinds of economic fish and their hybrid chromosomes [J]. Freshwater Fisheries, 1975, (2): 11—13
[22] 刘思阳. 三倍体草鲂杂种及其双亲的细胞遗传学研究. 水生生物学报, 1987, 11(1): 52—58 Liu S Y. Studies on cytogenetics of Ctenopharyngodon idellus, Megalobrama terminalis and their triploid F1 hybird [J]. Acta Hydrobiologica Sinica, 1987, 11(1): 52—58
[23] 刘思阳, 李素文. 三倍体草鲂杂种及其双亲的红细胞(核)大小和DNA含量. 遗传学报, 1987, (2): 62—68 Liu S Y, Li S W. On the Erythrocyte nucleus size and DNA contents of Ctenopharyngodon idellus, Megalobrama terminalis and their triploid F1 hybird [J]. Journal of Genetics, 1987, (2): 62—68
[24] 潘光碧. 鲢鲂杂交鱼的初步研究. 淡水渔业, 1987, 1(1): 17—19 Pan G B. Preliminary study on hybrid of silver carp and bream [J]. Freshwater Fisheries, 1987, 1(1): 17—19
[25] 朱蓝菲, 桂建芳, 梁绍昌, 等. 鲢的远缘杂交子代和人工三倍体的同工酶表达. 水生生物学报, 1993, 17(4): 293—297 Zhu L F, Gui J F, Liang S C, et al. Isozyme expression of distant hybridization offspring andartificial triploid in silver carp (Hypophthalmichthys molitrix) [J]. Acta Hydrobiologica Sinica, 1993, 17(4): 293—297
[26] 金万昆, 杨建新, 赵宜双, 等. 框鳞镜鲤♀×团头鲂♂杂种F1与亲本性腺组织学比较研究. 中国水产, 2005, (7): 63—65 doi: 10.3969/j.issn.1002-6681.2005.07.044 Jin W K, Yang J X, Zhao Y S, et al. Compare the gonadal tissue of hybrid F1 of Cyprinus carpio var. specularis (♀) and Megalobrama amblycephala (♂) with parent [J]. China Fisheries, 2005, (7): 63—65 doi: 10.3969/j.issn.1002-6681.2005.07.044
[27] 金万昆, 朱振秀, 王春英, 等. 框鳞镜鲤(♀)×团头鲂(♂)杂交及其杂种F1的形态学特征. 淡水渔业, 2003, 33(5): 16—18 doi: 10.3969/j.issn.1000-6907.2003.05.004 Jin W K, Zhu Z X, Wang C Y, et al. The characteristics of hybrid F1 of Cyprinus carpio var. specularis (♀) and Megalobrama amblycephala (♂) [J]. Freshwater Fisheries, 2003, 33(5): 16—18 doi: 10.3969/j.issn.1000-6907.2003.05.004
[28] 金万昆, 朱振秀, 王春英, 等. 散鳞镜鲤(♀)与团头鲂(♂)亚种间杂交获高成活率杂交后代. 中国水产科学, 2003, 10(2): 159—159 doi: 10.3321/j.issn:1005-8737.2003.02.019 Jin W K, Zhu Z X, Wang C Y, et al. A high survival rate of hybrid F1 was got from Cyprinu carpio L. Mirror (♀)×Megalobrama amblycephala (♂) [J]. Journal of Fishery Sciences of China, 2003, 10(2): 159—159 doi: 10.3321/j.issn:1005-8737.2003.02.019
[29] 广东省佛山地区水产局. 团头鲂长春鳊杂交种. 水产科技情报, 1975, (4): 18—19 Foshan Guangdong Fisheries Bureau. The hybrid of Megalobrama amblycephala and Parabramis pekinensis [J]. Fisheries Science & Technology Information, 1975, (4): 18—19
[30] 中国水产科学研究院长江水产研究所. 两年来淡水养殖鱼类优良品种选育和基础理论研究简况. 动物学杂志, 1975, (1): 45—47 Yangtze River Fisheries Research Institute. A brief introduction to breeding and basic theory of freshwater fish in two years [J]. Chinese Journal of Zoology, 1975, (1): 45—47
[31] 叶星, 谢刚, 祁宝伦, 等. 广东鲂(♀)×团头鲂(♂)杂交子一代及其双亲染色体组型的分析. 大连海洋大学学报, 2002, 17(2): 102—107 doi: 10.3969/j.issn.1000-9957.2002.02.005 Ye X, Xie G, Qi B L, et al. Comparison of karyotypes of the F1 hybrid (Megalobrama hoffmanni ♀×M. amblycephala ♂) with its parents [J]. Journal of Dalian Fisheries University, 2002, 17(2): 102—107 doi: 10.3969/j.issn.1000-9957.2002.02.005
[32] 叶星, 谢刚, 许淑英, 等. 广东鲂(♀)×团头鲂(♂)杂交子一代及其双亲同工酶的比较. 上海海洋大学学报, 2001, 10(2): 118—122 doi: 10.3969/j.issn.1004-7271.2001.02.004 Ye X, Xie G, Xu S Y, et al. Comparison on isozymes of F1 hybrid Megalobrama hoffmanni (♀)×Megalobrama amblycehala (♂) and its parents [J]. Journal of Shanghai Ocean University, 2001, 10(2): 118—122 doi: 10.3969/j.issn.1004-7271.2001.02.004
[33] 杨怀宇, 李思发, 邹曙明. 三角鲂与团头鲂正反交 F1 的遗传性状. 上海海洋大学学报, 2002, 11(4): 305—309 doi: 10.3969/j.issn.1004-7271.2002.04.001 Yang H Y, Li S F, Zou S M. A primary study on inheritance of morphological traits from Megalobrama amblycehala, Megalobrama terminalis to their reciprocal hybrids (F1) [J]. Journal of Shanghai Ocean University, 2002, 11(4): 305—309 doi: 10.3969/j.issn.1004-7271.2002.04.001
[34] 朱华平, 黄樟翰, 卢迈新. 翘嘴红鲌和海南红鲌同工酶的比较研究. 大连水产学院学报, 2003, 18(3): 175—179 doi: 10.3969/j.issn.1000-9957.2003.03.004 Zhu H P, Huang Z H, Lu M X. A comparative study on isozymes of Erythroculter ilishaeformis Bleeker and Erythroculter recurviceps Richardson [J]. Journal of Dalian Fisherise University, 2003, 18(3): 175—179 doi: 10.3969/j.issn.1000-9957.2003.03.004
[35] Hu J, Liu S, Xiao J, et al. Characteristics of diploid and triploid hybrids derived from female Megalobrama amblycephala (♀)×Xenocypris davidi Bleeker (♂) [J]. Aquaculture, 2012, (364−365): 157—164
[36] Zou S, Li S, Cai W, et al. Ploidy polymorphism and morphological variation among reciprocal hybrids by Megalobrama amblycephala×Tinca tinca [J]. Aquaculture, 2007, 270(1–4): 574—579 doi: 10.1016/j.aquaculture.2007.05.015
[37] Yang H, Li D Y, Cao X, et al. Genetic potential analysis of six Tilapia populations by microsatellite DNA markers [J]. Hereditas, 2011, 33(7): 768—775
[38] 李思发, 陈林, 蔡完其. 吉奥罗非鱼(新吉富罗非鱼♀×奥利亚罗非鱼♂)和4个近缘遗传型罗非鱼的遗传差异的RAPD、SSR比较分析. 水产学报, 2008, 32(5): 657—664 Li S F, Chen L, Cai W Q. Genetic variations among a new tilapia hybrid [NEW GIFT Tilapia (Oreochromis niloticus)♀×blue tilapia (O . aureas)♂] and four closed genotypes of tilapia by RAPD and SSR analysis [J].Journal of Fisheries of China, 2008, 32(5): 657—664
[39] Li O, Zhao Y Y, Guo N, et al. Effects of sample size and loci number on genetic diversity in wild population of grass carp revealed by SSR [J]. Zoological Research, 2009, 30(2): 121—130 doi: 10.3724/SP.J.1141.2009.02121
[40] Botstein D, White R L, Skolnick M, et al. Construction of genetic linkage map in man using restriction fragment length polymorphisms [J]. American Journal of Human Genetics, 1980, (32): 314—331
[41] 宓国强, 赵金良, 贾永义, 等. 鳜(♀)×斑鳜(♂)杂种F1的形态特征与微卫星分析. 上海海洋大学学报, 2010, 19(2): 145—150 Mi G Q, Zhao J L, Jia Y Y, et al. Morphological and microsatellite analysis of Siniperca chautsi ♀×Siniperca scherzeri ♂ hybrid with their parents [J]. Journal of Shanghai Ocean University, 2010, 19(2): 145—150
[42] 贾永义, 顾志敏, 叶金云, 等. 翘嘴红鲌(♀)×团头鲂(♂)杂种F1的SRAP标记分析. 上海海洋大学学报, 2011, 20(2): 198—203 Jia Y Y, Gu Z M, Ye J Y, et al. Analysis on genetic variations of Erythroculter ilishaeformis (♀)×Megalobrama amblycephala (♂) Hybrids F1 by SRAP markers [J]. Journal of Shanghai Ocean University, 2011, 20(2): 198—203
-
期刊类型引用(7)
1. 刘铠源,段勇杰,程浩,吕俊贤,谢婷,李娟,关长涛,贾玉东. 斑石鲷(Oplegnathus punctatus)、云龙石斑鱼(Epinephelus moara♀×E.lanceolatus♂)、许氏平鮋(Sebastes schlegelii)游泳行为对比分析研究. 海洋与湖沼. 2024(03): 555-565 .  百度学术
百度学术
2. 段勇杰,谢婷,高云涛,王枫林,李梦迪,关长涛,贾玉东. 斑石鲷(Oplegnathus punctatus)游泳性能研究. 海洋与湖沼. 2023(01): 183-193 .  百度学术
百度学术
3. 张静静,王亚冰,王倩,韩多彩,彭士明. 不同抗流能力大黄鱼(Larimichthys crocea)肌肉转录组学差异分析. 海洋与湖沼. 2023(05): 1507-1516 .  百度学术
百度学术
4. 李新丹,肖新平,周卫国,罗江,周杨浩,荣义峰,祁洪芳,史建全,杜浩. 青海湖裸鲤的游泳能力及鱼梯通过效果. 渔业科学进展. 2022(02): 44-52 .  百度学术
百度学术
5. 蔡露,Katopodis Christos,金瑶,黄应平,韩德举,胡望斌,陈小娟,陶江平,侯轶群. 中国鲤科鱼类游泳能力综合分析和应用. 湖泊科学. 2022(06): 1788-1801 .  百度学术
百度学术
6. 孙春艳,曾令清. 颜色标记对两种鱼类有氧运动能力的影响. 重庆师范大学学报(自然科学版). 2020(03): 67-71 .  百度学术
百度学术
7. 朱峰磊,张敬敬,龙静,闫玉莲,谢小军. 游泳加速模式对南方鲇和团头鲂运动后代谢恢复的影响. 淡水渔业. 2020(03): 65-71 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载: