A COMPARATIVE ANALYSIS ON THE GENETIC DIVERSITY OF TRICHIURUS LEPTURUS
-
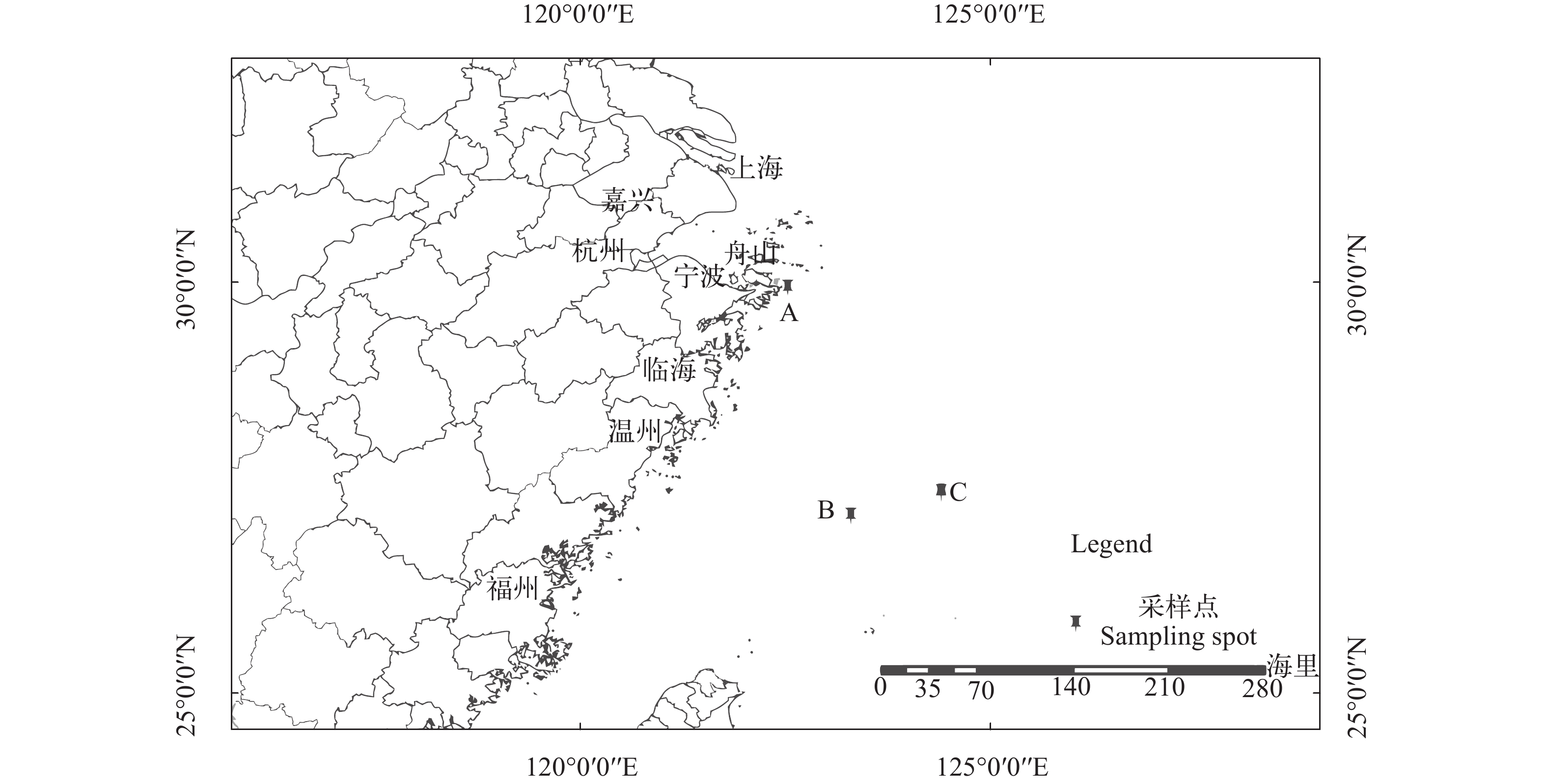
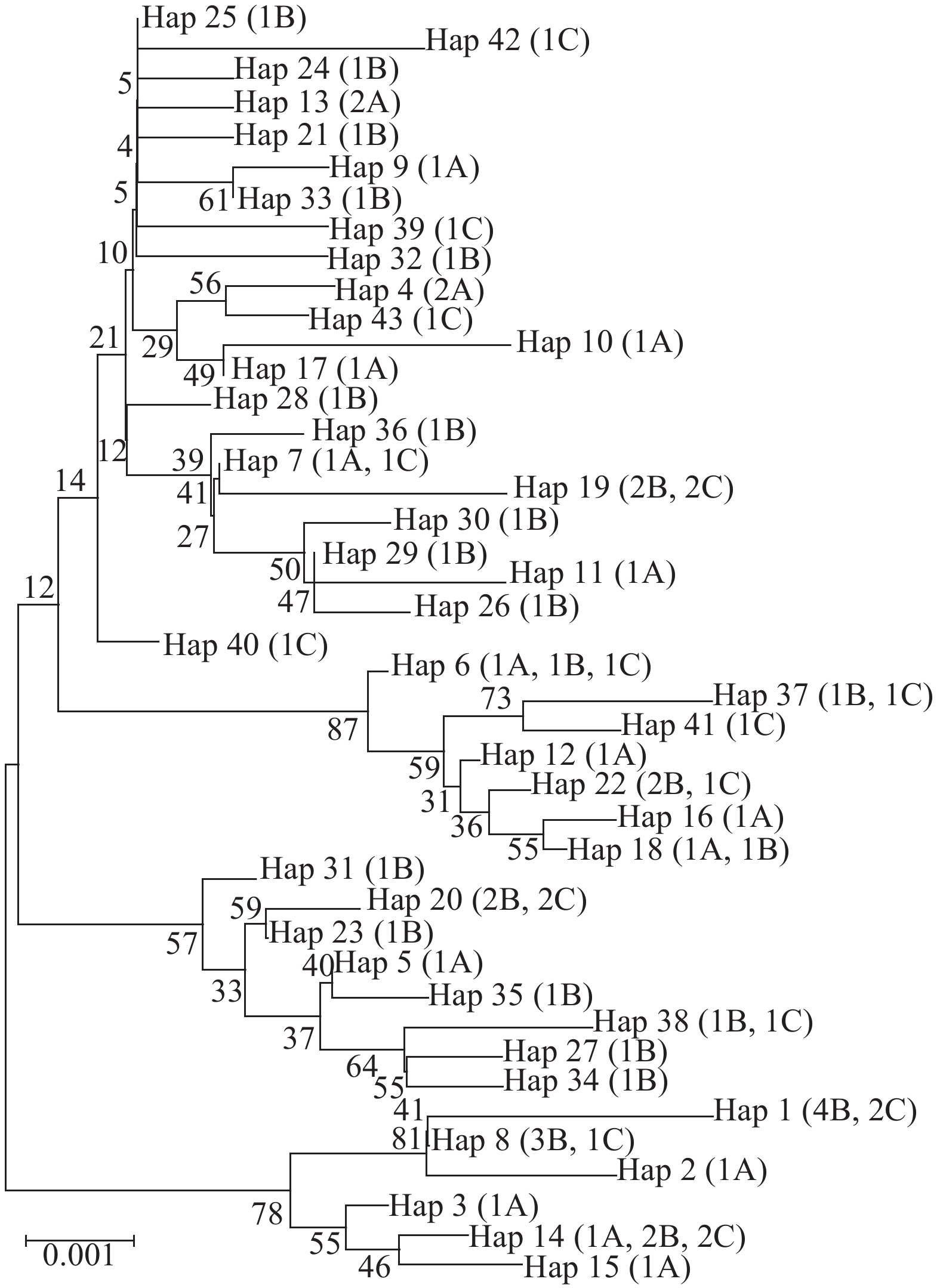
摘要: 测定了东海带鱼(Trichiurus lepturus Linnaeus)三个群体(命名为A: 122°32′E 29°55′N、B: 123°30′E 26°75N; C: 124°24′E 27°26′N)72个个体的线粒体DNA16S rRNA和COⅠ基因序列,通过单基因序列和联合序列分析, 研究了东海带鱼群体的遗传变异情况。分别得到1130 bp的COⅠ基因序列片段和554 bp的16S rRNA序列片段, 其中COⅠ基因片段的T、C、A、G含量分别为29.0%、28.9%、24.4%和17.7%; 16S rRNA基因片段的T、C、A、G含量分别为22.7%、27.6%、28.0%和21.7%。基于线粒体16S rRNA、COⅠ和16S+COⅠ基因序列分析, 72个个体中分别确定43个, 8个和49个单倍型, 存在单倍型共享现象。群体的单倍型多样性指数为0.9766—0.9992, 显示了群体内的单倍型较为丰富。3个群体间各序列平均核苷酸差异数(K)在5.111—9.024和0.0045—0.0076, 核苷酸多样性指数(π)为0.0048—0.0084, 显示不同带鱼群体遗传多态性丰富。使用邻接法构建的分子进化树揭示同一群体内大部分个体聚在一起。分析结果表明, 群体A遗传背景比群体B、群体C较为丰富, 群体内部个体差异大于群体间差异, 群体间基因交流频率较高, 遗传分化不明显, 初步判定东海带鱼3个群体的遗传多样性偏低。Abstract: Asingle gene fragment and combined nucleotide sequences for two gene fragments of mitochondrial DNA (mtDNA), which were 16S ribosomal RNA (16S rRNA) and cytochrome oxidase c subunit 1 (COⅠ), were analyzed for three populations of Trichiurus lepturus (T. lepturus, designated by A, B, and C). The length of 16S rRNA gene of mtDNA and COⅠ was 1130 and 554 bp, respectively. These two gene fragments were combined together to form a gene fragment with the length of 1684 bp for the purpose of subsequent genetic diversity analysis. The average contents of nucleotides T, C, A, and G were 29.0%, 28.9%, 24.4% and 17.7%, respectively in the mtDNA COⅠgene, while those mean contents were 22.7%, 27.6%, 28.0% and 21.7% respectively in 16S rRNA gene. In this study, 43, 8, and 49 haplotypes were defined in 72 individuals by using single and combined gene fragments, in which haplotypes were shared among the mentioned populations. The diversities of haplotypes varied between 0.9766 and 0.9992, indicating that the abundance of haplotypes was within different populations. The nucleotide differences and the nucleotide diversity in each population were in the ranges of 5.111—9.024 and 0.0045—0.0076, respectively. Genetic distances among the populations varied from 0.0048 to 0.00084. These results indicated that genetic diversity in three populations of T. lepturus was considerable. The construction of phylogenetic trees based on Neighbour-Joining (NJ) method showed that several individuals in the same population were aggregated. The achieved findings also indicated that high frequency of gene transfer among different populations resulted in low genetic differentiation. Population A contained richer genetic background than that of populations B and C. The difference within different populations was higher compared to among various populations. It could be concluded that the three mentioned populations of T. lepturus had low genetic diversity based on single and combined mtDNA genes.
-
Keywords:
- Trichiurus lepturus /
- COⅠ /
- 16S rRNA /
- Genetic diversity
-
年龄鉴定是研究鱼类生物学和生态学特性的重要组成部分, 也是分析和评价鱼类种群数量变动的基本依据之一[1]。鱼类年龄鉴定最普遍的方法是钙化组织分析法[2]。对于裂腹鱼类而言, 受特定生长环境的影响, 不同种类、不同阶段个体的鉴定材料年轮特征各不相同, 呈现出多样化的特点[3]。由于遗传差异和生存环境的差异, 鱼类的生长呈现出不同特点, 不同钙化组织上的年轮特征也表现各异。因此需要对不同的年龄材料进行对比, 最终选出最佳的年龄材料[4]。
双须叶须鱼(Ptychobarbus dipogon)隶属于裂腹鱼亚科(Schizothoracinae), 叶须鱼属(Ptychobarbus), 主要分布在西藏雅鲁藏布江中游干支流砂石底质的缓流处[5]。双须叶须鱼独特的种群特征、生活地理环境决定了其对环境变化和人为干扰极为敏感和脆弱[6]。近年来, 随着水利交通工程建设、渔业捕捞及工程材料索取加剧, 双须叶须鱼的种群数量和种群资源下降, 对双须叶须鱼种群资源构成了威胁。双须叶须鱼作为一个极为脆弱的种群资源, 为保护该物种的可持续性和稳定的种群而做出相应的管理是至关重要的[7]。杨鑫[6]主要研究雅鲁藏布江中游双须叶须鱼的耳石和脊椎骨两种年龄材料, Li等[7]主要研究雅鲁藏布江及其支流流域双须叶须鱼三对耳石年龄材料和微耳石的微结构特征及日增量。而本文研究主要是研究拉萨河流域双须叶须鱼8种年龄材料的年轮特征和年龄鉴定。
年龄鉴定结果可以阐明鱼类生长、性成熟年龄, 直接关系到鱼类种群分析与资源评估现状[8]。因此, 评估和比较每个物种所使用的年龄材料的研究是最基础和必要的内容[9]。本文对双须叶须鱼的微耳石、星耳石、脊椎骨、鳃盖骨、臀鳞、胸鳞、侧线鳞和背鳞等8种年龄材料的年轮特征进行了描述, 并对8种材料鉴定年龄的准确性和精确性进行了比较研究, 旨在为其生长特征、种群动态和资源变动提供可靠的年龄依据。
1. 材料与方法
1.1 样本采集
样本于2014年2月至12月在拉萨河上游采集双须叶须鱼193尾。全部测量全长、体长和体重, 长度精确到1 mm, 重量精确到0.1 g。取出左右微耳石、左右星耳石、鳃盖骨和6—8枚脊椎骨以及4种鳞片。样品用清水清洗, 晾干后放入封口袋冷冻保存。
1.2 年龄材料处理
微耳石 将微耳石远极面朝上, 用指甲油包埋, 固定在载玻片上, 静置, 让其凝固, 然后先用#1500的砂纸打磨, 再用#2000#的砂纸抛光, 打磨期间时刻加水, 并随时在显微镜下观察。直至微耳石核区年轮清晰为止, 最后放在显微镜下拍照保存。
星耳石 将星耳石内侧面朝上, 用指甲油包埋, 固定在载玻片上, 静置, 让其凝固。首先用#1500的砂纸打磨。再用#2000的砂纸抛光, 打磨期间时刻加水, 并在显微镜下拍照保存。
脊椎骨 将脊椎骨放入开水中浸泡1—2min, 用牙刷轻轻刷去附着的肌肉和结缔组织, 剪去多余的骨棘, 从中间将脊椎骨剪断, 静置让其干燥。调整好角度在显微镜下拍照保存。
鳃盖骨 将鳃盖骨放入开水中1min, 用牙刷剔除附着的肌肉的结缔组织, 让其自然干燥, 然后放在体视显微镜下用透射光观察, 并拍照保存。
鳞片 将鳞片放入清水中, 用牙刷轻轻刷去附着的黏膜, 取6片放在载玻片上, 然后盖上载玻片, 用胶带固定并用记号笔编号。最后放在显微镜下拍照保存。
1.3 年龄鉴定方法及年轮特征描述
根据殷名称[10]《鱼类生态学》的年轮鉴别特点及鉴定和分析鱼类年龄的方法, 在不清楚样本大小、性别的情况下对八种年龄材料进行年龄鉴定。每个年龄材料的年龄由同一观察者进行2次独立鉴定, 时间间隔不少于1周。
以体长大小为依据, 划分低龄、中龄和高龄3个年龄段[11], 并根据每一年龄段的同一样本, 描述8种年龄材料的年轮特征。
1.4 八种年龄材料的差异性
平均年龄的显著性分析 对8种年龄材料的平均年龄读数采用单因素方差分析(ANOVA)和多重比较进行统计检验和分析, 来解释8种年龄材料鉴定结果的差异性。
平均百分比误差(IAPE) 采用平均百分比误差(IAPE)来计算不同观察者年龄鉴定结果的精确性, 公式如下:
$ IAP{E_j} = \frac{1}{N}\sum\limits_{j = 1}^N {\left\{ {\frac{1}{R}\sum\limits_{{{i}} = 1}^R {\frac{{\left| {X_{ij} - X_j} \right|}}{X}} } \right\}} \times 100{{\%}} $


式中, N为进行年龄鉴定的鱼尾数; R为每尾鱼进行年龄鉴定的次数; Xij为第j尾鱼进行的第i次年龄鉴定结果; Xj为第j尾鱼的平均年龄。
为了更好地对不同年龄材料进行比较, 前后鉴定结果最终必须一致。若结果不一致, 则重新对该年龄材料进行年龄鉴定, 直到最终结果统一为止。若再次鉴定后, 结果差距较大, 则将其除去。在西藏其他裂腹鱼类[11, 12]的年龄材料鉴定中微耳石的清晰度是最好的, 并且双须叶须鱼微耳石的年轮比较清晰, 故以微耳石鉴定的年龄为准, 将星耳石、脊椎骨、鳃盖骨、臀鳞、胸鳞、侧线鳞和背鳞7种年龄材料分别和微耳石计算所得IAPE来进行比较。
清晰度评分 对8种年龄材料年轮的清晰度按照5个等级进行评分[11]: 1是非常好, 2是好, 3是一般, 4是很差, 5是难以辨认。
1.5 数据分析
统计分析采用SPSS 21和Excel 2003, 数据采用平均数±标准差表示, 当P<0.05时, 存在显著性差异。
2. 结果
总共采集到193尾双须叶须鱼, 体长为155—550 mm, 体重为46.5—1704.5 g。
2.1 年轮特征
微耳石 微耳石为不规则的椭圆形, 近极面前端膨大, 后端似铲型; 远极面微微隆起, 前端似由许多晶体组成, 从前端到后端逐渐变薄(图 1d1—d4)。中心核靠近前端, 在入射光下, 从微耳石核心向外边缘颜色逐渐变淡。在年轮排列区域, 年轮间距呈现有规律的缩短, 靠近中心核的年轮间距较大, 到10龄年轮间距明显变窄, 在20龄后年轮间距显著变窄(图 2f、图 3f、图 4g)。
![]() 图 1 双须叶须鱼背鳞(a)、侧线鳞(b)、胸鳞(c)、微耳石(d1、d2、d3、d4)、臀鳞(e)、鳃盖骨(f)、脊椎骨(g)、星耳石(h1、h2)的形态特征PZ为前区; UZ为上侧区; DZ为下侧区; BZ为后区; d1为远极面; d2为背面; d3为腹面; d4为近极面; h1为内侧面; h2为外侧面; 1为脊突; 2为翼叶; 3为主间沟; 4为基叶; 5为中央听沟; 6为叶突Figure 1. Morphological characteristics of back scale (a), lateral-line scale (b), chest scale (c), lapillus (d1, d2, d3, d4), hip scale (e), opercular bone (f), vertebrae (g), asteriscus (h1, h2) of Ptychobarbus dipogonPZ is the front zone; UZ is the upper zone; DZ is the lower zone; BZ is the rear zone; d1 is the far pole face; d2 is the back face; d3 is the ventral face; d4 is the near pole face; h1 is the inside face; h2 is the lateral side; 1 is the spinal protrusion; 2 is the wing leaf; 3 is the main groove; 4 is the basal leaf; 5 is the central auditory ditch; 6 is a leaf protrusion
图 1 双须叶须鱼背鳞(a)、侧线鳞(b)、胸鳞(c)、微耳石(d1、d2、d3、d4)、臀鳞(e)、鳃盖骨(f)、脊椎骨(g)、星耳石(h1、h2)的形态特征PZ为前区; UZ为上侧区; DZ为下侧区; BZ为后区; d1为远极面; d2为背面; d3为腹面; d4为近极面; h1为内侧面; h2为外侧面; 1为脊突; 2为翼叶; 3为主间沟; 4为基叶; 5为中央听沟; 6为叶突Figure 1. Morphological characteristics of back scale (a), lateral-line scale (b), chest scale (c), lapillus (d1, d2, d3, d4), hip scale (e), opercular bone (f), vertebrae (g), asteriscus (h1, h2) of Ptychobarbus dipogonPZ is the front zone; UZ is the upper zone; DZ is the lower zone; BZ is the rear zone; d1 is the far pole face; d2 is the back face; d3 is the ventral face; d4 is the near pole face; h1 is the inside face; h2 is the lateral side; 1 is the spinal protrusion; 2 is the wing leaf; 3 is the main groove; 4 is the basal leaf; 5 is the central auditory ditch; 6 is a leaf protrusion![]() 图 2 低龄双须叶须鱼(体长215 mm)背鳞(a)、侧线鳞(b)、胸鳞(c)、臀鳞(d)、星耳石(e)、微耳石(f)、鳃盖骨(g)、脊椎骨(h)的年轮特征(圆点示年轮)背鳞5龄(a); 侧线鳞4龄(b); 胸鳞5龄(c); 臀鳞5龄(d); 星耳石7龄(e); 微耳石7龄(f); 鳃盖骨7龄(g); 脊椎骨7龄(h)Figure 2. Annuli characteristics of back scale (a), lateral-line scale (b), chest scale (c), hip scale (d), asteriscus (e), lapillus (f), opercular bone (g), vertebrae (h) from the same Ptychobarbus dipogon with 215 mm SL(dots show annuli)back scale 5 years (a); lateral-line scale 4 years (b); chest scale 5 years (c); hip scale 5 years (d); asteriscus 7 years (e); lapillus 7 years (f); opercular bone 7 years (g); vertebrae 7 years (h)
图 2 低龄双须叶须鱼(体长215 mm)背鳞(a)、侧线鳞(b)、胸鳞(c)、臀鳞(d)、星耳石(e)、微耳石(f)、鳃盖骨(g)、脊椎骨(h)的年轮特征(圆点示年轮)背鳞5龄(a); 侧线鳞4龄(b); 胸鳞5龄(c); 臀鳞5龄(d); 星耳石7龄(e); 微耳石7龄(f); 鳃盖骨7龄(g); 脊椎骨7龄(h)Figure 2. Annuli characteristics of back scale (a), lateral-line scale (b), chest scale (c), hip scale (d), asteriscus (e), lapillus (f), opercular bone (g), vertebrae (h) from the same Ptychobarbus dipogon with 215 mm SL(dots show annuli)back scale 5 years (a); lateral-line scale 4 years (b); chest scale 5 years (c); hip scale 5 years (d); asteriscus 7 years (e); lapillus 7 years (f); opercular bone 7 years (g); vertebrae 7 years (h)![]() 图 3 中龄双须叶须鱼(体长400 mm)背鳞(a)、侧线鳞(b)、胸鳞(c)、臀鳞(d)、星耳石(e)、微耳石(f)、脊椎骨(g)、鳃盖骨(h)的年轮特征(圆点示年轮)背鳞9龄(a); 侧线鳞9龄(b); 胸鳞8龄(c); 臀鳞10龄(d); 星耳石17龄(e); 微耳石17龄(f); 脊椎骨15龄(g); 鳃盖骨15龄(h)Figure 3. Annuli characteristics of back scale (a), lateral-line scale (b), chest scale (c), hip scale (d), asteriscus (e), lapillus (f), vertebrae (g), opercular bone (h) from the same Ptychobarbus dipogon with 400 mm SL (dots show annuli)back scale 9 years (a); lateral-line scale 9 years (b); chest scale 8 years (c); hip scale 10 years (d); asteriscus 17 years (e); lapillus 17 years (f); vertebrae 15 years (g); opercular bone15 years (h)
图 3 中龄双须叶须鱼(体长400 mm)背鳞(a)、侧线鳞(b)、胸鳞(c)、臀鳞(d)、星耳石(e)、微耳石(f)、脊椎骨(g)、鳃盖骨(h)的年轮特征(圆点示年轮)背鳞9龄(a); 侧线鳞9龄(b); 胸鳞8龄(c); 臀鳞10龄(d); 星耳石17龄(e); 微耳石17龄(f); 脊椎骨15龄(g); 鳃盖骨15龄(h)Figure 3. Annuli characteristics of back scale (a), lateral-line scale (b), chest scale (c), hip scale (d), asteriscus (e), lapillus (f), vertebrae (g), opercular bone (h) from the same Ptychobarbus dipogon with 400 mm SL (dots show annuli)back scale 9 years (a); lateral-line scale 9 years (b); chest scale 8 years (c); hip scale 10 years (d); asteriscus 17 years (e); lapillus 17 years (f); vertebrae 15 years (g); opercular bone15 years (h)![]() 图 4 高龄双须叶须鱼(体长488 mm)背鳞(a)、侧线鳞(b)、胸鳞(c)、臀鳞(d)、鳃盖骨(e)、星耳石(f)、微耳石(g)、脊椎骨(h)的年轮特征(圆点示年轮)背鳞11龄(a); 侧线鳞12龄(b); 胸鳞12龄(c); 臀鳞16龄(d); 鳃盖骨23龄(e); 星耳石26龄(f); 微耳石34龄(g); 脊椎骨21龄(h)Figure 4. Annuli characteristics of back scale (a), lateral-line scale (b), chest scale (c), hip scale (d), opercular bone(e), asteriscus (f), lapillus (g), vertebrae (h) from the same Ptychobarbus dipogon with 488 mm SL (dots show annuli)back scale 11 years (a); lateral-line scale 12 years (b); chest scale 12 years (c); hip scale 16 years (d); opercular bone 23 years (e); asteriscus 26 years (f); lapillus 34 years (g); vertebrae 21 years (h)
图 4 高龄双须叶须鱼(体长488 mm)背鳞(a)、侧线鳞(b)、胸鳞(c)、臀鳞(d)、鳃盖骨(e)、星耳石(f)、微耳石(g)、脊椎骨(h)的年轮特征(圆点示年轮)背鳞11龄(a); 侧线鳞12龄(b); 胸鳞12龄(c); 臀鳞16龄(d); 鳃盖骨23龄(e); 星耳石26龄(f); 微耳石34龄(g); 脊椎骨21龄(h)Figure 4. Annuli characteristics of back scale (a), lateral-line scale (b), chest scale (c), hip scale (d), opercular bone(e), asteriscus (f), lapillus (g), vertebrae (h) from the same Ptychobarbus dipogon with 488 mm SL (dots show annuli)back scale 11 years (a); lateral-line scale 12 years (b); chest scale 12 years (c); hip scale 16 years (d); opercular bone 23 years (e); asteriscus 26 years (f); lapillus 34 years (g); vertebrae 21 years (h)星耳石 星耳石为星状, 轮纹不明显, 边缘为锯齿状, 内侧面中间长轴处为凹槽, 外侧面微微隆起, 具有辐射状脊(图 1h1、图 1h2)。到12龄间距明显变窄, 而到20龄后年轮间距显著变窄(图 2e、图 3e、图 4f)。
脊椎骨 脊椎骨为双凹型, 中心有一小孔, 前后凹面呈现出宽窄交替的同心圆轮纹, 在入射光下, 呈明暗交替分布。小孔的周围较为透明, 轮纹很少很细, 很难确认起始轮的位置。脊椎骨的边缘有较厚的结缔组织, 难以辨认末轮(图 1g)。脊椎骨的年轮宽度不会随着年龄的增加而显著变窄(图 2h、图 3g、图 4h)。
鳃盖骨 鳃盖骨为不规则的四边形, 基部内侧有许多小孔, 表面轮纹平行排列, 边缘为锯齿状。基部较厚, 且呈黄色, 难以辨认首轮位置(图 1f)。低龄鱼的鳃盖骨轮纹间隔大且稀疏, 不易分辨年轮; 高龄鱼轮纹排列紧密, 容易辨认。年轮间距呈现有规律的缩短, 到12龄年轮间距明显变窄(图 2g、图 3h、图 4e)。
臀鳞 臀鳞取自肛门至臀鳍的两侧, 大多数臀鳞形态特征特化, 下侧区向内弯曲, 呈“L”形。前区轮纹密集, 很难有效辨识年轮; 后区各年轮间隙较明显, 但夹杂副轮。有少部分鳞片上后区内的副轮与年轮十分相似, 较难区别, 需依靠侧区辅助观察(图 1e、图 2d、图 3d、图 4d)。
胸鳞、侧线鳞和背鳞 胸鳞取自侧线下方, 胸鳍基部(图 1c)。侧线鳞取自鱼体两侧的侧线部位, 中央有一条透明的管道(图 1b)。背鳞取自侧线上方, 背鳍附近(图 1a)。这3种环片疏密不明显, 但在入射光下可见到明亮的脊高出相邻环片, 脊的外缘即为年轮。前区、上侧区和下侧区均可作为年龄读取区。
2.2 八种年龄材料的比较
共采集193尾样本, 体长为155—550 mm, 体重为46.5—1704.5 g, 其中微耳石鉴定年龄在4—49龄, 星耳石鉴定年龄在4—35龄, 脊椎骨鉴定年龄范围在4—34龄, 鳃盖骨鉴定年龄范围在4—34龄, 臀鳞鉴定年龄范围在4—22龄, 胸鳞鉴定年龄范围在4—19龄, 侧线龄鉴定年龄范围在4—16龄, 背鳞鉴定年龄范围在4—17龄。不同年龄组的样本数和体长信息见表 1。
表 1 双须叶须鱼八种年龄材料所鉴定的各个年龄组的样本数和体长Table 1. Number of specimens and body length at different ages of Ptychobarbus dipogon年龄
Age (y)微耳石
Lapillus星耳石
Asteriscus脊椎骨
Vertebrae鳃盖骨
Opercular bones臀鳞
Hip scale胸鳞
Chest scale侧线鳞
Lateral-line scale背鳞
Back scaleN Mean±SD (mm) N Mean±SD (mm) N Mean±SD (mm) N Mean±SD (mm) N Mean±SD (mm) N Mean±SD (mm) N Mean±SD (mm) N Mean±SD (mm) 4 1 155.0 1 155.0 1 155.0 2 182.5±38.9 4 201.3±11.1 1 210 2 197.5±17.7 5 6 211.7±25.4 6 211.7±25.4 4 198.8±8.5 6 198.3±10.3 3 203.3±47.5 5 207.0±41.0 8 199.4±29.3 7 211.4±35.1 6 12 222.1±23.9 11 224.6±23.4 11 225.0±23.4 11 232.7±22.2 8 211.3±25.3 11 245.9±41.9 9 261.4±51.7 8 240.5±52.7 7 4 248.8±25.9 4 231.3±33.8 6 238.3±33.0 6 250.8±28.5 11 251.4±87.1 11 296.9±95.4 11 260.2±48.6 17 295.3±77.3 8 3 268.3±7.6 3 268.3±7.6 4 258.8±20.2 1 270.0 7 299.1±49.0 13 331.9±34.9 20 341.6±57.6 18 349.1±49.7 9 2 287.0±9.9 2 272.5±10.6 2 295.5±21.9 1 280.0 8 314.1±46.3 14 354.4±59.0 22 369.2±47.7 23 363.9±48.1 10 4 294.3±20.7 6 299.5±20.7 3 282.7±12.1 6 326.7±42.8 19 343.9±31.6 35 389.6±58.5 28 403.4±61.7 31 400.4±57.1 11 1 342.0 8 342.6±23.4 10 335.0±11.0 9 341.2±35.0 16 364.0±43.8 22 405.2±51.4 27 402.7±56.5 34 417.2±57.4 12 4 335.3±9.6 5 352.8±36.6 6 360.3±39.3 8 329.6±21.9 29 399.8±65.4 28 424.5±55.4 24 438.2±62.7 22 442.1±60.3 13 5 338.2±19.5 8 358.6±38.1 7 339.3±22.0 11 355.2±50.0 22 424.7±53.2 21 436.9±57.4 24 451.0±53.0 16 440.2±56.9 14 11 342.3±33.0 11 350.7±36.4 13 364.1±46.5 16 364.9±31.4 21 424.2±51.5 18 438.0±64.2 9 431.9±54.5 10 474.7±53.2 15 12 344.9±31.2 12 363.4±49.6 13 380.0±53.0 12 361.3±35.7 14 415.2±59.8 5 482.6±24.9 6 445.2±75.2 2 480.5±12.0 16 10 365.0±43.5 23 388.1±55.7 17 388.0±52.7 7 367.6±35.1 14 448.6±43.0 4 481.0±17.2 4 469.0±54.7 2 431.0±97.6 17 8 376.3±34.5 14 402.5±39.2 13 406.2±36.8 12 405.9±48.5 7 487.3±39.8 1 510.0 1 510.0 18 11 386.5±49.6 5 411.6±31.3 17 403.8±55.4 13 437.5±45.3 9 450.8±49.3 19 7 402.9±36.0 6 420.0±26.4 5 416.4±44.2 6 410.3±55.5 1 490.0 1 490.0 20 9 414.6±60.7 8 415.6±58.5 7 423.0±53.0 7 379.3±17.0 2 476.0±33.9 21 7 406.7±44.9 10 457.8±49.3 9 446.3±66.9 9 453.1±36.9 1 490.0 22 5 380.6±61.8 10 443.1±50.0 10 452.4±43.1 9 481.1±21.8 1 550.0 23 2 432.5±29.0 7 451.7±26.9 12 470.3±27.2 10 460.8±33.4 24 7 433.6±16.9 11 469.5±43.6 5 448.8±36.6 7 443.4±27.3 25 7 445.0±49.4 6 488.7±29.6 6 486.8±51.4 5 470.8±56.3 26 4 459.8±49.1 5 452.0±64.5 1 452.0 5 480.8±11.7 27 9 447.0±41.4 2 453.5±50.2 4 497.3±16.8 2 485.0±0.0 28 9 450.2±33.1 2 451.0±1.4 1 450.0 3 451.7±42.5 29 5 472.0±35.0 2 525.0±35.4 2 467.0±7.1 3 475.3±49.8 30 3 459.3±44.5 1 550.0 2 520.0 31 2 451.0±1.4 2 492.5±10.6 2 510.0±14.1 1 510.0 32 3 482.0±55.8 1 500.0 2 511.0±15.6 33 3 439.7±54.0 1 520.0 34 2 490.5±0.7 1 500.0 1 550.0 35 4 489.5±14.7 1 500.0 36 2 471.0±26.9 37 2 515.0±7.1 39 1 462.0 40 1 550.0 41 1 508.0 42 1 522.0 43 1 500.0 44 1 500.0 49 1 500.0 总计
Total193 193 193 193 193 193 193 193 2.3 八种年龄材料的平均年龄比较
双须叶须鱼不同年龄材料所鉴定的平均年龄见表 2。8种年龄材料所鉴定的平均年龄存在显著性差异(P<0.05)。用微耳石作为年龄材料所鉴定的平均年龄最高(20.05龄), 显著高于星耳石(16.84龄)、脊椎骨(16.56)、鳃盖骨(16.70龄)、臀鳞(11.34龄)、胸鳞(9.58龄)、侧线鳞(9.33龄)和背鳞(9.33龄)所鉴定的平均年龄(P<0.05)。23龄以下和23龄以上样本分开统计时, 4—23龄样本中, 微耳石鉴定的平均年龄与星耳石和脊椎骨鉴定的平均年龄较为接近, 分别为14.39龄、13.13龄、13.20龄, 显著高于鳃盖骨(12.96龄)、臀鳞(9.93龄)、胸鳞(8.49龄)、侧线鳞(8.30龄)和背鳞(8.13龄)所鉴定的平均年龄(P<0.05)。大于23龄时, 星耳石(23.52龄)、脊椎骨(22.61龄)和鳃盖骨(23.42龄)所鉴定的平均年龄较为接近, 星耳石、脊椎骨、鳃盖骨、臀鳞、胸鳞、侧线鳞和背鳞7种年龄鉴定材料都显著低于微耳石所鉴定的平均年龄30.23龄(P<0.05)。
表 2 不同年龄材料所鉴定的平均年龄的比较Table 2. The average age of different age materials年龄材料
Ages
structure平均年龄
Mean values of
age estimate年龄Total Age 4—14 Age 4—23 Age>23 微耳石
Lapillus20.05±9.32a 9.32±3.51a 14.39±5.26a 30.23±5.59a 星耳石
Asteriscus16.84±6.52b 9.11±3.25ab 13.13±4.44ab 23.52±3.71b 脊椎骨
Vertebrae16.56±6.18b 9.06±3.05ab 13.20±4.39ab 22.61±3.92b 鳃盖骨
Opercular
bones16.70±6.70b 8.98±3.28ab 12.96±4.62b 23.42±4.10b 臀鳞
Hip scale11.34±3.47c 7.74±2.49bc 9.93±3.04c 13.87±2.68c 胸鳞
Chest scale9.58±2.85d 6.62±2.26c 8.49±2.65d 11.54±2.03d 侧线鳞
Lateral-line
scale9.33±2.67d 6.49±1.85c 8.30±2.51d 11.17±1.81d 背鳞
Back scale9.33±2.68d 6.47±1.90c 8.13±2.41d 10.65±1.82d N 193 53 124 69 注: 表中同列数字上标不同字母表示有显著差异性(P<0.05)Note: Values with different superscripts in each column are significantly different from each other (P<0.05) 2.4 八种年龄材料的平均百分比误差比较
用微耳石鉴定年龄时, 多次读数的平均百分比误差(IAPE)最低(3.31%), 从小到大依次为: 星耳石(4.72%)、脊椎骨(4.79%)、臀鳞(5.11%)、鳃盖骨(5.17%)、胸鳞(5.19%)、侧线鳞(5.88%)、背鳞(5.86%)。其他7种年龄材料和微耳石比较的IAPE从小到大依次为星耳石(12.28%)、脊椎骨(15.67%)、鳃盖骨(17.81%)、臀鳞(41.63%)、侧线鳞(50.50%)、胸鳞(51.26%)、背鳞(51.74%)。从星耳石、脊椎骨、鳃盖骨、臀鳞、胸鳞、侧线鳞和背鳞分别与耳石作比较的IAPE值(图 5)可以看出, 星耳石、脊椎骨、鳃盖骨鉴定的年龄结果比四种鳞片准确。但仅从IAPE值来看, 并不能确定星耳石、脊椎骨和鳃盖骨做鉴定的年龄结果哪个更精确。但是统计分析表明(表 2), 星耳石和脊椎骨的年龄读数与微耳石的年龄读数在低于23龄时没有显著性差异(P>0.05), 而鳃盖骨所鉴定的年龄无论是在低龄还是高龄都显著低于耳石所鉴定的年龄(P<0.05)。随着年龄增加, IAPE值基本上呈现上升趋势, 差异也逐渐增大, 对于鉴定高龄鱼时所产生的差异越来越大。
2.5 八种年龄材料的清晰度评分比较
由于4种鳞片年龄读数在高于14龄组内都与微耳石有显著差异, 因此在清晰度评分中分为低于14龄组和高于14龄组。微耳石上的年龄较清晰, 在低于14龄和高于14龄组内被评为“非常好”和“好”的都较其他材料多, 故微耳石在进行年龄鉴定时准确性最好(表 3、表 4)。
表 3 双须叶须鱼不同年龄材料的清晰度评分(4—14龄)Table 3. Distribution of readability scores for different age materials of Ptychobarbus dipogon (4—14 years)年龄材料
Ages structure清晰度评分比例
Proportion of readability score1 2 3 4 5 微耳石
Lapillus9.43 66.04 18.87 5.66 星耳石
Asteriscus1.89 43.40 35.85 16.98 1.89 脊椎骨
Vertebrae3.77 43.40 45.28 3.77 3.77 鳃盖骨
Opercular bones1.89 64.15 30.19 1.89 1.89 臀鳞
Hip scale16.98 56.60 24.53 1.89 胸鳞
Chest scale9.43 50.94 30.19 9.43 侧线鳞
Lateral-line scale11.32 56.60 28.30 1.89 1.89 背鳞
Back scale11.32 60.38 24.53 3.77 表 4 双须叶须鱼不同年龄材料的清晰度评分(14龄以上)Table 4. Distribution of readability scores for different calcified struc-tures of Ptychobarbus dipogon (more than 14 years)年龄材料
Ages structure清晰度评分比例
Proportion of readability score1 2 3 4 5 微耳石
Lapillus4.29 57.86 29.29 6.43 2.14 星耳石
Asteriscus2.14 49.29 35.00 11.43 2.14 脊椎骨
Vertebrae4.29 50.00 34.29 8.57 2.86 鳃盖骨
Opercular bone2.86 51.43 36.43 6.43 2.86 2.6 年龄与体长关系
微耳石年龄鉴定的年龄读数(A)与相对应的体长(L)呈极显著的对数函数关系(P<0.01), 其相关关系式为: L=146.76 ln (A)–38.139, R2=0.8312。随着年龄的增加, 双须叶须鱼体长随之增长, 但其增长速率随之减缓(图 6)。
3. 讨论
3.1 年龄鉴定的准确性比较
鱼类年轮特征的研究是进行鱼类年龄鉴定的前提[1]。而年龄鉴定的准确性直接关系到鱼类生长参数估算的可靠程度[13], 这对于渔业的管理和资源的合理开发尤为重要; 低估年龄的结果将导致对鱼类生长估计过快和自然死亡率估计过高, 因而对产量做出过于乐观的估计, 往往会造成资源的过度开发[14]。
就同一种鱼而言, 不同的年龄材料轮纹的清晰度和数目不一定相同, 所以可能导致不同年龄段的最适材料也有所不同[15]。本文微耳石鉴定所得的最大年龄为49龄, 星耳石鉴定所得的最大年龄为35龄, 脊椎骨鉴定所得最大年龄为34龄, 鳃盖骨为34龄, 臀鳞为22龄, 胸鳞为19龄, 侧线鳞为16龄, 背鳞为17龄。在低于23龄时, 微耳石与星耳石和脊椎骨鉴定的平均年龄之间无显著性差异(P>0.05), 相差年龄在1龄以内, 显著高于鳃盖骨和四种鳞片(P<0.05)。反映出在鉴定低龄个体时, 微耳石、星耳石和脊椎骨作为年龄材料是可行的。分析原因为, 鳃盖骨仅在边缘可观察到明暗相间排列的环纹, 鳃盖骨基部变厚[16], 中心轮纹判别能力差, 不易确定年龄[13]; 鳞片随年龄增长易出现磨损或者停滞现象[17], 通常会低估高龄和生长速率慢的个体年龄[13], 只适用于对低龄、生长较快的鱼类进行年龄鉴定[18], 特别是裂腹鱼特有的臀鳞与其繁殖行为密切相关, 致使鳞片的磨损很难避免[19], 裂腹鱼类的鳞片在长期进化过程中为适应高原寒冷的水域环境而存在着不同程度的退化[12]。
然而高于23龄时, 7种年龄鉴定材料均显著低于微耳石鉴定的平均年龄(P<0.05)。星耳石高龄个体年轮特征不明显, 杂纹较多[20]; 脊椎骨首轮较难辨认[21], 轮纹较为密集, 增加高龄鱼年龄鉴定的误差[11], 生活的地理环境特殊、环境条件恶劣, 脊椎骨上年轮的形成和排列可能受到环境条件的影响[11, 12]。而耳石年轮标志明显, 可判读力高[22]。耳石生长是以与机体生长相对独立, 在慢生长和高龄个体中比其他骨质材料生长更快, 从而能更真实地记录周期性季节生长和年龄[23], 所以采用耳石估计生长缓慢和相对长寿命群体或种类的年龄更为准确[24]。此外, 与微耳石比较的平均百分比误差相比, 星耳石、脊椎骨、鳃盖骨与之相差不大, 4种鳞片与之差别较大。并且IAPE值随着年龄增加基本上呈现上升趋势反映出在高龄个体年龄鉴定水平上所产生的差异越来越大。
在国内许多学者对裂腹鱼不同年龄鉴定材料的比较研究中, 得出耳石读数较其他年龄材料准确。马宝珊[11]和周贤君[12]分别通过研究异齿裂腹鱼和拉萨裂腹鱼的3种年龄材料(耳石、脊椎骨和鳃盖骨)发现耳石是年龄鉴定的最合适材料, 霍斌[25]研究尖裸鲤年龄材料发现釆用耳石作为年龄鉴定材料其准确性和精确性要优于脊椎骨, 并且耳石还是伊犁裂腹鱼[26]、色林错裸鲤[14]、软刺裸裂尻鱼[27]、青海湖裸鲤[3]的最佳年龄材料。
总而言之, 双须叶须鱼8种年龄鉴定材料均为每年形成一个年轮, 本研究通过不同年龄鉴定材料的比较发现, 在进行年龄鉴定时微耳石所鉴定的最大年龄较其他年龄材料大, 而其他的几种年龄材料均有不同程度的年龄阶段性差异。在鉴定低龄个体时, 微耳石是双须叶须鱼年龄鉴定的最佳材料, 星耳石和脊椎骨次之, 鳃盖骨较差, 鳞片不宜作为年龄鉴定材料; 在鉴定高龄个体时, 微耳石是双须叶须鱼年龄鉴定的最佳材料。
3.2 双须叶须鱼年龄结构与年龄鉴定探讨
杨鑫[6]研究发现雅鲁藏布江中游的双须叶须鱼群体的年龄结构为3—24 龄, 反映出雅鲁藏布江双须叶须鱼群体年龄结构趋于简单。Li等[7]研究了雅鲁藏布江及其支流的双须叶须鱼, 其种群的年龄结构分别为2—44 龄, 与本文研究结果类似, 反映出双须叶须鱼在雅鲁藏布江中游流域年龄趋向低龄化, 而双须叶须鱼在拉萨河流域的年龄结构群体尚未受到严重干扰。究其原因, 采样点环境和人为干扰强度等差异是导致种群结构产生差异的主要因素[6]。而且在3—6月, 双须叶须鱼正处于繁殖期, 加之浮游生物在此季节繁殖生长, 易捕捞较大个体。
在不同水域中双须叶须鱼[6]2种年龄材料的比较显示, 脊椎骨与耳石鉴定的结果无显著性差异, 耳石鉴定10 龄以上的年龄大于脊椎骨鉴定的年龄。而本文研究仅是在鉴定低龄个体(小于23龄)时, 微耳石、星耳石和脊椎骨作为年龄材料是可行的。分析其原因, 可能是由于不同水域资源现状的差异和人为干扰的程度不同所致。交叉水域中双须叶须鱼3种耳石年龄材料的比较显示, 核心模棱两可的星耳石导致难以辨别年龄, 矢耳石易脆并经常破裂[7], 所以微耳石是双须叶须鱼的最佳年龄鉴定材料。
总而言之, 无论是不同水域或者交叉水域, 微耳石一直是双须叶须鱼最好的年龄鉴定材料, 这与杨鑫[6]、Li等[7]的研究结果一致。
-
表 1 带鱼单倍型16S rRNA基因序列片段及变异位点分布
Table 1 Variable sites of 16S rRNA gene sequence from different haplotypes of T. lepturus
核苷酸多态位点
Site1 1 2 2 2 3 3 3 单倍型数分布
Distribution of haplotypes6 7 3 4 5 2 2 2 9 0 2 1 6 0 6 9 A B C Hap1 T C T G C T C T 14 27 15 Hap2 . . . . . . . C 1 0 0 Hap3 . . . A . . . . 1 0 0 Hap4 C . . . . . . . 1 3 2 Hap5 . . . . T A . . 1 2 2 Hap6 . . . . . . T . 1 0 0 Hap7 . T . . . . . . 0 1 0 Hap8 . . C . . . . . 0 1 0 表 2 带鱼单倍型COⅠ基因序列片段及变异位点分布
Table 2 Variable sites of COⅠ gene sequence from different haplotypes of T. lepturus

表 3 带鱼不同群体内线粒体DNA单倍型多样度
Table 3 Haplotype diversity (H) of mtDNA in three populations of T. lepturus
遗传多样性参数
Diversity parameterA B C 单倍型数
Number of haplotypes (H)17/6/18 25/5/28 15/3/17 单倍型多样性
Haplotype diversity (Hd)0.9983/0.4678/0.9992 0.9768/0.3672/0.9814 0.9766/0.3743/0.9809 平均核苷酸差异数
Average number of nucleotide differences (K)7.111/0.632/9.014 5.111/0.512/6.732 5.766/0.596/7.021 核苷酸多样性指数
Nucleotide diversity (Pi)0.0063/0.0011/0.0076 0.0045/0.0009/0.0058 0.0051/0.0011/0.0066 注: 表格中数字分别为COⅠ参数, 16S参数和16S+COⅠ参数; 下同Note: The numbers are COⅠ parameter, 16S parameter and combined 16S and COⅠ parameter in the table; the same applies below 表 4 带鱼群体间和群体内平均遗传距离
Table 4 Genetic distances among and within populations of T. lepturus
群体
PopulationsA B 群体内
IntraspecificA 0.0063/0.0011/
0.0079B 0.0058/0.0010/
0.00720.0046/0.0009/
0.0060C 0.0061/0.0011/
0.00840.0048/0.0010/
0.00570.0051/0.0011/
0.7012表 5 带鱼群体遗传分化系数Gst (上三角)与固定系数Fst (下三角)
Table 5 Gst values (above the diagonal) and Fst values (below the diagonal) among populations of T. lepturus
群体
PopulationA B C A 0.00471/–0.01032 0.00188/–0.01672 B 0.06544/–0.02283 –0.00787/–0.01494 C 0.05361/–0.02623 –0.00750/–0.03144 注: 斜线左侧为COⅠ参数, 右侧为16S rRNA参数Note: left slash for COⅠ parameter, right slash for 16S rRNA parameter 表 6 海洋鱼类COⅠ基因遗传多样性
Table 6 The genetic diversity of marine fish in COⅠ gene
种类
Species基因区域
Gene region单倍型多样性
Haplotype diversity核苷酸多样性
Necleotide diversity参考文献
Reference大黄鱼
Larimichthys croceaCOⅠ 0.915 0.00412 陈淑吟等[26] 小黄鱼
L. polyactisCOⅠ 0.912±0.020 0.00430±0.00032 王肇霖[27] 日本黄姑鱼
Nibea japonicaCOⅠ 0.642 0.003 Chai等[28] 鮸状黄姑鱼
N. miichthioidesCOⅠ 0.584 0.002 Chai等[28] 鲳鱼
Pampus argenteusCOⅠ 0.571 0.004 彭士明等[29] 四指马鲅属
EleutheronomaCOⅠ 0.6486±0.1023 0.000407±0.001673 邓春兴[30] 蓝点马鲛
Scomberomorus niphoniusCOⅠ 0.792±0.089 0.0027±0.0027 曹艳等[31] 东海带鱼
Trichiurus lepturusCOⅠ 0.97692 0.00528 本实验研究 -
[1] Byrne M, Rowe F, Uthicke S. Molecular taxonomy, phylogeny and evolution in the family Stichopodidae (Aspidochirotida: Holothuroidea) based on COⅠ and 16S mitochondrial DNA [J]. Molecular Phylogenetics and Evolution, 2010, 56(3): 1061—1081
[2] Yuan T, He M X, Huang L M. Intraspecific genetic variation in mitochondrial 16S rRNA and COⅠ genes in domestic and wild populations of Huaguizhikong scallop Chlamys nobilis Reeve [J]. Aquaculture, 2009, 289(1-2): 19—25
[3] 辛俭, 张玉荣, 徐冬冬, 等. 基于线粒体16S rRNA和COⅠ基因探讨中国近海黄姑鱼类的分子系统进化关系. 海洋与湖沼, 2014, 45(2): 307—313 Xin J, Zhang Y R, Xu D D, et al. Molecular phylogenety of species Nibea in 16S rRNA and cytochrome oxidase submit Ⅰ mitochondrial genes [J]. Oceanologia et Limnologia Sinica, 2014, 45(2): 307—313
[4] 张铛妮, 郑连明, 何劲儒, 等. 基于线粒体COⅠ和16S片段序列的北部湾北部水螅水母DNA条形码分析. 生物多样性, 2015, 23(1): 50—60 Zhang D N, Zheng L M, He J R, et al. DNA barcoding of hydromedusae in northern Beibu Gulf for species identification [J]. Biodiversity Science, 2015, 23(1): 50—60
[5] Sung Y H, Hu P, Wang J, et al. A new species of Amolops (Anura: Ranidae) from southern China [J]. Zootaxa, 2016, 4170(3): 525—538
[6] Satoh T P, Miya M, Mabuchi K, et al. Structure and variation of the mitochondrial genome of fishes [J]. BMC Genomics, 2016, 17(1): 719
[7] 翁朝红, 谢仰杰, 肖志群, 等. 线粒体COⅠ和16S rRNA片段确定近江蛏和缢蛏属的分类地位. 水生生物学报, 2013, 37(4): 684—690 Weng Z H, Xie Y J, Xiao Z Q, et al. Molecular identification of the taxonomic status of Sinonovacula rivularis and genus Sinonovacula using mitochondrial COⅠ and 16S rRNA fragments [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 684—690
[8] 赵洪强. 东海带鱼食性研究. 舟山: 浙江海洋大学. 2014 Zhao H Q. Studies on the feeding habits of Trichiurus lepturus in East China Sea [D]. Zhoushan: Zhejiang Ocean University. 2014
[9] 张魁, 陈作志. 应用贝叶斯状态空间建模对东海带鱼的资源评估. 中国水产科学, 2015, 22(5): 1015—1026 Zhang K, Chen Z Z. Using Bayesian state-space model to assess Trichiurus japonicus stock in the East China Sea [J]. Journal of Fishery Sciences of China, 2015, 22(5): 1015—1026
[10] 柴学军, 朱云海, 王跃斌, 等. 东海带鱼的胚胎发育研究. 浙江海洋学院学报(自然科学版), 2015, 34(5): 429—432 Chai X J, Zhu Y H, Wang Y B, et al. Study on the Embryonic development of Trichiurus lepturus in the East China Sea [J]. Journal of Zhejiang Ocean University(
Natural Science ) , 2015, 34(5): 429—432 [11] 王垚, 徐汉祥. 伏季休渔制度下东海区带鱼资源动态分析. 浙江海洋学院学报(自然科学版), 2009, 28(4): 384—388 Wang Y, Xu H X. Dymamic analysis on Trichiurus japonicus resources in summer closed fishing system in East China Sea [J]. Journal of Zhejiang Ocean University(
Natural Science ) , 2009, 28(4): 384—388 [12] 郑文娟, 杜一超, 林洁, 等. 基于线粒体DNA D-loop区部分序列分析舟山海域带鱼种群遗传结构. 水生生物学报, 2015, 39(2): 408—423 Zheng W J, Du Y C, Lin J, et al. Genetic diversity analysis of Trichiurus lepturus in Zhoushan based on mitochondrial and D-loop region partial sequences [J]. Acta Hydrobiologica Sninca, 2015, 39(2): 408—423
[13] Liu Y, Cui Z. The complete mitochondrial genome sequence of the cutlassfish Trichiurus japonicas (Perciformes: Trichiuridae): genome characterization and phylogenetic considerations [J]. Marine Genomics, 2009, 2(2): 133—142
[14] Rychlik W. OLIGO 7 primer analysis software [J]. Methods in Molecular Biology, 2007, 402: 35—60
[15] Kessing B, Croom H, Martin A, et al. The simple fool’s guide to PCR [M]. Department of Zoology, University of Hawaii, Honolulu. 1989, 1−23
[16] Clark M J, Chen R, Lam H Y, et al. Performance comparison of exome DNA sequencing technologies [J]. Nature Biotechnology, 2011, 29(10): 908—914
[17] Hall T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for windows 95/98/NT [J]. Nucleic Acids Symposium Series, 1999, 41: 95—98
[18] Librado P, Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data [J]. Bioinformatics, 2009, 25(11): 1451—1452
[19] Tajima F. The effect of change in population size on DNA polymorphism [J]. Genetics, 1989, 123(3): 597—601
[20] Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Molecular Biology Evolution, 2011, 28(10): 2731—2739
[21] Liu X, Guo Y, Wang Z, et al. The complete mitochondrial genome sequence of Trichiurus nanhaiensis (Perciformes: Trichiuridae) [J]. Mitochondrial DNA, 2013, 24(5): 516—517
[22] 蒙子宁. 中国近海小黄鱼、带鱼和小带鱼的遗传多样性以及八种石首鱼类的分子系统进化. 厦门大学, 厦门. 2003 Meng Z N. The genetic diversity in Pseudosciaena polyactis, Trichiurus lepturus, Eupleurogrammus muticus and the molecular phylogeny of eight Sciaenoid species in the neritic waters of China [D]. Xiamen: Xiamen University. 2003
[23] 李鹏飞, 朱文斌, 贺舟挺, 等. 东海带鱼DNA条形码的建立及COⅠ序列变异分析. 浙江海洋学院学报(自然科学版), 2013, 32(1): 6—9 Li P F, Zhu W B, He Z T, et al. DNA barcoding construction and genetic diversity revealed by mtDNA COⅠ of Trichiurus lepturus in the East China sea [J]. Journal of Zhejiang Ocean University(
Natural Science ) , 2013, 32(1): 6—9 [24] 肖永双. 西北太平洋五种海洋鱼类的分子系统地理学研究. 中国海洋大学, 青岛. 2011 Xiao Y S. Molecular Phylogeography of Six Marine Fishes in the Northwestern Pacific [D]. Ocean University of China, Qingdao. 2011
[25] Teletchea F. Molecular indentification methods of fish species: reassessment and possible applications [J]. Reviews in Fish Biology and Fisheries, 2009, 19(3): 265—293
[26] 陈淑吟, 徐士霞, 张志勇, 等. 大黄鱼野生群体与养殖群体遗传多样性研究. 海洋科学, 2011, 35(12): 82—87 Chen S Y, Xu S X, Zhang Z Y, et al. Study of genetic diversity of wild and culture populations of Pseudosciaena crocea using two molecular markers [J]. Marine Sciences, 2011, 35(12): 82—87
[27] 王肇霖. 不同地理群体小黄鱼形态和种质资源差异研究. 浙江海洋大学,舟山. 2016 Wang Z L. Study on the morphology and germplasm resource divergence of different geographical groups of small yellow croaker [D]. Zhejiang Ocean University. Zhoushan. 2016
[28] Chai X J, Hu Z H, Wang Y B, et al. Genetic diversity and the relationship of Nibea japonica and Nibea miichthiodies using mitochondrial DNA gene [J]. Biochemical Systematics and Ecology, 2013, 48(2): 274—280
[29] 彭士明, 施兆鸿, 侯俊利. 基于线粒体D-loop区与COⅠ基因序列比较分析养殖与野生银鲳群体遗传多样性. 水产学报, 2010, 34(1): 19—25 Peng S M, Shi Z H, Hou J L. Comparative analysis on the genetic diversity of cultured and wild silver pomfret populations based on mtD-loop and COⅠ gene [J]. Journal of Fisheries of China, 2010, 34(1): 19—25
[30] 邓春兴. 基于COⅠ基因序列的中国东南沿海四指马鲅属鱼类的遗传多样性分析. 暨南大学,广州. 2014 Deng C X. Genetic diversity of Eleutheronema on the East and South China Seas based on mitochondrial COⅠ gene sequences analysis [D]. Jinan University. Guangzhou. 2014
[31] 曹艳, 章群, 宫亚运, 等. 基于线粒体COⅠ序列的中国沿海蓝点马鲛遗传多样性. 海洋渔业, 2015, 37(6): 485—493 Cao Y, Zhang Q, Gong Y Y, et al. Genetic variation of Scomberomorus niphonius in the coastal waters of China based on mtDNA COⅠ sequences [J]. Marine Fisheries, 2015, 37(6): 485—493
[32] Grant W S, Bowen B W. Shallow population histories in deep evolutionary lineages of marine fishes: insights from sardines and anchovies and lessons for conservation [J]. Journal of Heredity, 1998, 89(5): 415—426
[33] Shaklee J B, Tamaru C S, Waples R S. Speciation and evolution of marine fishes studied by the eletrophoretic analysis of protein [J]. Pacific Science, 1982, 36(2): 141—157
[34] 徐兆礼, 陈佳杰. 东、黄渤海带鱼的洄游路线. 水产学报, 2015, 39(6): 824—835 Xu Z L, Chen J J. Migratory routes of Trichiurus lepturus in the East China Sea, Yellow Sea and Bohai Sea [J]. Journal of Fisheries of China, 2015, 39(6): 824—835
[35] 李城华. 东海带鱼的生物学Ⅰ.卵巢周年变化的初步研究. 海洋与湖沼, 1982, 13(5): 461—472 Li C H. Annual ovarian changes of Trichiurus haumela in the East China Sea [J]. Oceanologia et Limnologia Sinica, 1982, 13(5): 461—472
[36] 浙江省海洋水产研究所资源室. 2015年上半年浙江海洋渔业资源动态评析. http://www.zjhys.cn/news/hydt/20159/1111331020951901.html, 2015-09-11/2016-08-15 Resource room of Zhejiang Marine Fisheries Research Institute. The dynamic analysis of marine fishery resources in Zhejiang in the first half of 2015[DB/OL]. http://www.zjhys.cn/news/hydt/20159/1111331020951901.html, 2015-09-11/2016-08-15
-
期刊类型引用(2)
1. 陈家琪,董丽,麻晓梅,田凯,白洁,赵彦伟. 基于eDNA技术的白洋淀微型生物群落监测. 农业环境科学学报. 2021(08): 1773-1786+1839 .  百度学术
百度学术
2. 姚新民,陈云,沈燕,李禹昕,龚美萍,金凤,邵未艾,刁永卿,师乐,胡洁兰. 2013—2019年上海市青浦区出厂水水质状况及趋势分析. 职业与健康. 2021(21): 2976-2978+2982 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: