CADMIUM EXPOSURE INDUCES HISTOLOGICAL DAMAGE, OXIDATIVE STRESS AND IMMUNE RESPONSE IN YELLOW CATFISH
-
摘要: 为研究水体镉(Cd)暴露对黄颡鱼(Pelteobagrus fulvidraco)鳃的组织学结构、抗氧化状态及免疫相关基因表达的影响, 将黄颡鱼分别暴露于0(对照组)、50和200 μg/L Cd水体中8周后, 取鳃进行分析。结果显示: 鳃中Cd含量随着水体Cd浓度的升高而上升; 组织学分析发现, Cd暴露组鳃出现了动脉瘤、细胞增生、鳃小片弯曲以及细胞脱落等病理变化。同时, Cd暴露导致鳃中谷胱甘肽-S-转移酶(GST)、谷胱甘肽过氧化物酶(GPx)和抗羟自由基(AHR)的活性及过氧化氢(H2O2)的含量升高, 而过氧化氢酶(CAT)的活性及还原型谷胱甘肽(GSH)的含量下降, 但超氧化物歧化酶(SOD)的活性无显著变化。此外, Cd暴露上调了肿瘤坏死因子-α(tnf-α)、主要组织相容性复合体(mhc)、白细胞介素-10(il-10)、转化生长因子-β(tgf-β)和补体因子C3(c3)的表达, 而下调了白细胞介素-1β(il-1β)、白细胞介素-8(il-8)及溶菌酶(lys)的转录水平。研究表明, Cd暴露导致黄颡鱼鳃中Cd富集, 进而诱导鳃的组织学损伤、氧化应激和免疫反应。Abstract: To investigate the effect of different Cd (0 (control), 50, and 200 μg/L Cd2+) on Yellow catfish (Pelteobagrus fulvidraco), fish were exposed for 8 weeks before analyzing the histological structure, antioxidant status and immune-related gene expression in gills. The results showed that Cd2+ exposure induced significant Cd accumulation and histological changes in gill, such as aneurism, hyperplasia, curling of lamella and cell desquamation. Meanwhile, Cd2+ increased the activity of glutathione-S-transferase (GST), glutathione peroxidase (GPx) and anti-hydroxyl radical (AHR) as well as the content of hydrogen peroxide (H2O2), and it decreased catalase (CAT) activity and glutathione (GSH) content. However, Cd2+ had no significant effect on superoxide dismutase (SOD) activity. In addition, Cd exposure up-regulated tumor necrosis factor-a (tnf-a), major histocompatibility complex (mhc), interleukin-10 (il-10), transforming growth factor-β (tgf-β) and complement factor C3 (c3) expressions, but down-regulated interleukin-1β (il-1β), interleukin-8 (il-8) and lysozyme (lys) transcription levels. These results showed that Cd exposure resulted in the accumulation of Cd, and induced histological damage, oxidative stress and immune response of gill in yellow catfish.
-
Keywords:
- Cd exposure /
- Gill /
- Yellow catfish /
- Oxidative stress /
- Immune response
-
镉(Cd)是一种非必需、难降解的重金属元素, 由于其具有良好的稳定性和防腐性, 一直以来被广泛应用于电池、油漆及染料等工业生产[1]。自20世纪50年代日本居民因食用“镉米”而引发“痛痛病”事件以来, Cd污染对人体健康的危害逐渐受到全世界的关注。水环境Cd污染主要来自含Cd废水的直接排放, 以及金属开采、冶炼等导致Cd在环境介质中积累, 并经雨水淋溶后进入水体[2]。通常, 自然水体中Cd浓度低于500 ng/L[3], 但我国部分污染水域Cd浓度远超过该值, 例如: 武汉东湖Cd浓度达8 μg/L[4], 山东省招远市玲珑金矿区Cd浓度高达194.5 μg/L[5]。鱼类长期暴露于Cd污染的水体中, 可导致体内Cd蓄积, 引起应激反应, 导致渗透压失衡[6]。胚胎暴露于Cd中会导致孵化率减少, 仔鱼Cd暴露会诱导畸形甚至死亡[7]。此外, Cd还能影响鱼体的能量代谢, 改变运动行为, 干扰内分泌系统[6, 8], 威胁鱼类的生存和生长, 并通过食物链危害人体健康。
鳃不仅是鱼类最主要的呼吸器官, 也是渗透压调节、酸碱平衡以及含氮废物排出的重要部位[9, 10]。因而, 维持鳃的正常结构和功能对于鱼类的代谢活动十分重要。然而, 鱼鳃直接暴露于水体中, 是有毒物质攻击的主要靶器官, 对水环境污染物尤为敏感, 其结构和功能的改变可反映水环境的变化, 因此可作为环境污染的指示器官[9, 11, 12]。截至目前, 国内外已有一些关于水体Cd暴露影响鱼类鳃的结构及功能的研究报道[13, 14], 但这些研究大多关注Cd对鱼类的急性毒性效应, 而环境剂量Cd暴露下鱼类鳃的组织学改变及抗氧化反应的研究相对缺乏。此外, 关于Cd暴露诱导鳃的免疫调节的研究未见报道。
黄颡鱼(Pelteobagrus fulvidraco)俗称黄腊丁, 是一种底栖小型杂食性鱼类, 为我国重要的名优养殖品种之一[15]。本研究以黄颡鱼为对象, 将其暴露于50和200 μg/L Cd2+水体8周后, 分析鳃的组织学结构、抗氧化状态以及免疫相关基因的表达水平, 旨在揭示Cd对鱼类的毒理效应及毒理机制, 为水体重金属污染风险评价提供理论依据。
1. 材料与方法
1.1 主要试剂
氯化镉(CdCl2)为分析纯, 硝酸为优级纯, 均购自国药集团化学试剂有限公司; 抗氧化指标分析试剂盒购自南京建成生物工程研究所; RNA提取、逆转录及荧光定量试剂盒购自TaKaRa公司。
1.2 实验设计
黄颡鱼购自重庆当地养殖场, 将其转移至室内养殖系统中进行为期2周的暂养。在实验开始时, 选取180尾规格一致的健康鱼(平均体重为6.26 g)随机放入9个盛有200 L水的养殖缸中, 每缸20尾。然后, 向缸中加入已配好的CdCl2母液(对照组不加), 使之分别暴露在Cd2+浓度理论值为0 (对照组)、50 μg/L(低剂量组)和200 μg/L(高剂量组)的水体中, 每个浓度设置3个平行缸。不同实验组对应的实测值分别为(0.23±0.09)、(55.22±3.10)和(184.58± 7.66) μg/L。在养殖期间, 每天投喂商业饲料2次(10:00和16:00), 投喂率为鱼体重的4%。此外, 为保持水质良好, 每天换水50%, 并补充相应的Cd2+。水质参数为: 水温(25.1±0.8)℃, pH 7.6±0.1, 溶氧(16.4±0.2) mg/L。光暗比为14h﹕10h, 暴露时间为8周。
在暴露结束后, 黄颡鱼经MS-222麻醉后, 置于冰面上解剖获取鳃组织, 经PBS冲洗后分成3份: 一份浸入波恩氏液中固定, 用于组织学观察; 另一份经液氮速冻后储存在–80℃用于抗氧化指标和基因表达分析; 其余部分保存在–80℃用于Cd含量测定。
1.3 Cd含量测定
使用石墨炉原子吸收分光光度法检测鳃中Cd含量。首先, 将样品置于80℃烘箱中烘干至恒重后, 称取约0.5 g样品, 加入10 mL浓硝酸, 置于消解罐中消解至冒白烟(消化液呈无色透明)。然后, 将消解液转移至容量瓶中定容, 并稀释至适宜浓度, 用石墨炉原子吸收分光光度计(岛津AA-6880)测定Cd含量。
1.4 组织学分析
鳃组织用波恩氏液固定24h后, 放入梯度乙醇中脱水。经二甲苯透明后, 放入石蜡中包埋。将包埋材料进行常规切片, 切片厚度为5 μm。采用苏木精-伊红(HE)染色, 中性树胶封片后拍照观察。
1.5 抗氧化指标分析
使用南京建成生物工程研究所的试剂盒测定以下抗氧化指标: 还原型谷胱甘肽(GSH)和过氧化氢(H2O2)的含量以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽-S-转移酶(GST)、抗羟自由基(AHR)的活性。测定时, 取鳃组织约0.5 g, 按1﹕10 (w/v)加入预冷的生理盐水, 在冰上充分匀浆。然后, 将匀浆液转移至离心管中, 于4℃ 3000×g离心15min, 取上清液立即用于分析。分析方法严格按照试剂盒说明书进行。上清液的蛋白浓度以牛血清蛋白(BSA)为标准品, 采用考马斯亮蓝法测定。
1.6 基因表达分析
使用RNAiso Plus提取鳃组织总RNA。总RNA的质量和浓度分别用1%琼脂糖凝胶电泳和微量分光光度计(Nanodrop ND-2000)检测。然后, 取1 μg总RNA, 用PrimeScript RT reagent Kit试剂盒合成第一链cDNA。
采用CFX96实时定量PCR仪(Bio-Rad)检测基因的表达水平。10 μL反应体系为: SYBR Premix Ex TaqTM 5 μL, 上下游引物各0.4 μL (10 μmol/L), cDNA 1 μL, 无RNA酶水3.2 μL。反应程序为: 95℃ 30s, 95℃ 5s、60℃ 30s、72℃ 30s (40个循环), 并添加熔解曲线(60℃至95℃, 每升高0.5℃检测一次荧光信号值)。基因的相对表达量用2−ΔΔCt计算, 内参基因为18S rRNA。引物序列见表 1。
表 1 qPCR引物Table 1. Primers used for qPCR引物
Primer序列
Sequence (5′—3′)产物大小
Product size (bp)序列号
Accession numberil-1β ATTACTCTGAAAGGTGGAAATGAAG 68 SRX1838469 TTTGGTGGGTTGTAGGCTGA il-8 ACTGACTGCGATGCTTTGTG 131 SRX1838469 AGGAGCCACTTGGAGGGAATA tnf-α ATCAGGTGAACGCTGATGCT 98 XM-017463815.1 GTGTTGAGGGAAGGGGTCTG mhc AAAGCCCAGGCGGAAAC 138 SRX1838469 GCACATCAACATGGCAGGA il-10 CTCCTCCCCCTGAGGATTCA 227 XM-017450800.1 CGGATCACGGCGTATGAAGA tgf-β ATCTTCTCGCTGTCCACTTGC 235 SRX1838469 CGGTCTCGGTGTTGTCCTG lys GGAGCACATCAGACAAGGCA 126 KP210248.1 CCTACTCCGGCATTGTAGGC c3 GGCAGAGCAGTCCTTATGGG 132 GU353333.1 CACTCACGCTCACTTCCACA 18s rRNA CGGTGGTCTTCTTCCACTCTG 179 GQ376028.1 TCAGCGGGTCGTCTCGTC 1.7 数据处理
试验数据以平均值±标准差(Mean±SD)表示, 采用SPSS 17.0统计软件进行单因素方差分析和Tukey多重检验, 当P<0.05时视为差异显著。柱形图用GraphPad Prism 6进行绘制。
2. 结果
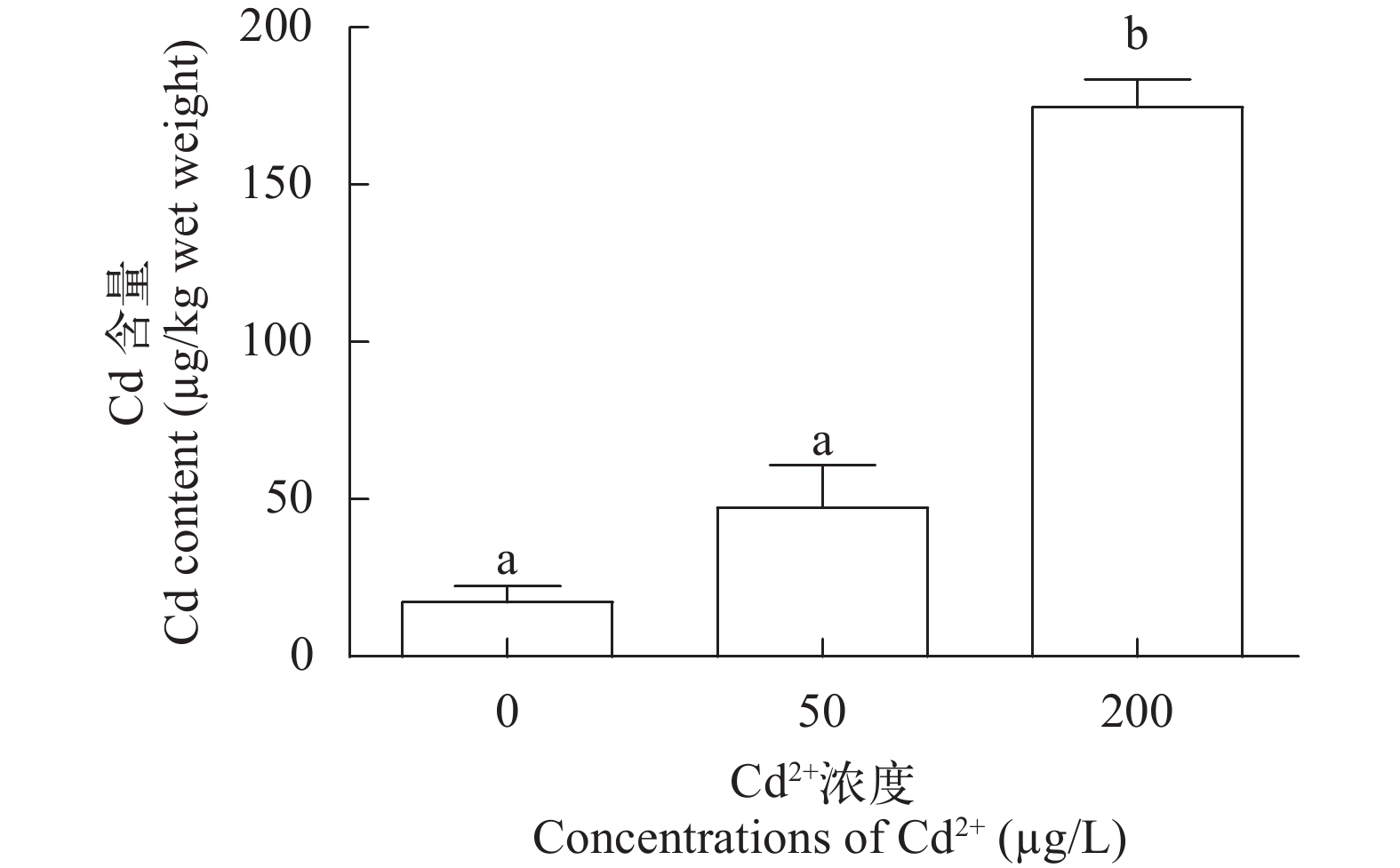
2.1 Cd2+暴露对鳃中Cd含量的影响
如图 1所示, 随着水体Cd2+浓度升高, 鳃中Cd含量逐渐上升, 且高剂量组鳃中Cd含量显著高于对照组(P<0.05)。低剂量组(47.5±13.5) μg/kg和高剂量组(174.6±8.8) μg/kg鳃中Cd含量分别是对照组(17.3±5.0) μg/kg的2.7倍和10.1倍。
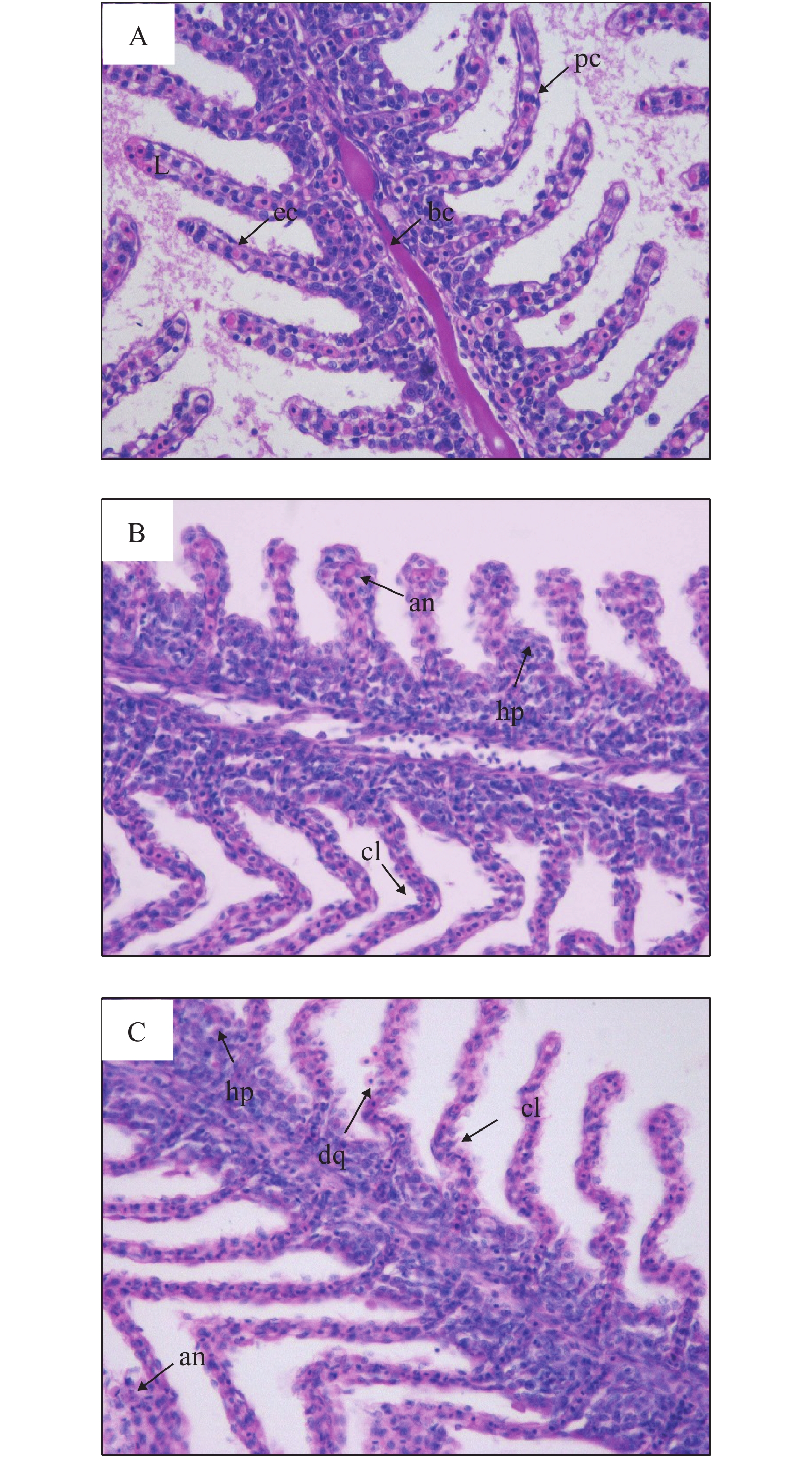
2.2 Cd2+暴露对鳃组织学的影响
如图 2所示, 对照组鳃组织结构正常, 表现为鳃丝结构完整, 外层上皮细胞膜平滑, 毛细血管、柱细胞和上皮细胞形态正常(图 2A)。在低剂量组中, 可见明显的组织学病变, 包括动脉瘤、细胞增生和鳃小片弯曲(图 2B)。在高剂量组中, 不仅有动脉瘤、细胞增生和鳃小片弯曲等病变, 还出现了细胞脱落的现象(图 2C)。
![]() 图 2 Cd2+暴露8周对黄颡鱼鳃组织学的影响(×400)A. 对照组; B. 50 μg/L Cd2+组; C. 200 μg/L Cd2+组。鳃小片(L), 柱细胞(pc), 毛细血管(bc), 上皮细胞(ec), 动脉瘤(an), 细胞增生(hp), 鳃小片弯曲(cl), 细胞脱落(dq)Figure 2. Effects of Cd2+ exposure for 8 weeks on histology of gill of yellow catfish (×400)A. Control; B. 50 μg/L Cd2+; C. 200 μg/L Cd2+. lamellae (L), pillar cell (pc), blood capillary (bc), epithelial cell (ec), aneurism (an), hyperplasia (hp), curling of lamella (cl), cell desquamation (dq)
图 2 Cd2+暴露8周对黄颡鱼鳃组织学的影响(×400)A. 对照组; B. 50 μg/L Cd2+组; C. 200 μg/L Cd2+组。鳃小片(L), 柱细胞(pc), 毛细血管(bc), 上皮细胞(ec), 动脉瘤(an), 细胞增生(hp), 鳃小片弯曲(cl), 细胞脱落(dq)Figure 2. Effects of Cd2+ exposure for 8 weeks on histology of gill of yellow catfish (×400)A. Control; B. 50 μg/L Cd2+; C. 200 μg/L Cd2+. lamellae (L), pillar cell (pc), blood capillary (bc), epithelial cell (ec), aneurism (an), hyperplasia (hp), curling of lamella (cl), cell desquamation (dq)2.3 Cd2+暴露对鳃抗氧化指标的影响
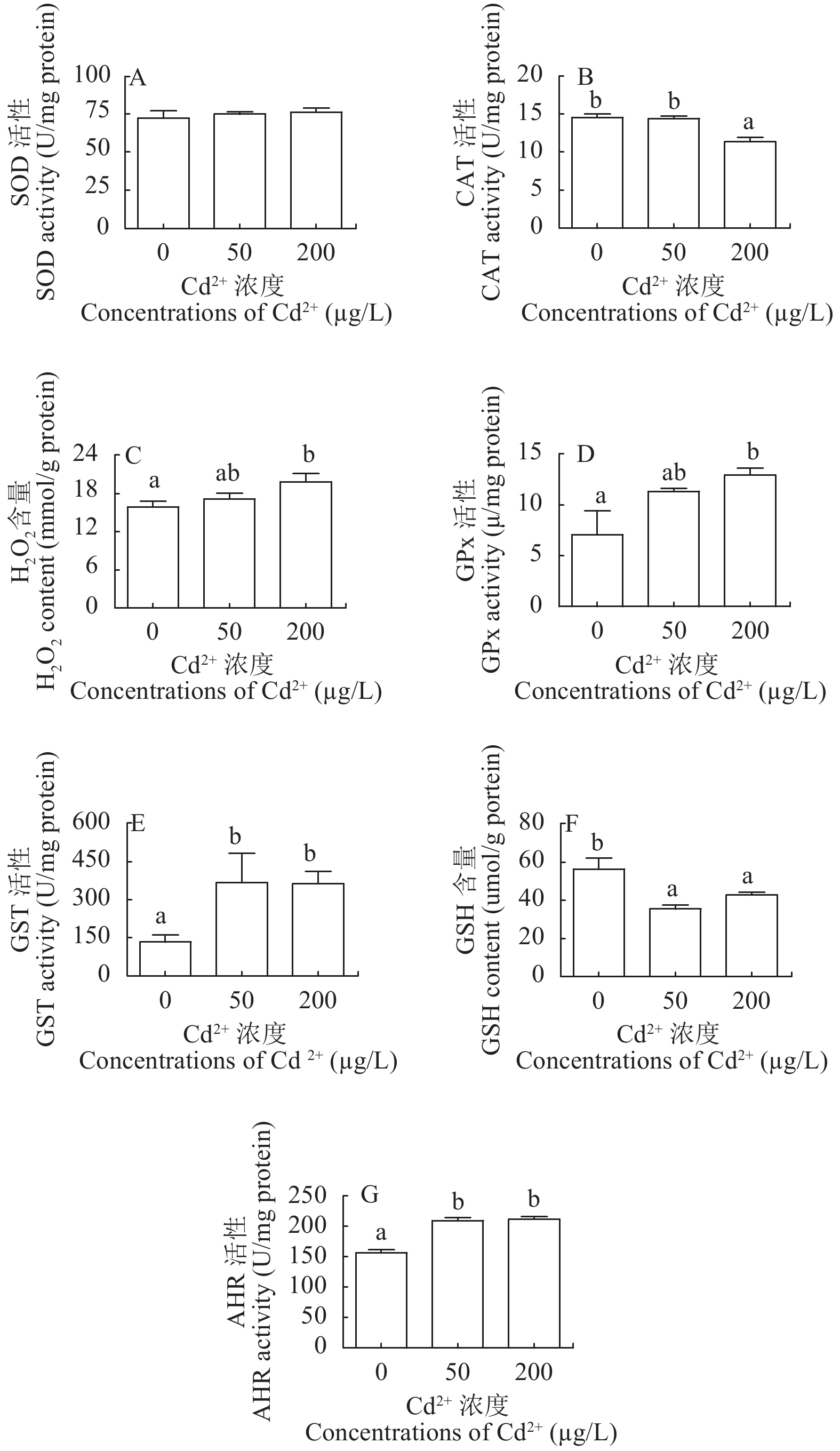
如图 3所示, 随着水体Cd2+浓度的升高, CAT的活性逐渐降低, 而GPx的活性以及H2O2的含量逐渐升高, 且均在高剂量组差异显著(P<0.05)。与对照组相比较, 低剂量组和高剂量组GSH的含量均显著降低, 而GST和AHR的活性显著升高(P<0.05)。此外, Cd暴露对SOD的活性无显著影响(P>0.05)。
2.4 Cd2+暴露对鳃免疫相关基因表达水平的影响
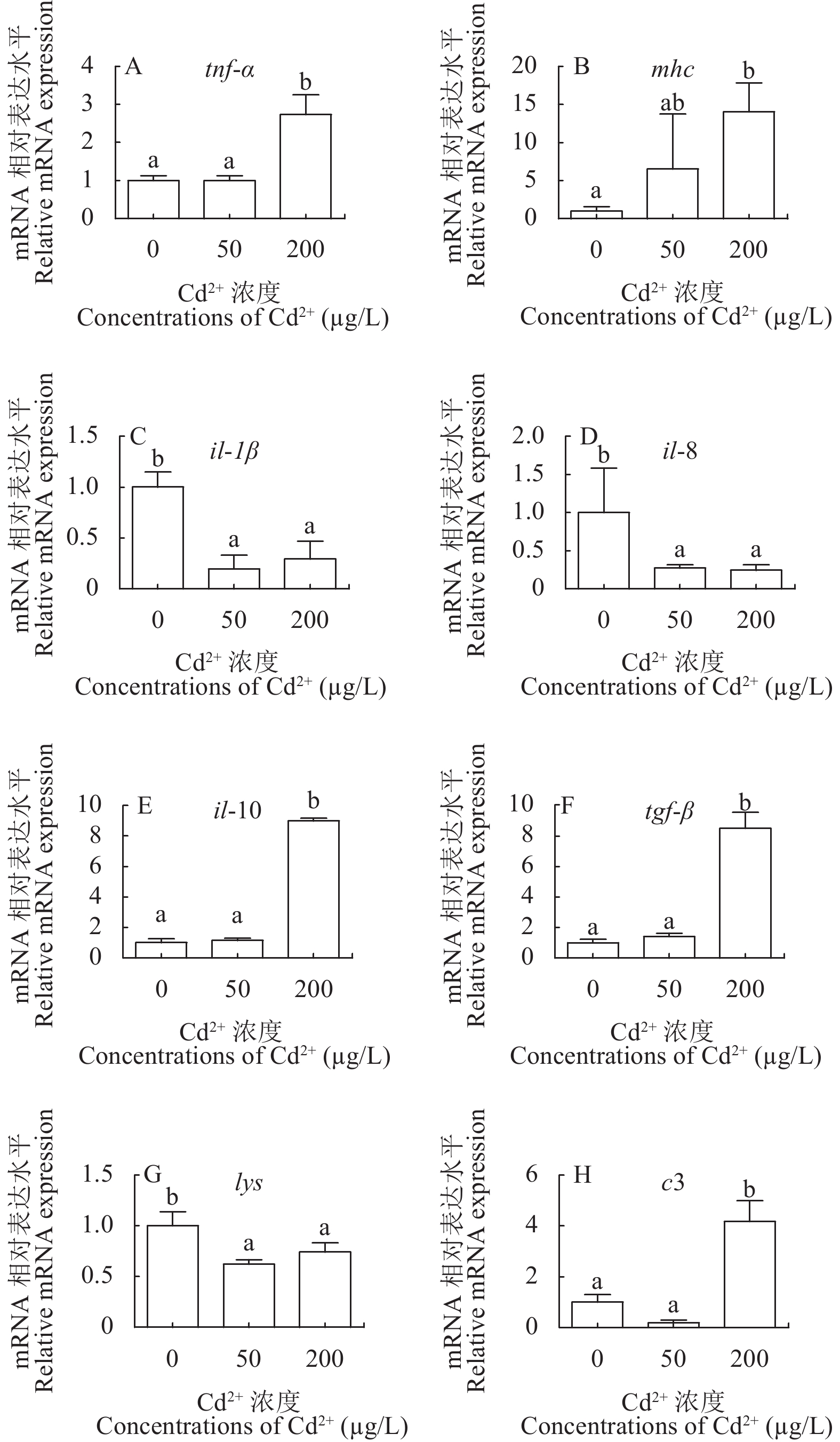
如图 4所示, 与对照组相比较, 肿瘤坏死因子-d (tnf-α)、主要组织相容性复合体(mhc)、白细胞介素-10(il-10)、转化生长因子-β(tgf-β)和补体因子C3(c3)的表达水平在低剂量组无显著变化(P>0.05), 而在高剂量组显著上调(P<0.05)。此外, 在低剂量组和高剂量组中白细胞介素-1β(il-1β)、白细胞介素-8(il-8)及溶菌酶(lys)的mRNA水平均显著高于对照组(P<0.05)。
3. 讨论
3.1 Cd2+暴露对鳃中Cd含量及组织学的影响
在本研究中, 随着水体Cd2+浓度的升高, 鳃中Cd含量上升, 反映了鳃对水中Cd的富集效应, 这与在喀拉鲃(Catla catla)[16]和牙鲆(Paralichthys olivaceus)[17]中的研究结果相符。重金属在水生生物体内的积累通过以下途径实现: 一是鳃不断吸收水中的重金属离子, 然后积累在表面细胞中或通过血液输送到各个部位; 二是通过摄食, 经消化道进入体内; 此外, 体表与水体的渗透交换作用也可能是重金属进入体内的又一个途径[18]。因此, Cd在鳃组织的积累可能是以上3个途径的共同作用, 但鳃直接吸收水中Cd2+可能起主导作用。当重金属在体内蓄积到一定程度时, 会引起组织学病变。鱼鳃组织学是毒理学研究的重要生物指标[19]。在本研究中, Cd暴露损伤了鳃的组织结构, 包括动脉瘤形成、细胞增生、鳃小片弯曲以及细胞脱落等。类似地, Liu等[20]发现, 矛尾复虾虎(Synechogobius hasta)暴露于0.29 mg/L Cd2+水体15d后鳃出现动脉瘤和细胞增生; Thophon等[21]发现, 尖吻鲈(Lates calcarifer)暴露于20.12 mg/L Cd2+水体48h后鳃出现动脉瘤, 而72h和96h鳃出现细胞增生。这些组织学损伤一方面可能会影响鳃的呼吸功能; 但另一方面, 动脉瘤、细胞增生和鳃小片弯曲等组织学改变也是机体的一种防御机制, 即通过这些改变, 可以增加Cd到达血管的距离, 一定程度上阻止Cd进入细胞[22, 23]。
3.2 Cd2+暴露对鳃抗氧化指标的影响
鱼类受到重金属胁迫时, 体内会产生大量活性氧(ROS), 如超氧阴离子(O2–)、羟自由基(·OH)和H2O2等[24]。如果这些ROS不能被及时有效地清除, 将导致体内各种大分子如蛋白质、脂类等受到破坏, 造成氧化损伤, 进而影响鱼体组织和器官的正常生理功能[25, 26]。在抗氧化系统中, SOD-CAT系统是抵抗ROS的第一道防线[27], 其中, SOD将O2–转换成H2O2[28], 而CAT进一步将H2O2转换成水[29]。因此, 如果SOD活性不变, 而CAT活性降低则可能导致H2O2积累。在本研究中, Cd2+暴露对鳃中SOD活性无显著影响, 但显著抑制了CAT的活性, 从而使Cd暴露组中H2O2含量升高。GPx是机体内广泛存在的一种过氧化物分解酶, 可将有毒的H2O2带入无毒的羟基化合物(GSSG)中[30], 防止H2O2对细胞膜结构和功能的干扰和破坏。在本研究中, 高剂量组CAT活性降低的同时, GPx活性升高, 这可能是一种补偿机制, 表明GPx在鳃清除H2O2方面起关键作用。研究表明, 当鱼类受到低浓度Cd胁迫时, SOD、CAT和GPx活性均表现为升高, 而当受到高浓度Cd胁迫时, 这些酶的活性则表现为不同程度的降低, 其剂量-效应关系曲线为抛物线[31]。GSH是机体中重要的抗氧化剂和自由基清除剂。GST是一种生物转化酶, 催化有害物质与GSH的偶联反应, 从而保护细胞免受氧化损伤[31]。在本研究中, Cd2+暴露导致GST的活性显著升高, 而GSH的含量显著降低, 这与Farombi等[32]的研究结果一致。GST活性增强是对鳃中Cd积累的适应性反应, 即鳃通过提升GST活性增加Cd与GSH之间的共轭, 以应对Cd引起的氧化应激[33]。GSH含量的减少表明鳃消耗GSH来清除有毒的代谢废物。·OH是最活泼也是最具危害性的自由基, 其氧化能力极强, 往往难以清除[34]。AHR活性是评估清除·OH能力的重要指标。在本实验中, 低浓度组和高浓度组AHR活性均显著高于对照组, 这进一步证实Cd暴露激活了鳃的抗氧化防御系统。
3.3 Cd2+暴露对鳃免疫相关基因表达水平的影响
鱼类的免疫系统在识别和清除外来抗原、抗感染及维持机体内环境稳定等方面发挥着至关重要的作用[35]。有研究表明, Cd暴露可引起鱼体先天性免疫和特异性免疫[36]。Cd影响先天性免疫功能主要表现在改变鱼体免疫相关酶活性、血液白细胞吞噬能力、补体溶血活性及血细胞呼吸爆发活性等[37, 38]。在特异性免疫方面, Cd暴露可导致鱼体血清总免疫球蛋白M含量显著升高[38]。此外, Cd对淋巴细胞有直接作用, 可抑制T、B细胞增殖和B细胞释放抗体, 也可抑制淋巴细胞DNA合成以及细胞膜上的Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性, 进而影响淋巴细胞的转化[6, 39]。在脊椎动物中, 免疫反应通常以炎症反应为特征[40]。在动物发生炎症时, TNF-α通常最先被释放[41]。TNF-α是促炎症细胞因子, 由免疫细胞释放, 与机体的各种炎症、感染和疾病密切相关[42]。MHC家族编码而成的分子位于细胞表面, 其主要功能是结合由病原体衍生的肽链, 从而在细胞表面显示出该病原体, 以便T细胞识别并执行一系列免疫功能[43]。已有研究表明mhc可被tnf-α调节[44]。在本研究中, Cd暴露上调了鳃中tnf-α和mhc表达水平, 表明Cd暴露诱导了鳃的免疫反应。白细胞介素(IL)是由淋巴细胞、单核细胞等产生的细胞因子, 在免疫调节、造血以及炎症过程中起着调节作用[45]。在本研究中, 与对照组相比, Cd暴露组鳃中il-1β和il-8的转录水平明显下调, 而il-10的表达水平显著上调。促炎细胞因子il-1β和il-8的下调一方面可能是Cd诱导的免疫抑制效应, 另一方面也可能跟抗炎细胞因子il-10表达水平上调有关。TGF-β是抗炎和免疫抑制细胞因子, 参与细胞的生长、分化和免疫功能[46]。因此, 在本研究中tgf-β的上调可能是黄颡鱼免疫系统为修复Cd暴露所导致的鳃损伤的一种平衡机制。溶菌酶(LYS)是鱼类先天性免疫的重要组成部分, 由多种白细胞产生, 包括中性粒细胞和巨噬细胞[47]。已有研究表明, LYS与机体防御机制有关, 如抗病毒、溶菌、免疫应答等[48]。在本研究中, Cd暴露黄颡鱼8周后, 下调了鳃中lys的表达水平, 表明Cd暴露可能抑制了鳃的抗菌能力, 干扰黄颡鱼的先天性免疫系统, 反映了Cd对黄颡鱼的免疫毒性。此外, 补体在鱼类宿主防御方面起着关键作用, 启动后可参与机体靶细胞溶解[49]。在补体系统中, 补体因子C3是主要成分, 其在免疫防御、免疫调节和免疫病理中起着重要作用[49]。在本研究中, 高剂量组c3的表达水平显著上调, 表明补体系统被激活以抵御Cd暴露诱导的鳃损伤。
综上所述, 本研究表明, 黄颡鱼暴露于50和200 μg/L Cd2+的水体8周后, 其鳃中Cd积累, 并诱导鳃的组织学损伤、氧化应激和免疫反应。同时, 抗氧化系统和免疫系统在Cd诱导的鳃损伤中发挥了重要的保护作用。
-
图 2 Cd2+暴露8周对黄颡鱼鳃组织学的影响(×400)
A. 对照组; B. 50 μg/L Cd2+组; C. 200 μg/L Cd2+组。鳃小片(L), 柱细胞(pc), 毛细血管(bc), 上皮细胞(ec), 动脉瘤(an), 细胞增生(hp), 鳃小片弯曲(cl), 细胞脱落(dq)
Figure 2. Effects of Cd2+ exposure for 8 weeks on histology of gill of yellow catfish (×400)
A. Control; B. 50 μg/L Cd2+; C. 200 μg/L Cd2+. lamellae (L), pillar cell (pc), blood capillary (bc), epithelial cell (ec), aneurism (an), hyperplasia (hp), curling of lamella (cl), cell desquamation (dq)
表 1 qPCR引物
Table 1 Primers used for qPCR
引物
Primer序列
Sequence (5′—3′)产物大小
Product size (bp)序列号
Accession numberil-1β ATTACTCTGAAAGGTGGAAATGAAG 68 SRX1838469 TTTGGTGGGTTGTAGGCTGA il-8 ACTGACTGCGATGCTTTGTG 131 SRX1838469 AGGAGCCACTTGGAGGGAATA tnf-α ATCAGGTGAACGCTGATGCT 98 XM-017463815.1 GTGTTGAGGGAAGGGGTCTG mhc AAAGCCCAGGCGGAAAC 138 SRX1838469 GCACATCAACATGGCAGGA il-10 CTCCTCCCCCTGAGGATTCA 227 XM-017450800.1 CGGATCACGGCGTATGAAGA tgf-β ATCTTCTCGCTGTCCACTTGC 235 SRX1838469 CGGTCTCGGTGTTGTCCTG lys GGAGCACATCAGACAAGGCA 126 KP210248.1 CCTACTCCGGCATTGTAGGC c3 GGCAGAGCAGTCCTTATGGG 132 GU353333.1 CACTCACGCTCACTTCCACA 18s rRNA CGGTGGTCTTCTTCCACTCTG 179 GQ376028.1 TCAGCGGGTCGTCTCGTC -
[1] 李涌泉, 王兰, 刘娜, 等. 镉对长江华溪蟹酶活性及脂质过氧化的影响. 水生生物学报, 2008, 32(3): 373—379 Li Y Q, Wang L, Liu N, et al. Effects of cadmium on enzyme activity and lipid peroxidation in freshwater crab Sinopotamon yangtsekiense [J]. Acta Hydrobiologica Sinica, 2008, 32(3): 373—379
[2] Das S, Mukherjee D. Effect of cadmium chloride on secretion of 17β-estradiol by the ovarian follicles of common carp, Cyprinus carpio [J]. General and Comparative Endocrinology, 2013, 181(2): 107—114
[3] Jin Y X, Liu Z Z, Liu F, et al. Embryonic exposure to cadmium (Ⅱ) and chromium (Ⅵ) induce behavioral alterations, oxidative stress and immunotoxicity in zebrafish (Danio rerio) [J]. Neurotoxicology and Teratology, 2015, 48: 9—17
[4] He L L, Chen Z H. Monitoring of heavy metal pollution in water environment of wuhan [J]. Environmental Science & Technology, 2007, 30: 40—41
[5] Ning L, Yang L Y, Dai J R, et al. Heavy metal pollution in surface water of linglong gold mining area, China [J]. Procedia Environmental Sciences, 2011, 10(1): 914—917
[6] 柏世军, 许梓荣. 镉对黄颡鱼鳃线粒体结构和能量代谢的影响. 应用生态学报, 2006, 17(7): 1213—1217 Bai S J, Xu Z R. Effects of cadmium on mitochondrial structure and energy metabolism of yellow catfish [J]. Chinese Journal of Applied Ecology, 2006, 17(7): 1213—1217
[7] 刘腾腾, 董晓晓, 苗明升, 等. 日本青鳉(Oryzias latipes)胚胎和卵黄期仔鱼对镉的敏感性. 生态毒理学报, 2012, 7(2): 177—181 Liu T T, Dong X X, Miao M S, et al. Sensitivity of embryo and yolk-sac fry of japanese medaka (Oryzias latipes) to cadmium [J]. Asian Journal of Ecotoxicology, 2012, 7(2): 177—181
[8] 史慧勤, 张利军, 苑晓燕, 等. 氯化镉暴露对斑马鱼幼鱼神经行为毒性作用. 生态毒理学报, 2013, 8(3): 374—380 Shi H Q, Zhang L J, Yuan X Y, et al. Toxic effects of cadmium chloride exposure on neurobehavior of zebrafish larvae [J]. Asian Journal of Ecotoxicology, 2013, 8(3): 374—380
[9] Rubens M M, Edith F. Effects of the organophosphorous methyl parathion on the branchial epithelium of a freshwater fish Metynnis roosevelti [J]. Brazilian Archives of Biology and Technology, 2003, 46(3): 361—372
[10] Perry S F, Shahsavarani A, Georgalis T, et al. Channels, pumps, and exchangers in the gill and kidney of freshwater fishes: their role in ionic and acid-base regulation [J]. Journal of Experimental Zoology Part A Ecological Genetics and Physiology, 2003, 300(1): 53—62
[11] Heuvel M R V D, Power M, Richards J, et al. Disease and gill lesions in yellow perch (Perca flavescens) exposed to oil sands mining-associated waters [J]. Ecotoxicology and Environmental Safety, 2000, 46(3): 334—341
[12] Bernet D, Schmidt H, Meier W, et al. Histopathology in fish: proposal for a protocol to assess aquatic pollution [J]. Journal of Fish Diseases, 1999, 22(1): 25—34
[13] Chen Q L, Gong Y, Luo Z, et al. Differential effect of waterborne cadmium exposure on lipid metabolism in liver and muscle of yellow catfish Pelteobagrus fulvidraco [J]. Aquatic Toxicology, 2013, 142: 380—386
[14] Annabi A, Messaoudi I, Kerkeni A, et al. Cadmium accumulation and histological lesion in mosquitofish (Gambusia affinis) tissues following acute and chronic exposure [J]. International Journal of Environmental Research, 2011, 5(3): 745—756
[15] Luo Z, Li X, Bai H, et al. Effects of dietary fatty acid composition on muscle composition and hepatic fatty acid profile in juvenile Synechogobius hasta [J]. Journal of Applied Ichthyology, 2008, 24(1): 116—119
[16] Sobha K, Poornima A, Harini P, et al. A study on biochemical changes in the fresh water fish, Catla catla (Hamilton) exposed to the heavy metal toxicant cadmium chloride [J]. Kathmandu University Journal of Science Engineering & Technology, 2007, 3(2): 1—11
[17] Kim S G, Jee J H, Kang J C. Cadmium accumulation and elimination in tissues of juvenile olive flounder, Paralichthys olivaceus after sub-chronic cadmium exposure [J]. Environmental Pollution, 2004, 127(1): 117—123
[18] 刘长发, 陶澍, 龙爱民. 金鱼对铅和镉的吸收蓄积. 水生生物学报, 2001, 25(4): 344—349 Liu C F, Tao S, Long A M. Accumulations of lead and cadmium in goldfish Carassius auratus [J]. Acta Hydrobiologica Sinica, 2001, 25(4): 344—349
[19] Abdel-Moneim A M, Al-Kahtani M A, Elmenshawy O M. Histopathological biomarkers in gills and liver of Oreochromis niloticus from polluted wetland environments, Saudi Arabia [J]. Chemosphere, 2012, 88(8): 1028—1035
[20] Liu X J, Luo Z, Li C H, et al. Antioxidant responses, hepatic intermediary metabolism, histology and ultrastructure in Synechogobius hasta exposed to waterborne cadmium [J]. Ecotoxicology and Environmental Safety, 2011, 74(5): 1156—1163
[21] Thophon S, Kruatrachue M, Upatham E S, et al. Histopathological alterations of white seabass, Lates calcarifer, in acute and subchronic cadmium exposure [J]. Environmental Pollution, 2003, 121(3): 307—320
[22] Mallatt J. Fish gill structural changes induced by toxicants and other irritants: a statistical review [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1985, 42(4): 630—648
[23] Camargo M M P, Martinez C B R. Histopathology of gills, kidney and liver of a Neotropical fish caged in an urban stream [J]. Neotropical Ichthyology, 2007, 5(3): 327—336
[24] Cao L A, Huang W, Liu J H, et al. Accumulation and oxidative stress biomarkers in Japanese flounder larvae and juveniles under chronic cadmium exposure [J]. Comparative Biochemistry and Physiology Part C Toxicology & Pharmacology, 2010, 151(3): 386—392
[25] López E, Arce C, Oset-Gasque M J, et al. Cadmium induces reactive oxygen species generation and lipid peroxidation in cortical neurons in culture [J]. Free Radical Biology and Medicine, 2006, 40(6): 940—951
[26] Hallare A, Nagel K, Köhler H R, et al. Comparative embryotoxicity and proteotoxicity of three carrier solvents to zebrafish (Danio rerio) embryos [J]. Ecotoxicology and Environmental Safety, 2006, 63(3): 378—388
[27] Monteiro D A, Rantin F T, Kalinin A L. Inorganic mercury exposure: toxicological effects, oxidative stress biomarkers and bioaccumulation in the tropical freshwater fish matrinxã, Brycon amazonicus (Spix and Agassiz, 1829) [J]. Ecotoxicology, 2010, 19(1): 105—123
[28] Mccord J M, Fridovich I. Superoxide dismutase an enzymic function for erythrocuprein (hemocuprein) [J]. Journal of Biological Chemistry, 1969, 244(22): 6049—6055
[29] Thomas J P, Maiorino M, Ursini F, et al. Protective action of phospholipid hydroperoxide glutathione peroxidase against membrane-damaging lipid peroxidation. In situ reduction of phospholipid and cholesterol hydroperoxides [J]. Journal of Biological Chemistry, 1990, 265(1): 454—461
[30] Pandey S, Parvez S, Sayeed I, et al. Biomarkers of oxidative stress: a comparative study of river Yamuna fish Wallago attu (Bl. & Schn.) [J]. Science of the Total Environment, 2003, 309(1-3): 105—115
[31] Basha P S, Rani A U. Cadmium-induced antioxidant defense mechanism in freshwater teleost Oreochromis mossambicus (Tilapia) [J]. Ecotoxicology and Environmental Safety, 2003, 56(2): 218—221
[32] Farombi E O, Adelowo O A, Ajimoko Y R. Biomarkers of oxidative stress and heavy metal levels as indicators of environmental pollution in african cat fish (Clarias gariepinus) from Nigeria Ogun River [J]. International Journal of Environmental Research and Public Health, 2007, 4(2): 158—165
[33] Mohamed S, Kheireddine O, Wyllia H M, et al. Proportioning of biomarkers (GSH, GST, AChE, Catalase) indicator of pollution at Gambusia affinis (Teleostei Fish) exposed to cadmium [J]. Environmental Research Journal, 2008, 2(4): 177—181
[34] Tanzadehpanah H, Asoodeh A, Mahaki H, et al. Bioactive and ACE binding properties of three synthetic peptides assessed by various spectroscopy techniques [J]. Process Biochemistry, 2016, 51(12): 2067—2075
[35] Magnadóttir B. Innate immunity of fish (overview) [J]. Fish & Shellfish Immunology, 2006, 20(2): 137—151
[36] Thuvander A. Cadmium exposure of rainbow trout, Salmo gairdneri Richardson: effects on immune functions [J]. Journal of Fish Biology, 1989, 35(4): 521—529
[37] 汪红军, 李嗣新, 周连凤, 等. 5种重金属暴露对斑马鱼呼吸运动的影响. 农业环境科学学报, 2010, 29(9): 1675—1680 Wang H J, Lin S X, Zhou L F, et al. The effect of exposure to five kinds of heavy metals on respiratory movement of zebra fish (Brachydanio rerio) [J]. Journal of Agro-Environment Science, 2010, 29(9): 1675—1680
[38] Guardiola F A, Cuesta A, Meseguer J, et al. Accumulation, histopathology and immunotoxicological effects of waterborne cadmium on gilthead seabream (Sparus aurata) [J]. Fish & Shellfish Immunology, 2013, 35(3): 792—800
[39] Alkharashi N A O, Periasamy V S, Athinarayanan J, et al. Cadmium triggers mitochondrial oxidative stress in human peripheral blood lymphocytes and monocytes: Analysis using in vitro and system toxicology approaches [J]. Journal of Trace Elements in Medicine and Biology, 2017, 42: 117—128
[40] Zhao J, Liu Y, Jiang J, et al. Effects of dietary isoleucine on the immune response, antioxidant status and gene expression in the head kidney of juvenile Jian carp (Cyprinus carpio var. Jian) [J]. Fish & Shellfish Immunology, 2013, 35(2): 572—580
[41] Secombes C J. Cytokines and innate immunity of fish [J]. Developmental & Comparative Immunology, 2001, 25(8-9): 713—723
[42] Roca F J, Mulero I, López-Muñoz A, et al. Evolution of the inflammatory response in vertebrates: fish TNF-alpha is a powerful activator of endothelial cells but hardly activates phagocytes [J]. Journal of Immunology, 2008, 181(7): 5071—5081
[43] Rammensee H, Bachmann J, Emmerich N P, et al. SYFPEITHI: database for MHC ligands and peptide motifs [J]. Immunogenetics, 1999, 50(4): 213—219
[44] Neumann H, Schmidt H, Cavalié A, et al. Major histocompatibility complex (MHC) class I gene expression in single neurons of the central nervous system: differential regulation by interferon (IFN)-γ and tumor necrosis factor (TNF)-α [J]. Journal of Experimental Medicine, 1997, 185(2): 305—316
[45] Dinarello C A. Immunological and inflammatory functions of the interleukin-1 family [J]. Annual Review of Immunology, 2009, 27(27): 519—550
[46] Tsai T C, Lu J H, Chen S J, et al. Soluble interleukin-10 and transforming growth factor-β in children with acute exacerbation of allergic asthma [J]. Journal of Asthma, 2009, 46(1): 21—24
[47] Pushpa K, Gireeshbabu P, Rajendran K V, et al. Molecular cloning, sequencing and tissue-level expression of complement C3 of Labeo rohita (Hamilton, 1822) [J]. Fish & Shellfish Immunology, 2014, 40(1): 319—330
[48] Ma J G, Feng Y Y, Xie W J, et al. Immune response in common carp (Cyprinus carpio L.) following glyphosate-exposure [J]. Toxin Reviews, 2015, 34(4): 1—6
[49] Peng M X, Niu D H, Wang F, et al. Complement C3 gene: Expression characterization and innate immune response in razor clam Sinonovacula constricta [J]. Fish & Shellfish Immunology, 2016, 55: 223—232
-
期刊类型引用(15)
1. 陈琼汝,高育冉,赵悦,王壬,陈浩铭,石九四,刘羽鸿. 鱼类应激反应的分子机理及防治措施综述. 江苏农业科学. 2024(03): 27-34 .  百度学术
百度学术
2. 类延菊,戴佳,张琴,张运生,杨品红,邵立业. 重金属Pb~(2+)、Cd~(2+)、Cr~(6+)对洞庭青鲫仔鱼急性毒性、细胞凋亡及组织损伤的影响. 湖南文理学院学报(自然科学版). 2024(03): 58-63+71 .  百度学术
百度学术
3. 夏虎,贺欢乐,刘良国,曾好,余嘉,丁成,陈福艳,陈秀荔,雷婷. 镉胁迫对团头鲂免疫系统与抗氧化系统的影响. 水生生物学报. 2024(11): 1801-1811 .  本站查看
本站查看
4. 王炫凯,曲宝成,胡柳林. 水产品重金属污染检测技术及去除方法研究进展. 水产养殖. 2022(01): 37-42 .  百度学术
百度学术
5. 龙萌,王振华,陈浩,胡艳平,朱引,李冠亚. 水环境中镉对鱼类的毒理效应研究进展. 水生态学杂志. 2022(02): 142-150 .  百度学术
百度学术
6. 高金伟,吴浩,李绍明,谢敏,李文祥,宋锐. 氨氮和镉胁迫对芙蓉鲤鲫抗氧化系统和免疫机能的影响. 水生生物学报. 2022(04): 448-456 .  本站查看
本站查看
7. 黄春红,陈蕴,王攀,王荣华. 基于营养与环境因素的鱼类氧化应激研究现状. 饲料研究. 2022(13): 131-136 .  百度学术
百度学术
8. 周俊豪,刘念,杨映. 硬骨鱼类Keap1-Nrf2/ARE信号通路研究进展. 水产学杂志. 2022(04): 117-124 .  百度学术
百度学术
9. 王旭江,么宗利,来琦芳,于明超,李新苍,高鹏程,周凯,崔青曼,刘一萌,孙真,李燕. 长期高碱胁迫下凡纳滨对虾基因表达差异研究. 渔业科学进展. 2022(04): 22-32 .  百度学术
百度学术
10. 牛莹月,罗志平,区又君,蓝军南,温久福,李加儿,周慧. 不同盐度对四指马鲅幼鱼存活及鳃组织形态变化的影响. 南方农业学报. 2021(06): 1719-1726 .  百度学术
百度学术
11. 高珊,常玉梅,赵雪飞,孙博,张立民,梁利群,董志国. 不同NaHCO_3碱度对瓦氏雅罗鱼鳃组织结构的影响. 水生生物学报. 2020(04): 736-743 .  本站查看
本站查看
12. 徐英江,刘欢,彭凯秀,刘鸽,韩典峰,刘永春,王明磊,曹伟,冷男,杨玉芳,宫向红,田秀慧. 水产品中三种常见重金属污染物的毒性及风险评估进展. 现代食品科技. 2020(09): 314-324 .  百度学术
百度学术
13. 牛莹月,区又君,蓝军南,温久福,李加儿,李俊伟,周慧. 人工培育四指马鲅鳃组织结构及其早期发育. 南方水产科学. 2020(05): 108-114 .  百度学术
百度学术
14. 熊大林,段亚飞,徐敬明,詹爱军,陈成勋,张家松. 凡纳滨对虾鳃组织对高温和氨氮胁迫的生理响应. 南方农业学报. 2020(09): 2296-2303 .  百度学术
百度学术
15. 王志芳,肖俊,罗永巨. 水环境镉污染对养殖鱼类的影响研究进展. 广西科学院学报. 2019(03): 166-171 .  百度学术
百度学术
其他类型引用(13)



 下载:
下载: