THE RELATIONSHIP OF SOX9 EXPRESSION AND ITS CPG ISLAND METHYLATION IN CULTER ALBURNUS
-
摘要: 为了揭示翘嘴鲌(Culter alburnus)性别决定与分化的作用机制, 进而更好地发展性别控制育种技术, 研究重点分析了Sox9基因在翘嘴鲌性腺分化过程中的作用。通过RT-PCR和RACE方法获得了翘嘴鲌2个旁系同源基因Sox9a和Sox9b的cDNA序列: Sox9a全长1642 bp, 编码458个氨基酸; Sox9b全长1673 bp, 编码456个氨基酸。序列分析表明两者相似度达到73.95%, 编码HMG盒区域极其保守。蛋白质次级结构预测显示Sox9a和Sox9b除了保守的HMG盒结构域外, 还存在2个核定位信号; 两者的三维结构都存在多个螺旋结构。系统进化树分析发现翘嘴鲌Sox9a与罗非鱼关系最近, 但Sox9b形成单独的一支。利用实时荧光定量PCR技术分析了翘嘴鲌Sox9a和Sox9b基因在各成体组织中的表达水平, 结果显示Sox9a在脑和精巢中表达量最高, 其次是肌肉、鳍条、眼睛和卵巢, 在肾脏、脾脏、肝脏中相对较低; Sox9b只在脑、鳍条、眼睛和精巢中检测到一定水平的表达。通过重亚硫酸氢盐DNA测序方法分析了翘嘴鲌性腺组织Sox9a启动子CpG岛甲基化修饰模式, 结果显示在精巢中CG位点几乎不发生甲基化, 然而卵巢中的甲基化程度非常高。这些结果表明启动子CpG甲基化可以调控Sox9a的性别异形表达, 表观遗传修饰在翘嘴鲌性腺发育过程中可能具有重要的生物学功能。
-
关键词:
- 翘嘴鲌 /
- Sox9a和Sox9b /
- 基因表达 /
- CpG甲基化
Abstract: In order to elucidate the mechanisms of sex determination and differentiation in Culter alburnus and to control breeding, this study analyzed the role of C. alburnus Sox9 during gonad development. The cDNA sequence of two homologous genes Sox9a and Sox9b were obtained. The full-length cDNA of Sox9a was 1642 bp, encoding 458 amino acids; the full-length cDNA of Sox9b was 1673 bp, encoding 456 amino acids. Sequence analysis revealed that the similarity between them was 73.95% and the HMG motif regions were highly conservative. Protein second structural prediction showed that Sox9a and Sox9b contained a HMG domain and two nuclear localization signal (NLS) sequences; their three-dimensional structure contained multiple spiral structures. Phylogenetic tree analysis discovered that C. alburnus Sox9a was the closest to Oreochromis niloticus, while Sox9b formed a separate branch. Sox9a was highly expressed in brain and testes, followed by muscle, fins, eyes and ovaries, and rarely detected in kidney, spleen and liver. The expression of Sox9b were only detected in brain, fins, eyes and testes. Promoter CpG methylation analysis of Sox9a showed that CpGs were not methylated in the testes, whereas CpGs were hypermethylated in the ovaries. These results suggested that promoter CpG methylation can regulate sexual dimorphic expression of sex-related genes, and epigenetic modification may play an important role in the gonad development of C. alburnus.-
Keywords:
- Culter alburnus /
- Sox9a and Sox9b /
- Gene expression /
- CpG methylation
-
Sox基因是编码一类具有高度保守HMG盒(High mobility group)序列特征的转录调控因子[1], 伴随着物种多倍化进程中导致的基因组复制和分裂结果, 目前已克隆到该家族30多个成员[2]。Sox家族成员在早期胚胎至成体的各个发育阶段都发挥着重要作用, 如参与神经系统发育、器官再生、细胞命运决定、血细胞生成、晶状体发育等众多生物学过程[3, 4]。其中Sox9基因作为重要的一员, 已被证明与脊椎动物性别决定直接相关, 因而受到了广泛的关注与研究[5]。鱼类有着最为复杂的性别决定类型, 这也为研究性别分化机制提供了理想的动物模型。迄今为止, 在斑马鱼(Danio rerio)、黄鳝(Monopterus albus)、青鳉(Oryzias latipes)、鲤(Cyprinus carpio)、虹鳟(Oncorhynchus mykiss)等鱼类品系中展开的相关研究都证实Sox9在鱼类性别控制方面具有重要作用[6]。
近年来, 越来越多的研究表明表观遗传调控在性别决定中有着不可或缺的作用, 特别是性别相关基因启动子区域的CpG岛DNA甲基化修饰[7—9]。海鲈(Lateolabrax japonicus)中发现在发育早期高温处理能使Cyp19a1a基因启动子区域的甲基化水平增强, 从而抑制了该基因的表达, 引导其向雄性分化[7]。Wen等[10]在日本牙鲆(Paralichthys olivaceus)中的研究证明性别相关基因dmrt1和cyp19a启动子CpG甲基化修饰模式与2个基因的表达水平呈负相关, 提示表观遗传调控可以决定牙鲆的性腺分化。同样的, 性别决定相关基因Sox9启动子或调控区域的甲基化修饰作为一种关键的因子可以直接影响下游基因的表达, 进而实现性别的决定与分化[11]。
翘嘴鲌(Culter alburnus Basilewsky)在分类上隶属鲤科、鲌亚科、鲌属, 近年来由于人工养殖和繁殖技术的不断成熟与推广, 现已成为长江三角洲地区的主要名特养殖品种[12]。多年的养殖经验显示翘嘴鲌雌鱼比雄鱼的个体大、生长速度快, 有着明显的性别异形特征[13, 14]。但目前我们对于翘嘴鲌的性别决定类型以及相关的调控基因都不清楚, 因此探索、阐明翘嘴鲌性别决定与分化的作用机制, 发展翘嘴鲌全雌育种技术, 对于提高翘嘴鲌养殖产业的发展具有重要意义和应用价值。本研究首次克隆了翘嘴鲌性别相关基因Sox9的全长cDNA及近端启动子序列, 同时进行了序列分析和蛋白质结构预测; 随后采用实时定量PCR技术检测了该基因在成体各组织中的表达水平; 最后分析了该基因在不同性腺组织启动子区域CpG岛甲基化的修饰状态。这些结果为深入研究翘嘴鲌性别相关基因及性别决定机制提供线索和新的思路, 为进一步探索翘嘴鲌Sox9基因的生物学功能研究提供重要依据, 同样也有助于发展翘嘴鲌性别控制育种和单性养殖技术。
1. 材料与方法
1.1 实验材料
本研究使用的翘嘴鲌实验材料取自浙江省淡水水产研究所八里店综合试验基地。各成体组织: 脑、肝、肾、脾、心脏、肌肉、眼、卵巢、精巢样品经液氮速冻后保存于–80℃, 直至后续RNA或基因组DNA提取。
1.2 翘嘴鲌基因组DNA、总RNA的提取及cDNA第一链合成
选用实验室改良的酚氯仿抽提法分离翘嘴鲌精巢和卵巢的基因组DNA, 按照Total RNA Extractor (Trizol)试剂盒(生工生物工程 上海)说明书步骤进行各成体组织总RNA的提取。最后将提取的所有核酸产物经琼脂糖电泳检测和浓度测定, 并置于冰箱用于后续的实验。以提取的总RNA为模板, 在HiFiScript cDNA第一链合成试剂盒(康为 北京)作用下合成cDNA的第一条链。具体操作按照试剂盒说明书进行。
1.3 翘嘴鲌Sox9编码区的克隆及cDNA末端扩增
从GenBank中下载多个已发表鱼类物种Sox9基因mRNA序列并进行比较分析, 它们都含有一段编码HMG盒结构域的保守区域, 随即在该区域设计了简并引物sox9-F和sox9-R (表 1)。PCR反应体系为50 μL, 包含10×Ex-Taq Buffer 5 μL、dNTP (2.5 mmol/L) 4 μL、正反向引物(2.5 μmol/L)各4 μL、Ex-Taq 0.5 μL及补足ddH2O至50 μL。扩增条件: 94℃预变性5min; 94℃ 30s, 55℃ 30s, 72℃ 1min, 32个循环; 72℃延伸7min, 最后4℃保存。PCR产物经胶回收后连接至pMD18-T克隆载体进行测序, 序列结果通过与同源基因比对确认其为目的片段。随后在已获编码区序列基础上分别设计正反向特异性巢式引物GSPF1、GSPF2和GSPR1、GSPR2 (表 1)并参照SMARTerTM RACE (Clontech Japan)试剂盒说明书进行cDNA末端扩增, 最终获得Sox9a和Sox9b两个翘嘴鲌旁系同源基因的cDNA全长, 并且提交至GenBank (登录号: MG694537和MG694536)。本部分实验所用试剂均购自日本TaKaRa公司, 引物合成及测序委托上海生工生物工程公司。
表 1 用于翘嘴鲌Sox9基因克隆、表达分析和甲基化检测的引物Table 1. Primers used for cloning, expression and methylation analysis of Sox9 in C. alburnus名称Name 序列Sequences (5′—3′) sox9-F CACGTCAAGAGACCGATGAA sox9-R TACTTATAGTCGGGGTGATC GSPF1 GGACCAATACCCGCACCTCCACAAC GSPF2 GCTCAGCAAAACTCTGGGCAAACTT GSPR1 AGTCGGGGTGATCTTTCTTGTGCTG GSPR2 GCGTTGTGGAGGTGCGGGTATTGGT RT-sox9a-F CCGAGAACGACGCACATCAAGAC RT-sox9a-R GAAGGAAGTGCTGTAGTGCTGTAGG RT-sox9b-F AACAGCAGCAGCACTCGTTGAG RT-sox9b-R AGGTTGAAGGAGCCGTAGGTGAC ef-1α-F ACATGAGGCAGACCGTTGCT ef-1α-R GGCAGCCTTCTGTGCAGATT GSP-AS1 CTCATCTGTCATTTTCAGGTAGGGA GSP-AS2 AGCGACTCCAAAAAATCCTTTCCAA BSP-F TATTAGGACGAGATGGGTTTGGTTT BSP-R TTCTACTAATATCTACAAAAACAA 1.4 氨基酸预测、比对及进化树分析
使用JELLYFISH软件推测了Sox9a和Sox9b基因编码的氨基酸序列, 随后用DNAMAN软件对这两个同源基因编码的氨基酸序列进行了比对, 利用在线软件Motif Scan (https://myhits.isb-sib.ch/cgi-bin/motif_scan)和SWISS-MODEL (https://swissmodel.expasy.org/)进行了蛋白质二级结构和三级结构预测。同时将预测的结果分别与其他物种进行同源性分析, 使用MEGA 5.0软件的Neighbor-joining方法构建了系统进化树。
1.5 Sox9a、Sox9b在翘嘴鲌成体不同组织中的表达特征分析
利用荧光实时定量PCR (qRT-PCR)的方法检测了翘嘴鲌不同成体组织的mRNA转录水平, 根据克隆获得的Sox9a和Sox9b cDNA序列分别设计实时定量引物对RT-sox9a-F和RT-sox9a-R、RT-sox9b-F和RT-sox9b-R (表 1), 并以ef-1α作为内参基因。荧光定量RT-PCR实验首先将各组织RNA在去基因组逆转录试剂盒(ABM加拿大)作用下合成cDNA第一链, 随后选用EvaGreen 2× qPCR MasterMix试剂盒(ABM加拿大)构建PCR反应体系。实时定量PCR反应及后续信息在LightCycler 480 System (Roche瑞士)上进行。由于定量反应非常敏感, 我们对每个反应设定了3个平行, 最后采用2–ΔΔCt法计算表达量并使用GraphPad Prism 5软件获得直方图。
1.6 Sox9a近端启动子扩增、CpG岛预测及DNA甲基化修饰检测
根据已知的Sox9a mRNA序列设计了两条特异性引物GSP-AS1、GSP-AS2, 按照GenomeWalker™ Universal Kit (CloneTech, 日本)试剂盒说明书通过染色体步查法扩增到未知的近端启动子区域。随后, 我们直接将翘嘴鲌Sox9a启动子原始序列输入于在线软件MethPrimer (http://www.urogene.org/methprimer/), 进行序列提交命令后, 软件预测到CpG岛的所在区域以及甲基化分析引物对BSP-F和BSP-R (表 1)。根据CpGenomeTM DNA Modification Kit (Chemicon, USA)说明书对翘嘴鲌性腺组织基因组DNA进行重亚硫酸氢盐修饰处理, 随后进行甲基化特异性扩增。
2. 结果
2.1 翘嘴鲌Sox9基因的cDNA克隆
用sox9-F和sox9-R简并引物通过RT-PCR方法扩增获得了一段长度为212 bp的核苷酸片段, 经测序并借助NCBI网站中Blast功能进行同源性分析, 结果显示其为斑马鱼、鲤等物种的同源片段, 从而确定此片段为翘嘴鲌Sox9基因的部分cDNA序列。
随后用SMARTerTM RACE试剂盒进行5′和3′-RACE扩增获得了翘嘴鲌Sox9 cDNA的完整序列。与其他鱼类品系一样, 翘嘴鲌Sox9具有2个同源基因, 分别为Sox9a、Sox9b。Sox9a全长1642 bp, 包括191 bp的5′非编码区(5′-UTR)、1377 bp的开放阅读框(ORF)和74 bp的3′非编码区(3′-UTR), 编码458个氨基酸; Sox9b全长1673 bp, 包括212 bp的5′非编码区(5′-UTR)、1371 bp的开放阅读框(ORF)和90 bp的3′非编码区(3′-UTR), 编码456个氨基酸。2个同源基因都具有进化上高度保守的HMG盒结构域, 目前已将序列提交至GenBank (登录号: MG694537和MG694536)。
2.2 翘嘴鲌转录因子Sox9a和Sox9b氨基酸序列比对及蛋白结构预测
运用DNAMAN软件对翘嘴鲌转录因子Sox9a和Sox9b的氨基酸序列进行了比对分析, 两者相似度达到73.95%, 但编码HMG盒区域极其保守。利用在线软件Motif Scan分子结构预测工具对翘嘴鲌Sox9a和Sox9b的蛋白质二级结构进行了分析, 结果显示两者除了高度保守的HMG盒结构域外, 分别还有2个核定位信号。利用SWISS-MODEL在线工具为Sox9的三维结构建模, 翘嘴鲌Sox9a和Sox9b与人4euw.1.A的一致性高达98.81%, 其中Sox9a含有多个α螺旋及无规则卷曲结构, 在约90—170个氨基酸处形成空穴, 与预测的二级保守结构域HMG-box有重叠, 推测该部位为其活性部位。Sox9b同样含有多个螺旋结构, 同时在90—180个氨基酸处出现更大的弯曲, 空穴则压缩得更小, 使其三维结构呈现饼铛状, 推测其与Sox9b功能趋异有关。
2.3 不同物种Sox9基因氨基酸序列聚类分析
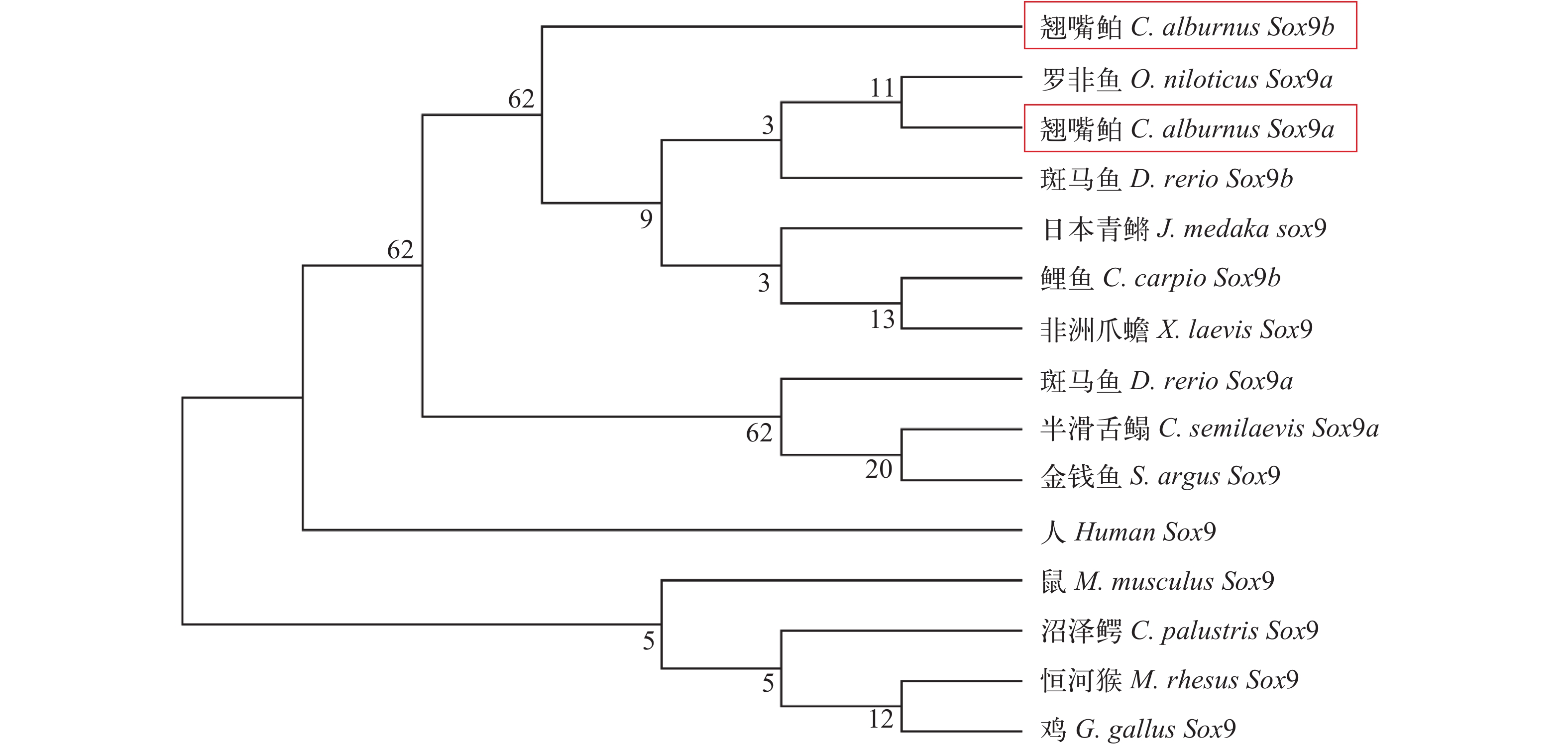
从GenBank数据库中下载了不同脊椎动物已发表的Sox9蛋白编码序列, 利用MEGA 5.0软件的邻接法(Neighbor-joining)对翘嘴鲌Sox9a、Sox9b氨基酸序列与其他物种的Sox9氨基酸序列构建了系统进化树(图 1)。在分子系统树中, 所有鱼类聚为一支, 与其他较高等脊椎动物关系较远(除了非洲爪蟾)。其中翘嘴鲌Sox9a与罗非鱼Sox9a发生聚类, 较其他物种具有最接近的亲缘关系, 而翘嘴鲌Sox9b形成单独的一支。总体而言, 该基因的系统进化关系与其所在物种的进化地位仍保持一致。
![]() 图 1 采用Neighbor Joining方法构建的不同物种Sox9蛋白系统进化树图中方框示翘嘴鲌物种, 置信度(Bootstraps)500次检验各分支置信度。其他物种如下: 人(Homo sapiens CAA86598)、鼠(Mus musculus AAL16093)、恒河猴(Macaca mulatta AF322900.1)、爬行类沼泽鳄(Crocodylus porosus XM_019542330.1)、两栖类非洲爪蟾(Xenopus laevis AAI70060)、鸟类中的鸡(Gallus gallus BAA25296)以及属于鱼类的半滑舌鳎(Cynoglossus semilaevis NP_001281172.1)、日本青鳉(NM_001105085)、尼罗罗非鱼(Oreochromis niloticus DQ632575)、鲤(AAX56088.1)、斑马鱼(NM_131643、NM_131644)、金钱鱼(Scatophagus argus AFW97630.1)Figure 1. Phylogenetic tree of Sox9 protein generated with Neighbor Joining methodThe box shows the C. alburnus species, and bootstrap values based on 500 re-smpling replicates. Species using for phylogenetic tree analysis are as followed: Homo sapiens (CAA86598), Mus musculus (AAL16093), Macaca mulatta (AF322900.1), Crocodylus porosus (XM_019542330.1), Xenopus laevis (AAI70060), Gallus gallus (BAA25296), Cynoglossus semilaevis (NP_001281172.1), O. latipes (NM_001105085), Oreochromis niloticus (DQ632575), C. carpio (AAX56088.1), D. rerio (NM_131643 and NM_131644), Scatophagus argus (AFW97630.1)
图 1 采用Neighbor Joining方法构建的不同物种Sox9蛋白系统进化树图中方框示翘嘴鲌物种, 置信度(Bootstraps)500次检验各分支置信度。其他物种如下: 人(Homo sapiens CAA86598)、鼠(Mus musculus AAL16093)、恒河猴(Macaca mulatta AF322900.1)、爬行类沼泽鳄(Crocodylus porosus XM_019542330.1)、两栖类非洲爪蟾(Xenopus laevis AAI70060)、鸟类中的鸡(Gallus gallus BAA25296)以及属于鱼类的半滑舌鳎(Cynoglossus semilaevis NP_001281172.1)、日本青鳉(NM_001105085)、尼罗罗非鱼(Oreochromis niloticus DQ632575)、鲤(AAX56088.1)、斑马鱼(NM_131643、NM_131644)、金钱鱼(Scatophagus argus AFW97630.1)Figure 1. Phylogenetic tree of Sox9 protein generated with Neighbor Joining methodThe box shows the C. alburnus species, and bootstrap values based on 500 re-smpling replicates. Species using for phylogenetic tree analysis are as followed: Homo sapiens (CAA86598), Mus musculus (AAL16093), Macaca mulatta (AF322900.1), Crocodylus porosus (XM_019542330.1), Xenopus laevis (AAI70060), Gallus gallus (BAA25296), Cynoglossus semilaevis (NP_001281172.1), O. latipes (NM_001105085), Oreochromis niloticus (DQ632575), C. carpio (AAX56088.1), D. rerio (NM_131643 and NM_131644), Scatophagus argus (AFW97630.1)2.4 翘嘴鲌Sox9a和Sox9b在各个组织中的差异表达
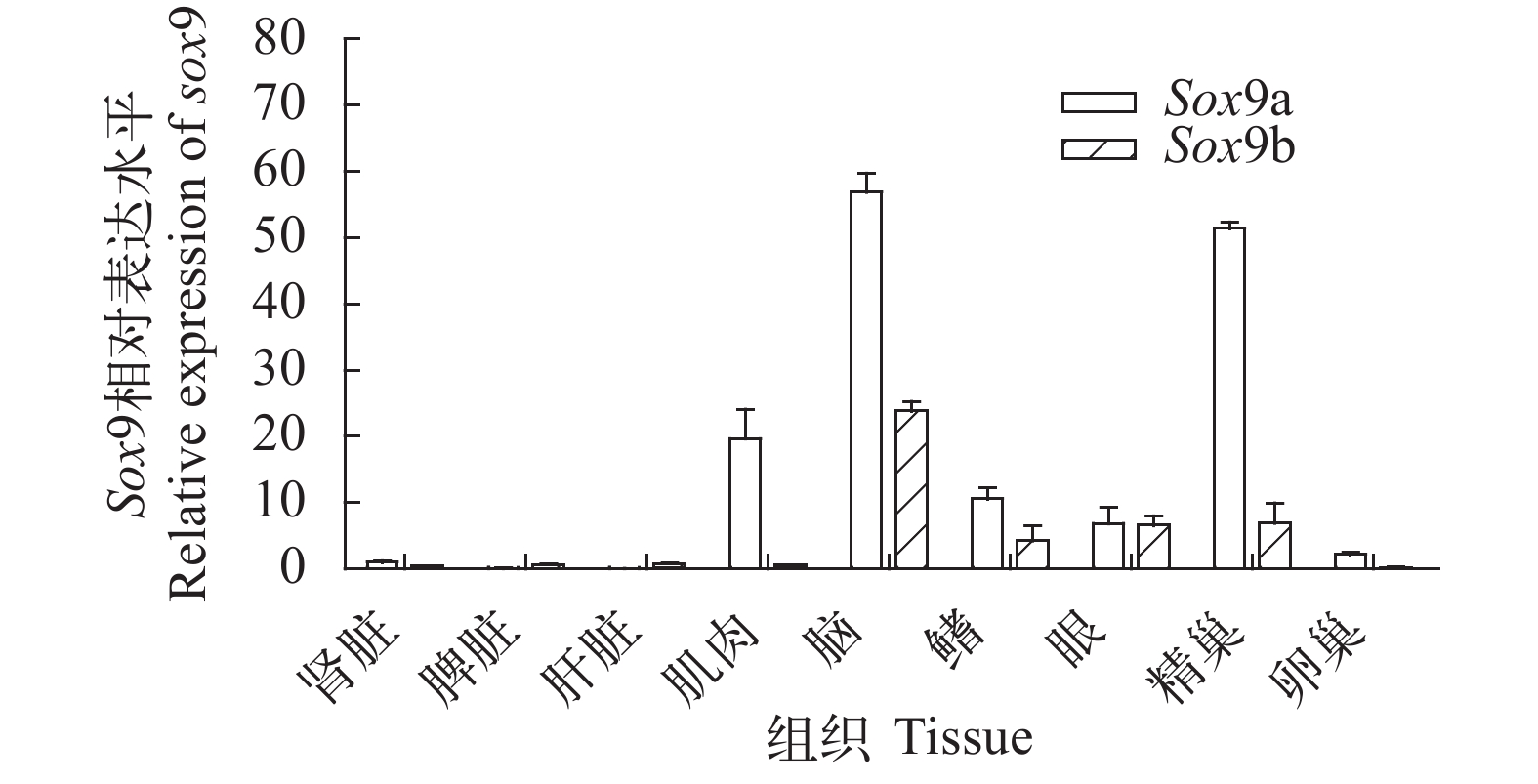
运用实时荧光定量PCR技术对2个同源基因Sox9a和Sox9b的mRNA表达水平进行了检测, 结果显示两者在翘嘴鲌不同组织中的表达丰度具有明显的组织差异性和特异性。Sox9a在脑和精巢中表达量最高, 其次是肌肉、鳍条、眼睛和卵巢, 在肾脏、脾脏、肝脏中相对较低; Sox9b只在脑、鳍条、眼睛和精巢中检测到一定水平的表达, 其余组织中几乎不表达(图 2)。
2.5 翘嘴鲌Sox9a启动子区域CpG岛甲基化分析
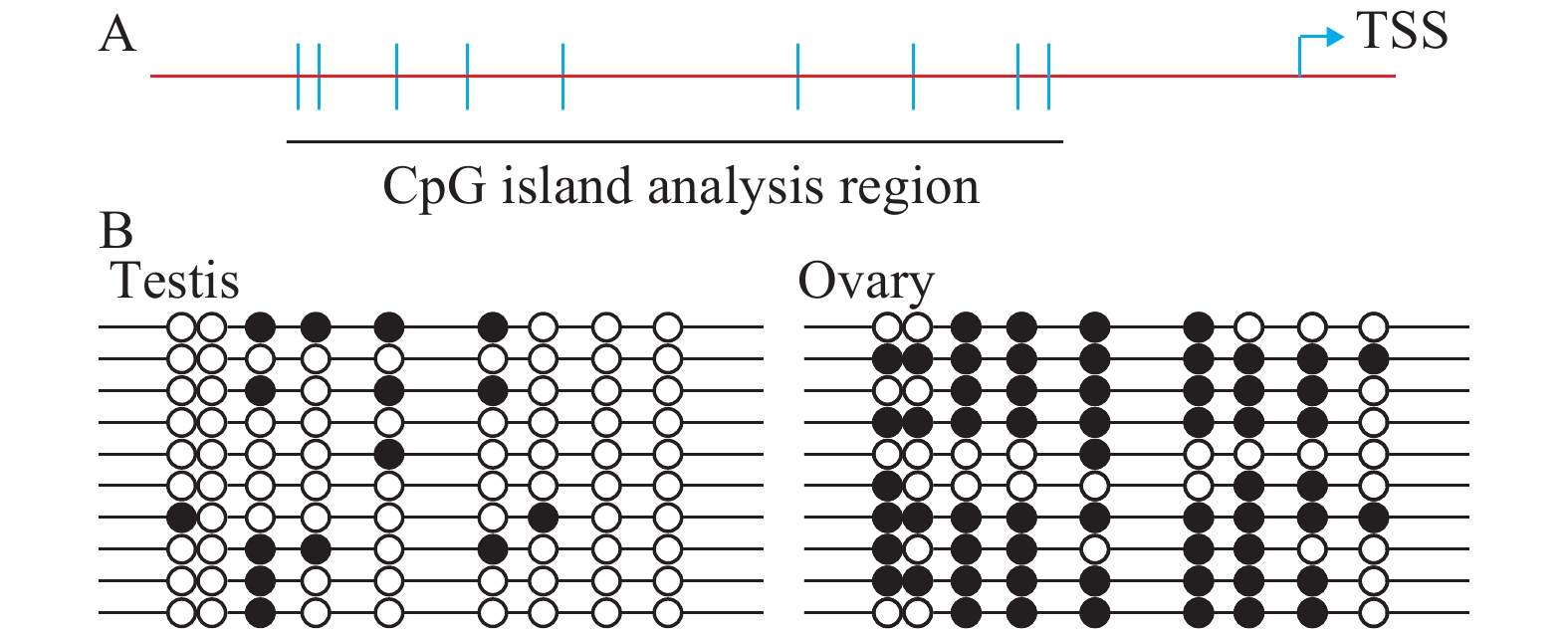
实时定量分析结果显示翘嘴鲌雄性特异性基因Sox9a在精巢组织中的表达量远高于卵巢组织, 为了解这类两性特异性差异表达的潜在机制, 我们检测了精巢和卵巢中Sox9a基因差异表达是否涉及DNA甲基化水平的差异修饰。通过染色体步查法获得的部分启动子序列提交至在线工具MethPrimer进行CpG岛预测, 结果表明近端启动子附近存在符合标准的CpG岛, 包含9个CG二核苷酸位点(图 3A)。随即我们通过重亚硫酸氢盐DNA测序方法分析了翘嘴鲌性腺组织Sox9a启动子CpG岛甲基化修饰模式, 结果显示在精巢中CG位点几乎不发生甲基化, 然而卵巢中高度甲基化(图 3B)。这个结果表明Sox9a在性腺组织中的表达丰度与DNA甲基化修饰程度正好呈负相关, 提示在翘嘴鲌性腺发育过程中性别相关基因启动子CpG岛差异甲基化修饰涉及下游基因的异形表达。
![]() 图 3 翘嘴鲌Sox9a基因启动子CpG岛甲基化分析a. Sox9a启动子CpG岛位置, 每一条垂直竖线代表一个CG二核苷酸; b. 精巢和卵巢基因组Sox9a启动子硫化测序结果; 实心圆圈代表甲基化的CpG位点、空心圆圈代表非甲基化的CpG位点。每一行表示一个测序克隆Figure 3. Promoter CpG island methylation analysis of Sox9a in C. alburnusa. The position of Sox9a promoter CpG island, each vertical line indicates the position of a CpG dinucleotide; b. Bisulfte sequencing results of the Sox9a promoter CpG-island in the genomes of testis and ovary; The methylated and unmethylated CpG sites are represented by flled circles and open circles, respectively. Each line represents an examined clone
图 3 翘嘴鲌Sox9a基因启动子CpG岛甲基化分析a. Sox9a启动子CpG岛位置, 每一条垂直竖线代表一个CG二核苷酸; b. 精巢和卵巢基因组Sox9a启动子硫化测序结果; 实心圆圈代表甲基化的CpG位点、空心圆圈代表非甲基化的CpG位点。每一行表示一个测序克隆Figure 3. Promoter CpG island methylation analysis of Sox9a in C. alburnusa. The position of Sox9a promoter CpG island, each vertical line indicates the position of a CpG dinucleotide; b. Bisulfte sequencing results of the Sox9a promoter CpG-island in the genomes of testis and ovary; The methylated and unmethylated CpG sites are represented by flled circles and open circles, respectively. Each line represents an examined clone3. 讨论
3.1 翘嘴鲌Sox9基因序列克隆及特征分析
为了解Sox9基因在翘嘴鲌性腺分化中的作用, 本研究利用RT-PCR、RACE及染色体步查等分子克隆方法获得了翘嘴鲌Sox9基因全长和近端启动子序列。不同于高等哺乳动物, 低等脊椎动物在进化过程会产生基因加倍现象, 类似于其他鱼类品系, 翘嘴鲌Sox9也存在2个旁系同源基因: Sox9a和Sox9b, 但其中涉及的分子机制较为复杂[15]。氨基酸序列分析表明Sox9a和Sox9b有着Sox家族蛋白都存在的高度保守HMG盒结构域, 然而两者的三维结构预测显示出一定程度上的不一致性, 提示其在功能作用中的差异。根据氨基酸序列进行同源性分析表明翘嘴鲌Sox9a与罗非鱼Sox9a发生聚类, 较其他物种具有最接近的亲缘关系, 而翘嘴鲌Sox9b形成单独的一支, 但总体而言该基因的系统进化关系与其所在物种的进化地位仍保持一致, 意味着Sox9基因在功能上的保守性。因此, 在鱼类中克隆并深入研究Sox9基因, 对于揭示脊椎动物Sox基因的进化历程以及研究其性别决定机制具有重要的理论和实践意义。
3.2 翘嘴鲌Sox9a和Sox9b基因的表达特征
为了揭示Sox9a和Sox9b基因在翘嘴鲌各成体组织中的表达情况, 本研究利用实时荧光定量技术对这2个同源基因的mRNA表达水平进行了检测, 结果显示Sox9a在脑和精巢中表达量最高, 其次是肌肉、鳍条、眼睛和卵巢, 在肾脏、脾脏、肝脏中相对较低, 这与Sox9基因在金钱鱼[16]、虹鳟[17]、西伯利亚鲟(Acipenser baeri)[18]等物种中的表达情况相似。翘嘴鲌Sox9a基因的表达模式表明其主要功能体现于神经系统发育和雄性性别分化, 同时在其他组织中也有不同程度的表达, 显示其功能的广泛性。基因组研究发现在鱼类等低等脊椎动物中, 基因复制后的重复基因有着不同的命运, 主要包括选择性丢失或协同进化产生新的功能, 而Sox9b只在脑、鳍条、眼睛和精巢中检测到一定水平的表达, 这个结果说明该基因明显面临功能上的丢失。
3.3 DNA甲基化在翘嘴鲌性腺分化过程中的作用
鱼类性别决定方式最为复杂, 其主要由内在的基因调控, 但同时又会受到其他非遗传因子的影响。近年来, 关于表观遗传修饰对于鱼类性别决定调控的研究越来越多, 特别是靶基因启动子或调控区域的CpG岛甲基化作用。DNA甲基化修饰能改变基因表达活性, 并且在细胞分裂后, 以半保留复制的方式将这种修饰式样传递到子细胞[19], 因此深入研究表观遗传机制在鱼类性别决定中的作用具有十分重要的意义。本研究通过分析翘嘴鲌近端启动子区域鉴定到一个CpG岛, 对不同性腺组织的甲基化检测表明翘嘴鲌精巢和卵巢确实存在差异的修饰式样, 且正好与基因的表达水平呈负相关。这个结果初步表明翘嘴鲌很可能通过DNA甲基化修饰依赖型机制调控下游基因二态性表达, 进而引导性腺分化。已知性别决定涉及到复杂的分子作用网络以及信号级联, 目前的研究大多局限于单基因甲基化状态的分析, 因此未来仍需大量的、全基因组水平的甲基化分析来解答众多关键性问题。
-
图 1 采用Neighbor Joining方法构建的不同物种Sox9蛋白系统进化树
图中方框示翘嘴鲌物种, 置信度(Bootstraps)500次检验各分支置信度。其他物种如下: 人(Homo sapiens CAA86598)、鼠(Mus musculus AAL16093)、恒河猴(Macaca mulatta AF322900.1)、爬行类沼泽鳄(Crocodylus porosus XM_019542330.1)、两栖类非洲爪蟾(Xenopus laevis AAI70060)、鸟类中的鸡(Gallus gallus BAA25296)以及属于鱼类的半滑舌鳎(Cynoglossus semilaevis NP_001281172.1)、日本青鳉(NM_001105085)、尼罗罗非鱼(Oreochromis niloticus DQ632575)、鲤(AAX56088.1)、斑马鱼(NM_131643、NM_131644)、金钱鱼(Scatophagus argus AFW97630.1)
Figure 1. Phylogenetic tree of Sox9 protein generated with Neighbor Joining method
The box shows the C. alburnus species, and bootstrap values based on 500 re-smpling replicates. Species using for phylogenetic tree analysis are as followed: Homo sapiens (CAA86598), Mus musculus (AAL16093), Macaca mulatta (AF322900.1), Crocodylus porosus (XM_019542330.1), Xenopus laevis (AAI70060), Gallus gallus (BAA25296), Cynoglossus semilaevis (NP_001281172.1), O. latipes (NM_001105085), Oreochromis niloticus (DQ632575), C. carpio (AAX56088.1), D. rerio (NM_131643 and NM_131644), Scatophagus argus (AFW97630.1)
图 3 翘嘴鲌Sox9a基因启动子CpG岛甲基化分析
a. Sox9a启动子CpG岛位置, 每一条垂直竖线代表一个CG二核苷酸; b. 精巢和卵巢基因组Sox9a启动子硫化测序结果; 实心圆圈代表甲基化的CpG位点、空心圆圈代表非甲基化的CpG位点。每一行表示一个测序克隆
Figure 3. Promoter CpG island methylation analysis of Sox9a in C. alburnus
a. The position of Sox9a promoter CpG island, each vertical line indicates the position of a CpG dinucleotide; b. Bisulfte sequencing results of the Sox9a promoter CpG-island in the genomes of testis and ovary; The methylated and unmethylated CpG sites are represented by flled circles and open circles, respectively. Each line represents an examined clone
表 1 用于翘嘴鲌Sox9基因克隆、表达分析和甲基化检测的引物
Table 1 Primers used for cloning, expression and methylation analysis of Sox9 in C. alburnus
名称Name 序列Sequences (5′—3′) sox9-F CACGTCAAGAGACCGATGAA sox9-R TACTTATAGTCGGGGTGATC GSPF1 GGACCAATACCCGCACCTCCACAAC GSPF2 GCTCAGCAAAACTCTGGGCAAACTT GSPR1 AGTCGGGGTGATCTTTCTTGTGCTG GSPR2 GCGTTGTGGAGGTGCGGGTATTGGT RT-sox9a-F CCGAGAACGACGCACATCAAGAC RT-sox9a-R GAAGGAAGTGCTGTAGTGCTGTAGG RT-sox9b-F AACAGCAGCAGCACTCGTTGAG RT-sox9b-R AGGTTGAAGGAGCCGTAGGTGAC ef-1α-F ACATGAGGCAGACCGTTGCT ef-1α-R GGCAGCCTTCTGTGCAGATT GSP-AS1 CTCATCTGTCATTTTCAGGTAGGGA GSP-AS2 AGCGACTCCAAAAAATCCTTTCCAA BSP-F TATTAGGACGAGATGGGTTTGGTTT BSP-R TTCTACTAATATCTACAAAAACAA -
[1] Foster J W, Dominguez-Steglich M A, Guioli S, et al. Campomelic dysplasia and autosomal sex reversal caused by mutations in an SRY-related gene [J]. Nature, 1994, 372(6506): 525—530 doi: 10.1038/372525a0
[2] Zhong L, Yu X M, Tong J G. Sox genes in grass carp (Ctenopharyngodon idella) with their implications for genome duplication and evolution [J]. Genetics Selection Evolution, 2006, 38: 673—687
[3] Kamachi Y, Kondoh H. Sox proteins: regulators of cell fate specification and differentiation [J]. Development, 2013, 140(20): 4129—4144 doi: 10.1242/dev.091793
[4] Sarkar A, Hochedlinger K. The Sox family of transcription factors: versatile regulators of stem and progenitor cell fate [J]. Cell Stem Cell, 2013, 12(1): 15—30 doi: 10.1016/j.stem.2012.12.007
[5] Denny P, Swift S, Brand N, et al. A conserved family of genes related to the testis determining gene, SRY [J]. Nucleic Acids Research, 1992, 20(11): 2887 doi: 10.1093/nar/20.11.2887
[6] 贺超, 洪广, 吴静娴, 等. 泰国斗鱼Sox9基因的克隆及组织表达研究. 安徽农业科学, 2017, 45(8): 151—155 doi: 10.3969/j.issn.0517-6611.2017.08.051 He C, Hong G, Wu J X, et al. Study on cloning and tissue expression of Sox9 in Betta splendens [J]. Journal of Anhui Agricultural Sciences, 2017, 45(8): 151—155 doi: 10.3969/j.issn.0517-6611.2017.08.051
[7] Navarro-Martín L, Viñas J, Ribas L, et al. DNA methylation of the gonadal aromatase (cyp19a) promoter is involved in temperature-dependent sex ratio shifts in the European sea bass [J]. PLoS Genetics, 2011, 7(12): e1002447 doi: 10.1371/journal.pgen.1002447
[8] Zhang J, Boualem A, Bendahmane A, et al. Genomics of sex determination [J]. Current Opinion in Plant Biology, 2014, 18(1): 110—116
[9] Tachibana M. Epigenetic regulation of mammalian sex determination [J]. Journal of Medical Investigation, 2015, 62(1-2): 19—23
[10] Wen A Y, You F, Sun P, et al. CpG methylation of dmrt1 and cyp19a promoters in relation to their sexual dimorphic expression in the Japanese flounder Paralichthys olivaceus [J]. Journal of Fish Biology, 2014, 84(1): 193—205 doi: 10.1111/jfb.12277
[11] Pamnani M, Sinha P, Singh A, et al. Methylation of the Sox9 and Oct4 promoters and its correlation with gene expression during testicular development in the laboratory mouse [J]. Genetics & Molecular Biology, 2016, 39(3): 452—458
[12] 顾志敏, 朱俊杰, 贾永义, 等. 太湖翘嘴红鲌胚胎发育及胚后发育观察. 中国水产科学, 2008, 15(2): 204—214 doi: 10.3321/j.issn:1005-8737.2008.02.003 Gu Z M, Zhu J J, Jia Y Y, et al. Research on embryonic and postembryonic development of Erythroculter ilishaeformis Bleeker of Taihu Lake [J]. Journal of Fishery Sciences of China, 2008, 15(2): 204—214 doi: 10.3321/j.issn:1005-8737.2008.02.003
[13] 梅洁, 桂建芳. 鱼类性别异形和性别决定的遗传基础及其生物技术操控. 中国科学: 生命科学, 2014, 44(12): 1198—1212 Mei J, Gui J F. Genetic basis and biotechnological manipulation of sexual dimorphism and sex determination in fish (review) [J]. Science China Life Sciences, 2014, 44(12): 1198—1212
[14] 刘祥芳, 郑建波, 贾永义, 等. 翘嘴红鲌雌雄基因组差异及太湖野生群体遗传多样性现状的AFLP分析. 水生生物学报, 2017, 41(06): 36—42 Liu X F, Zheng J B, Jia Y Y, et al. AFLP analysis on genomic sexual dimorphism of Erythroculter ilishaeformis and current genetic diversity of the taihu strain [J]. Acta Hydrobiologica Sinica, 2017, 41(06): 36—42
[15] Zheng J, Long L, Hu J, et al. Isolation and sequence analysis of Sox genes in the red crucian carp (Carassius carassius, red variety) [J]. Russian Journal of Genetics, 2008, 44(11): 1325—1330 doi: 10.1134/S1022795408110112
[16] 陈建华, 何毛贤, 牟幸江, 等. 金钱鱼Sox9 cDNA克隆及其表达分析. 动物学杂志, 2015, 50(1): 93—102 Chen J H, He M X, Mu X J, et al. cDNA cloning and mRNA expression analysis of Sox9 in Scatophagus argus [J]. Chinese Journal of Zoology, 2015, 50(1): 93—102
[17] Ito M. Rainbow trout SOX9: cDNA cloning, gene structure and expression [J]. Gene, 1997, 202(1-2): 167—170 doi: 10.1016/S0378-1119(97)00483-6
[18] 施志仪, 程千千, 宋佳坤, 等. 西伯利亚鲟Sox9基因cDNA全长克隆、序列分析及其表达检测. 水产学报, 2010, 34(5): 664—672 Shi Z Y, Cheng Q Q, Song J K, et al. Cloning, analysis and expression detection of the full-length cDNA of Sox9 from the Siberian sturgeon (Acipenser baerii Brandt) [J]. Journal of Fisheries of China, 2010, 34(5): 664—672
[19] Bing Z, Reinberg D. Epigenetic inheritance: uncontested [J]? Cell Research, 2011, 21(3): 435—441 doi: 10.1038/cr.2011.26
-
期刊类型引用(6)
1. 何昌熙,郑建波,马建波,贾永义,刘士力,蒋文枰,迟美丽,程顺,李飞. 翘嘴鲌Runx2b基因的克隆与表达特征分析. 浙江农业学报. 2024(05): 1024-1031 .  百度学术
百度学术
2. 张爽,苏靖景,王欣慧,张颖,刘丰瑜,刘婧琪,袁紫霞,吕佳励,商凯琳,杨受保. 福寿螺SOX9L基因的克隆与表达分析. 农业生物技术学报. 2023(09): 1914-1923 .  百度学术
百度学术
3. 杨超超,屈蓉,杜妙柔,王琪,雷忻. 鱼类雄性性别分化与精巢发育调控基因研究进展. 中国实验动物学报. 2023(09): 1206-1216 .  百度学术
百度学术
4. 徐东杰,谢熙,王蒙恩,王振亚,朱冬发. Sox基因家族在水生动物性腺发育中的功能研究进展. 生物学杂志. 2022(03): 97-102 .  百度学术
百度学术
5. 郑建波,贾永义,蔡李娜,顾志敏,刘士力,迟美丽,程顺. 翘嘴鲌胰岛素样生长因子igf3基因的克隆及表达分析. 水生生物学报. 2021(04): 734-740 .  本站查看
本站查看
6. 崔晓羽,董赛赛,段胜华,汪桂玲,李家乐. 三角帆蚌(Hyriopsis cumingii)Hc-Sox9基因的全长克隆及表达分析. 基因组学与应用生物学. 2021(Z3): 2936-2943 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: