THE EFFECT OF ACUTE LOW SALINITY STRESS ON GPI GENE IN TAKIFUGU RUBRIPES
-
摘要: 为了获得红鳍东方鲀Takifugu rubripes葡萄糖-6-磷酸异构酶(Glucose-6-Phosphate Isomerase, GPI)的基因信息及其表达特性, 研究采用RT-PCR和实时荧光定量PCR (qPCR) 技术进行了GPI基因的克隆、组织表达分析及其在急性低盐胁迫下的基因响应研究。结果显示, 所获得的红鳍东方鲀GPI基因序列长1736 bp, 包含一个完整的开放阅读框(Open Reading Frame, ORF)。ORF由1662个核苷酸组成, 编码553个氨基酸; 预测的氨基酸序列中有2个糖异构域(Sugar Isomerase Domains), 不存在信号肽和跨膜结构域。多序列比对结果表明物种间GPI具有较高的保守性。qPCR结果表明: GPI基因mRNA在红鳍东方鲀鳃、肌肉、脑、肠、肝及肾等组织中均有表达, 其中肌肉中表达量最高。在不同盐度胁迫下, 在鳃中, 各低盐组GPI mRNA相对表达量均呈现先升高后降低又回升的趋势; 在肾中, 各低盐组GPI mRNA相对表达量变化趋势各有不同。由此推测, GPI基因在红鳍东方鲀对急性低盐胁迫的响应中发挥一定作用。
-
关键词:
- 红鳍东方鲀 /
- 葡萄糖-6-磷酸异构酶 /
- 低盐胁迫
Abstract: To investigate the effect of low salinity stress on Glucose-6-Phosphate Isomerase (GPI) in Takifugu rubripes, we cloned GPI and analyzed its expressions in tissues with and without acute low-salinity stress using RT-PCR and real-time quantitative PCR (qPCR) techniques. The results showed that the GPI cDNA of the T. rubripes was 1736 bp in length containing an Open Reading Frame of 1662 nucleotides that encodes 553 amino acids. The predicted amino acid sequence contains two Sugar Isomerase Domains without signal peptide and transmembrane domains. Results of multiple sequence alignment showed that GPI was highly conserved among species. qPCR results showed that GPI mRNA was expressed in all the tested tissues, with the highest expression level in muscle. Under low-salinity stress, the relative mRNA expression of GPI in gill increased firstly, then decreased and increased again in all low-salinity groups, and the relative mRNA expression of GPI in kidney differed among low-salinity groups. Therefore, it was speculated that GPI play a role in the response of T. rubripes to acute low-salinity stress. -
葡萄糖-6-磷酸异构酶(Glucose-6-Phosphate Isomerase, GPI)存在于真核生物和原核生物中, 是一种多功能酶, 主要功能是催化糖酵解过程中6-磷酸葡萄糖与6-磷酸果糖之间的相互转化[1]。GPI根据行使功能的不同, 又称神经细胞素(Neuroleukin, NLK)、自分泌运动因子(Autocrine Mobility Factor, AMF)[2]和分化成熟调节因子(Differentation and Maturation Mediator, DMM)[2, 3]。NLK由T细胞分泌, 作为神经营养因子促进脊髓和感觉神经的存活[4]。AMF是癌细胞分泌的细胞因子, 可以刺激癌细胞的分化和迁移[5, 6]。由于GPI在生物体内行使多种功能, 所以该酶的基因缺陷可引起多种疾病, Kugler等[7]研究指出人体内缺乏GPI可导致非球型血红细胞贫血症。此外, 许多疾病如急性肝炎、恶性肿瘤、急性心肌梗死等也会引起患者血清中GPI活性明显增高, 并且有研究发现其与病程呈正相关性。因此, GPI的研究对其他类疾病的诊断检测也具有一定的潜在意义[8, 9]。
目前, 关于GPI的研究, 大多数集中于哺乳动物, 而鱼类中的研究相对较少, 主要针对鱼糜制品产品的劣化。Sun等[10]研究并证实鲫体内GPI是其自身肌原纤维结合型丝氨酸蛋白酶(Myofibril-bound serine proteinase, MBSP)的内源性抑制剂, 对预防鱼产品凝胶劣化起到一定作用。
红鳍东方鲀Takifugu rubripes属鲀形目Tetraodontiformers、鲀亚目Tetraodontoidei、鲀科Tetraodontidae、东方鲀属Takifugu[11], 是我国北方一种名贵的经济鱼类。其能够在盐度为5‰—45‰的水体中存活, 属于广盐性底栖鱼类, 但其盐度适应机制尚不清楚。我们在前期的研究中, 通过转录组测序技术, 在低盐处理的红鳍东方鲀鳃中获得了GPI基因的片段序列, 为了进一步了解红鳍东方鲀GPI的基因信息及其表达特性, 本研究通过RT-PCR技术, 克隆获得红鳍东方鲀GPI基因的cDNA序列, 并对其序列特征、组织差异表达及在低盐胁迫下的转录水平变化进行了分析, 以期为进一步研究红鳍东方鲀响应盐度胁迫的变化及机制提供基础资料。
1. 材料与方法
1.1 材料
试验用红鳍东方鲀幼鱼购于大连天正实业有限公司, 平均质量为(11.34±2.13) g, 平均体长为(7.18±0.34) cm。试验用鱼购回后于农业农村部北方海水增养殖重点实验室暂养1周。暂养条件为: 水温(25.03±0.42)℃, 盐度(32±0.5)‰, 24h连续充气。
1.2 方法
试验设计及样品采集 选取暂养后无异常的红鳍东方鲀幼鱼3尾, 解剖后, 分别取其鳃、肌肉、脑、肠、肝和肾组织, 用于基因克隆及组织差异表达分析。样品置于1.5 mL离心管中, 迅速投入液氮, 转移至−80℃冰箱保存备用。
低盐胁迫试验用水为净化处理的天然海水(盐度平均为32‰)和天然海水与曝气后自来水配制成的低盐度海水, 容器为200 L的方形水槽。设计5个盐度梯度, 分别为32‰(对照组)、16‰、12‰、8‰和4‰, 每个盐度设置3个平行, 每个盐度组30尾鱼, 选取暂养后大小相似、状态良好的红鳍东方鲀幼鱼, 每个方形槽中放入10尾幼鱼, 分别在3h、6h、12h、24h、48h和72h取样, 每个时间点每个盐度组取6尾幼鱼, 麻醉后取其鳃和肾, 液氮速冻, ‒80℃保存备用。
RNA提取及cDNA合成 根据动物组织总RNA提取试剂盒(天根生化科技有限公司)说明书, 提取红鳍东方鲀鳃、肌肉、脑、肠、肝及肾组织总RNA。采用微量分光光度计和1%琼脂糖凝胶电泳分别对其进行浓度测定和质量分析。质量和浓度检测合格的RNA用于后续试验。总RNA经DNaseⅠ(大连宝生物工程有限公司)处理去除基因组污染后, 每个样品均取1 μg总RNA, 按照反转录试剂盒(大连宝生物工程有限公司)说明书以10 μL体系进行反转录合成cDNA第一链。将反转录产物置于−20℃冰箱保存。
GPI基因扩增及序列测定 根据本实验室前期获得的红鳍东方鲀鳃低盐转录组中已有GPI序列, 利用Primer premier 5.0设计两对特异性引物(表 1), 以红鳍东方鲀鳃组织cDNA第一链为模板进行PCR, 分别扩增获得GPI基因片段序列。PCR反应程序为: 94℃预变性5min; 94℃变性30s; 58℃/56℃退火30s; 72℃延伸1min, 共35个循环; 72℃终延伸10min; 4℃终止反应。PCR产物经1% (w/v)琼脂糖凝胶电泳检测后用胶回收试剂盒分别回收目的片段。将回收产物与pMD18-T载体连接, 连接产物转化至大肠杆菌DH5α感受态细胞中, 挑取阳性克隆送至生工生物工程(上海)股份有限公司进行测序。
表 1 基因扩增及荧光定量PCR所用引物序列Table 1. Primers used for gene cloning and qPCR基因名称
Gene name引物序列
Primer sequence (5′-3′)用途
PurposeGPI F1: TAGGTCACACCGAGCACAGCA 基因克隆 R1: ACCCAATCCCAAAACTCAAAC F2: TTTGAGGCAGATAAGGAGAGAT R2: GATGGTCATAATGAGGAGGAGA qF: GCCCTTCTGCCCTATGAT 荧光定量PCR qR: CACGCACTCCCTGACTTG β-actin qF: ATCCGTAAGGACCTGTATGC 荧光定量PCR qR: AGTATTTACGCTCAGGTGGG 基因序列生物信息学分析 利用DNAstar软件对所得序列进行拼接获得红鳍东方鲀GPI cDNA序列。运用DNAMAN软件分析其编码的氨基酸序列; 用生物信息学网站NCBI的在线功能BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)工具和DNAMAN软件对序列进行同源性比对和相似性分析; 运用ExPASy TMHMM (http://www.cbs.dtu.dk/services/TMHMM-2.0/)进行跨膜区预测; 利用SignalP4.0 Server (http://www.cbs.dtu.dk/services/SignalP/)对GPI基因编码的氨基酸序列进行N端信号肽结构预测; 用ExPASy prosite (http://prosite.expasy.org/)工具对氨基酸序列进行结构域预测; 使用MEGA7.0, 邻位相连法构建进化树, 所用物种GPI序列均从GenBank下载。
荧光定量PCR 检测GPI基因表达差异 根据红鳍东方鲀的GPI和β-actin序列, 应用Primer Premier 5.0设计荧光定量引物(表 1), 引物由生工生物工程(上海)股份有限公司合成。用普通PCR筛选出条带单一且无二聚体的引物, 然后通过荧光定量PCR检测引物的特异性, 挑选条带单一且特异性好的引物进行荧光定量PCR实验。取红鳍东方鲀幼鱼鳃、肌肉、脑、肠、肝及肾等组织、低盐胁迫前后cDNA, 调整样品浓度, 以β-actin为内参引物[12], 配置20 μL反应体系, 检测GPI在红鳍东方鲀不同组织、不同盐度胁迫不同时间下的表达水平。反应条件为95℃预变性10min; 95℃变性15s; 60℃延伸1min, 共40个循环。检测每份样品中GPI基因和β-actin基因的Ct值, 然后根据相对表达量(Relative quantity, RQ)=2−ΔΔCt [13]计算, 不同组织选用鳃相对表达量为对照; 不同盐度胁迫选用盐度32‰红鳍东方鲀幼鱼GPI相对表达量作为对照。
2. 结果
2.1 红鳍东方鲀GPI基因序列特征及其编码蛋白的结构分析
经过拼接得到的红鳍东方纯GPI基因长度为1736 bp, 包含一个完整ORF。ORF长度为1662 bp, 编码553个氨基酸。利用SignalP 4.0在线工具预测发现, 该氨基酸序列不存在信号肽。跨膜结构预测结果显示, GPI没有跨膜区, 属于胞浆蛋白。NCBI保守结构域预测结果显示, GPI基因存在2个糖异构域(Sugar isomerase domains), 分别为SIS-PGI-1和SIS-PGI-2。
2.2 红鳍东方鲀GPI氨基酸序列的多序列比对及系统进化分析
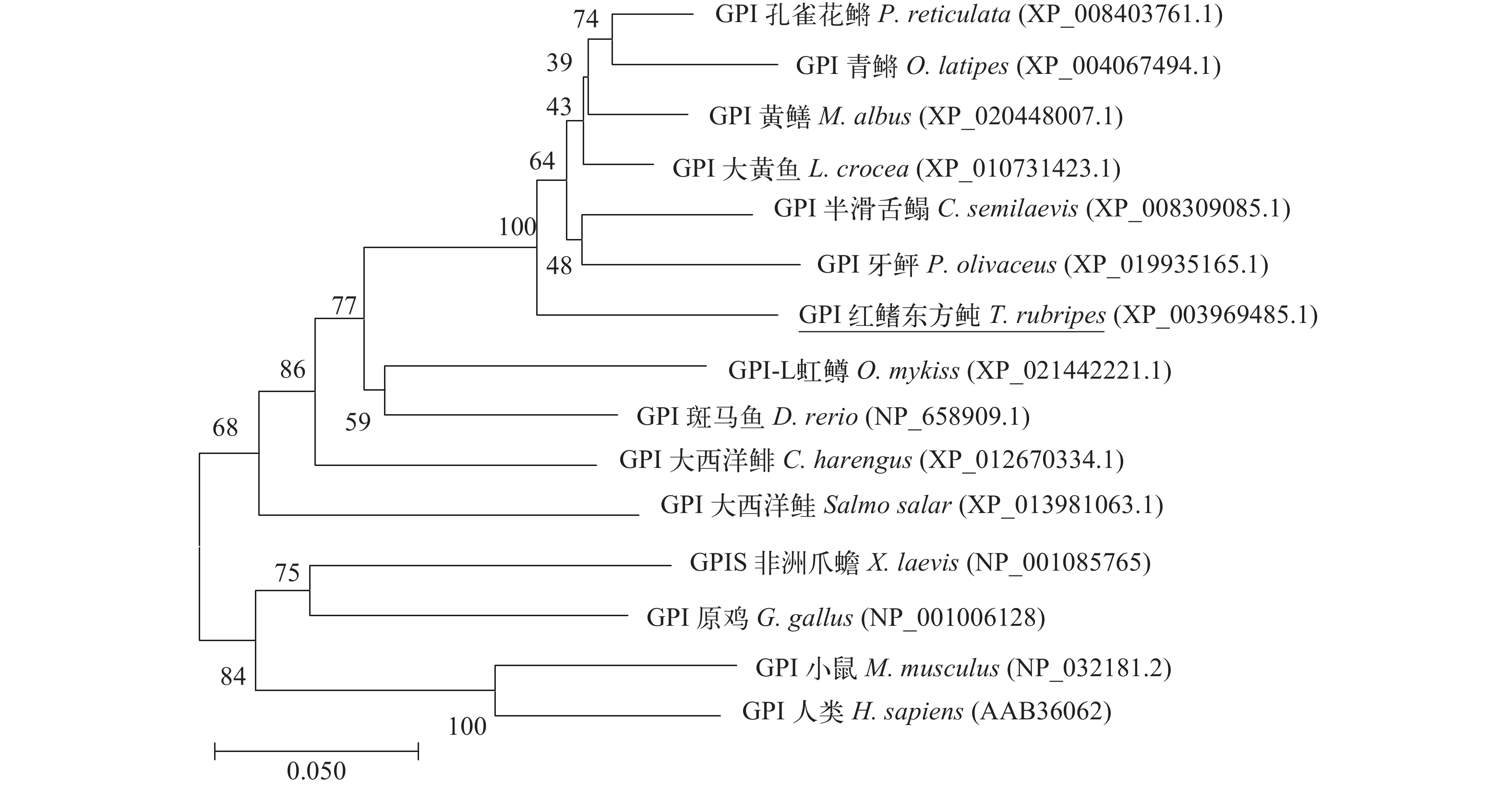
运用DNAMAN软件将GPI蛋白序列与斑马鱼Danio rerio、非洲爪蟾Xenopus laevis、人类Homo sapiens、原鸡Gallus gallus等物种的GPI蛋白序列进行比对, 结果显示, 红鳍东方鲀GPI与各物种相似性分别为85%、77%、76%、和77%。在此基础上, 利用MEGA7.0构建红鳍东方鲀和其他物种GPI氨基酸序列的系统进化树(图 1), 结果显示, 鱼类GPI单独聚为一支, 非洲爪蟾、原鸡GPI与人类、小鼠的GPI聚为另一个分支。在鱼类分支中, 红鳍东方鲀GPI与孔雀花鳉、青鳉、黄鳝、大黄鱼、半滑舌鳎和牙鲆GPI聚为一个小分支。
2.3 红鳍东方鲀幼鱼GPI的组织差异表达分析
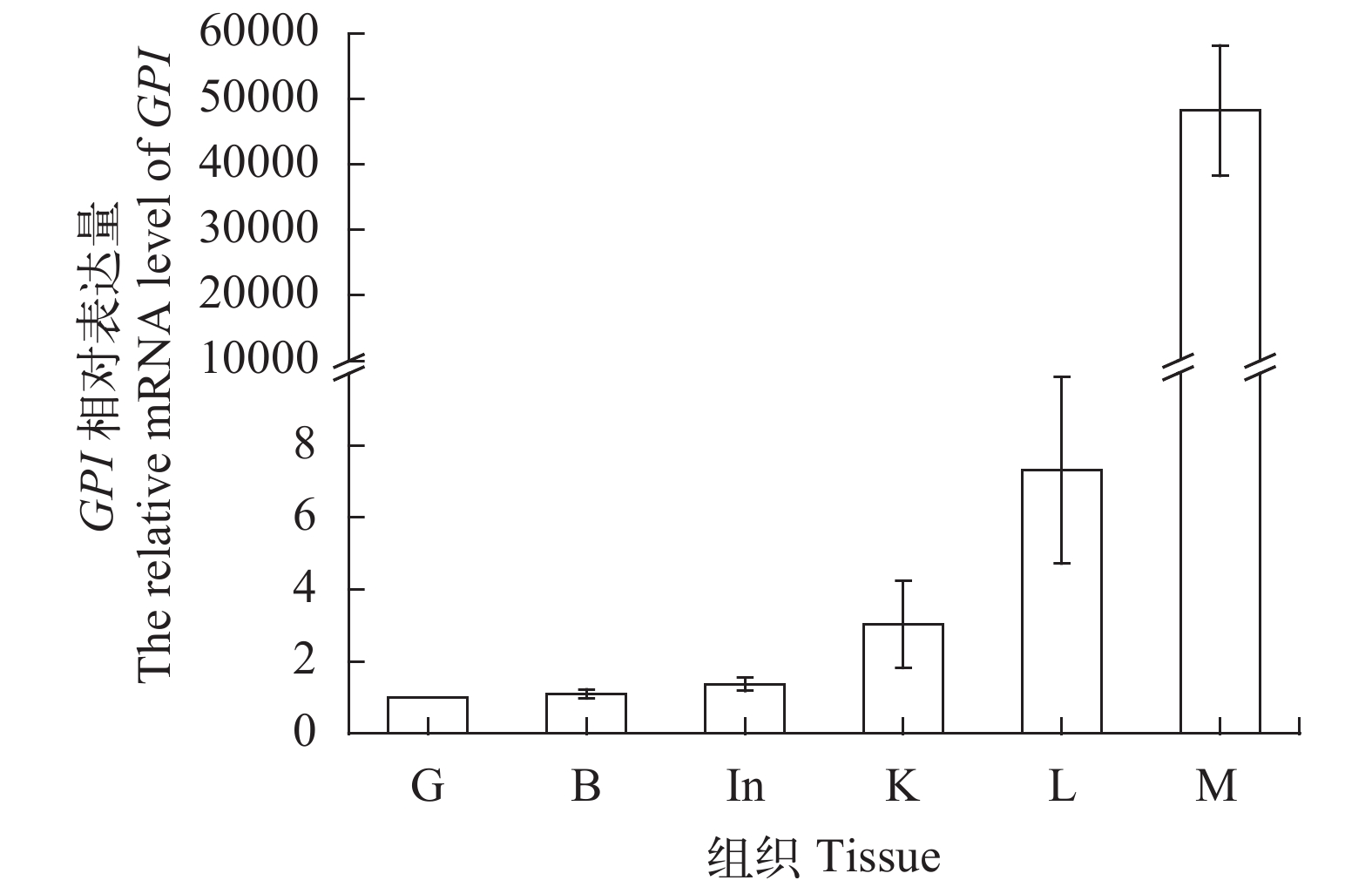
运用qPCR技术检测GPI基因在红鳍东方鲀鳃、肌肉、脑、肠、肝和肾中的表达情况, 结果显示GPI基因在各组织中均有表达。其中, 肌肉中表达量最高, 以鳃中的表达量作为基准1, 肌肉中GPI表达量接近50000, 远远高于其他各组织中的表达量。其他各组织中GPI表达量由高到低依次为: 肝>肾>肠>脑>鳃(图 2)。
2.4 低盐胁迫后红鳍东方鲀GPI基因的表达
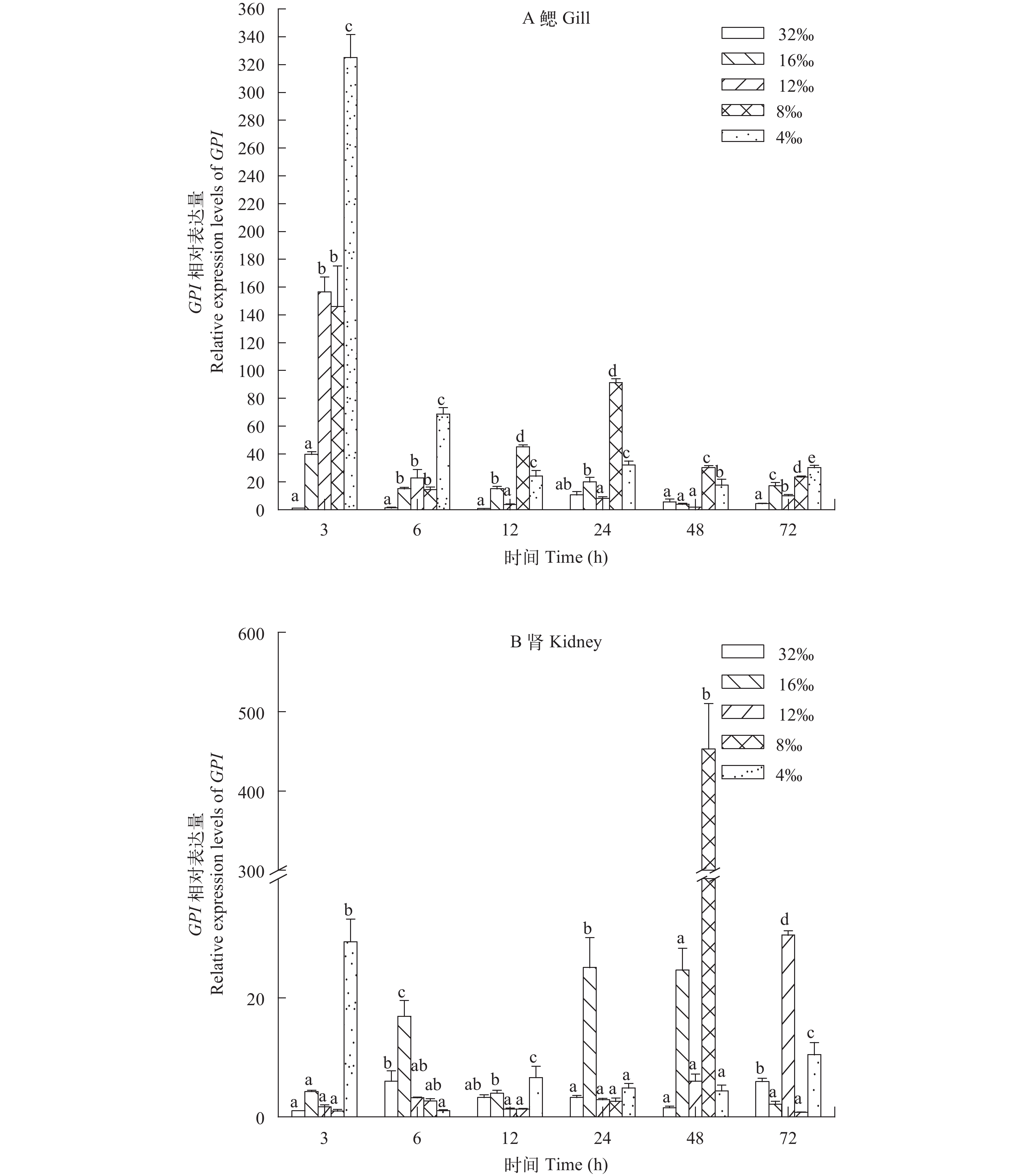
利用荧光定量PCR方法分析不同盐度胁迫下红鳍东方鲀GPI基因在鳃和肾中的表达情况, 在鳃中(图 3A), 各低盐组GPI均在3h时即上调表达, 其中盐度4‰、8‰和12‰组显著上调(P<0.05)。6h时, 16‰组GPI表达量仍继续上调, 与对照组达到显著差异(P<0.05), 其余各组表达水平有所回落, 但与对照组相比, 仍处于显著上调(P<0.05)。12h之后各低盐组GPI在不同时间点开始表达量有所下降, 之后又回升, 至72h时各低盐组与对照组相比, GPI均显著上调表达(P<0.05)。在肾中(图 3B), 各低盐组GPI相对表达量变化趋势各有不同。盐度4‰组GPI相对表达量在3h时即显著上调, 之后经过波动, 至72h时表达量又呈现显著上调(P<0.05)。盐度16‰组GPI在6h时显著上调, 之后持续保持上调状态, 至72h时表达量显著下调(P<0.05)。盐度8‰组在24h内表达量与对照组相比没有显著差异, 48h时GPI才出现显著上调(P<0.05), 72h时表达量又呈现显著下调(P<0.05)。盐度12‰组在48h内表达量与对照组相比没有显著差异, 72h时出现显著上调(P<0.05)。
![]() 图 3 在不同盐度胁迫下红鳍东方鲀GPI基因mRNA在鳃(A)和肾(B)中相对表达量图中不同字母表示同一时间下低盐组与对照组的差异显著(P<0.05)Figure 3. Relative mRNA level of GPI gene in gill (A) and kidney (B) of Takifugu rubripes under different salinitiesDifferent letters denote significant differences between low-salinity groups and the control group at the same time point (P<0.05)
图 3 在不同盐度胁迫下红鳍东方鲀GPI基因mRNA在鳃(A)和肾(B)中相对表达量图中不同字母表示同一时间下低盐组与对照组的差异显著(P<0.05)Figure 3. Relative mRNA level of GPI gene in gill (A) and kidney (B) of Takifugu rubripes under different salinitiesDifferent letters denote significant differences between low-salinity groups and the control group at the same time point (P<0.05)3. 讨论
本研究首次从红鳍东方鲀中克隆获得了GPI基因的cDNA ORF全长序列, 并解析了该基因在急性低盐胁迫下的表达模式, 为进一步解读其他鱼类GPI对急性低盐胁迫的响应及其潜在的分子机制奠定了重要基础。NCBI保守结构域预测结果显示, 所获cDNA序列推导的氨基酸序列存在2个糖异构域, 分别为SIS-PGI-1和SIS-PGI-2, 初步证实了所获序列为红鳍东方鲀GPI基因cDNA序列。通过将红鳍东方鲀GPI基因的氨基酸序列与其他已登记在GenBank上的GPI氨基酸序列进行序列比对后, 我们发现其与斑马鱼Danio rerio GPI序列相似性达到85%, 与两栖类非洲爪蟾GPI相似性达到77%、鸟类原鸡GPI相似性为78%, 和哺乳类人类GPI相似性为77%, 进一步证实了所获序列为红鳍东方鲀GPI基因cDNA序列, 同时也表明GPI在进化上高度保守, 在不同物种中可能具有相似的生物学功能。系统进化树显示鱼类GPI单独聚为一支, 非洲爪蟾、原鸡GPI与人类、小鼠的GPI聚为另一个分支(图 1)。因此可以认为GPI的基因进化有不同的方向。
qPCR结果显示, 红鳍东方鲀GPI基因在鳃、肌肉、脑、肠、肝及肾等组织中均有表达, 且在肌肉中表达量远大于其他各组织(图 2)。一方面, GPI的主要功能是催化糖酵解过程中6-磷酸葡萄糖与6-磷酸果糖之间的相互转化, 从而为机体提供能量[1]。肌肉中含有较多的GPI, 可能和其生理活动需要较多的能量有关; 另一方面, GPI在鱼类肌肉中具有其他的功能。近年, 从白姑鱼肌肉中分离出一种内源性的肌原纤维结合型丝氨酸蛋白酶抑制剂(Myofibril-bound serine proteinase inhibitor, MBSPI), 且与猪的GPI具有高度的同源性, 表明其可能是白姑鱼的GPI[14]。孙乐常[15]研究显示, 鲫GPI对肌原纤维的降解有较明显的抑制作用, 其中肌球蛋白重链、肌动蛋白、原肌球蛋白的降解都得到了有效抑制, 表明多功能蛋白质GPI作为一种内源性的MBSP抑制剂可能对鱼体肌肉的新陈代谢起着重要的调节作用。因此, GPI在组织中的表达情况, 可能与各组织的不同功能有关。
鱼类生活在各种不同的环境中, 由于海水和淡水中所含盐分的数量, 与鱼体液所含盐分的数量不大相同, 为了保证恒定的渗透压, 必须具备渗透压调节的能力[16—18]。广盐性鱼类具有较强的渗透压调节能力, 使其能够适应较大范围的盐度变化。而渗透压调节是一个消耗能量非常大的过程, 研究表明, 在渗透调节过程中, 鳃和肾等重要的渗透压调节组织器官中的糖代谢作用会有所增强, 以满足组织器官对于能量的需求[19]。Kidder等[20]也证实鳉鱼需要消耗总能量的6%—10%用于渗透压调节。崔文晓[21]通过转录组测序技术, 筛选大菱鲆在不同盐度下的差异基因, 结果发现糖酵解相关基因出现上调表达。房子恒等[22]的研究也表明, 在低盐驯化后, 半滑舌鳎幼鱼肾脏和鳃内糖代谢酶HK、PK、SDH和MDH活力升高, 表明这些组织中的糖代谢确实由于渗透调节压力的增大而有所增强。糖酵解作用是鱼体葡萄糖分解的重要途径之一。GPI的主要功能是催化糖酵解过程中6-磷酸葡萄糖与6-磷酸果糖之间的相互转化[1]。由于鳃和肾是鱼类渗透压调节的主要器官, 因此, 本研究以这2个组织为研究对象, 利用qPCR检测GPI mRNA的表达水平, 结果显示, 在急性低盐胁迫72h内, 红鳍东方鲀鳃和肾中GPI的表达量均发生变化(图 3)。在鳃中(图 3A), 各低盐组GPI相对表达量均在3h时即出现上调表达, 总体呈现先升高后降低又回升的趋势, 但除12‰组和16‰组个别时间点外, 其余与对照组相比, 均呈显著上调(P<0.05)。这与上述其他研究的结果相似, 表明在急性低盐胁迫下, 红鳍东方鲀鳃中糖代谢增强, 用于产生更多的能量以支持其渗透压调节过程来适应环境盐度的变化[19—22]。在肾中(图 3B), 各低盐组GPI相对表达量变化趋势各有不同。盐度8‰组和盐度12‰组在24h内GPI表达量与对照组相比没有显著差异, 盐度8‰组48h时GPI显著上调, 72h时表达量又呈现显著下调(P<0.05), 盐度12‰组48h时GPI与对照组没有显著差异, 72h时出现显著下调(P<0.05)。有研究指出, 对半滑舌鳎进行低盐驯化后, 在盐度为10‰条件下, 其肝脏中葡萄糖含量低于淡水、盐度5‰、盐度20‰和盐度30‰[22]。而当周围水体盐度发生变化时, 鱼类肝脏中糖原可分解为葡萄糖, 向鳃、肾等渗透压调节组织器官输送葡萄糖[23, 24], 为鱼体的渗透压调节提供能量, 故推测当盐度为10‰时, 可能由于在等渗条件下机体对葡萄糖的需求量较低导致肝脏中葡萄糖含量低于其他盐度条件[22]。在本研究中盐度8‰组和盐度12‰组GPI表达量在24h保持在相对低水平, 且在72h出现显著下调, 可能由于在这两个盐度下, 外界水环境渗透压与鱼类渗透压较为接近, 因而肾脏用于渗透压调节的能量需求较低所致。盐度4‰组GPI相对表达量在3h时即显著上调, 之后经过波动, 至72h时表达量又呈现显著上调(P<0.05)。在低盐条件下鱼类的肾脏为避免体内离子的过度流失, 肾脏对水分的滤过作用增强, 而对离子的重吸收作用会提高[16, 22]。因此, 在本研究中, 在盐度4‰条件下, 可能由于周围水环境的盐度远低于鱼体渗透压, 因而肾脏表现出较强的离子重吸收能力并加强水分的滤过作用, 消耗的能量增加, 故GPI表达量升高, 用于表达出更多的GPI蛋白, 以参与糖酵解作用产生更多的能量。
综上所述, GPI基因参与红鳍东方鲀对急性低盐胁迫的响应, 进而增强其对低盐的适应性。本实验的结果可为进一步研究红鳍东方鲀的渗透压调节机制提供基础材料。
-
图 3 在不同盐度胁迫下红鳍东方鲀GPI基因mRNA在鳃(A)和肾(B)中相对表达量
图中不同字母表示同一时间下低盐组与对照组的差异显著(P<0.05)
Figure 3. Relative mRNA level of GPI gene in gill (A) and kidney (B) of Takifugu rubripes under different salinities
Different letters denote significant differences between low-salinity groups and the control group at the same time point (P<0.05)
表 1 基因扩增及荧光定量PCR所用引物序列
Table 1 Primers used for gene cloning and qPCR
基因名称
Gene name引物序列
Primer sequence (5′-3′)用途
PurposeGPI F1: TAGGTCACACCGAGCACAGCA 基因克隆 R1: ACCCAATCCCAAAACTCAAAC F2: TTTGAGGCAGATAAGGAGAGAT R2: GATGGTCATAATGAGGAGGAGA qF: GCCCTTCTGCCCTATGAT 荧光定量PCR qR: CACGCACTCCCTGACTTG β-actin qF: ATCCGTAAGGACCTGTATGC 荧光定量PCR qR: AGTATTTACGCTCAGGTGGG -
[1] Kao H W, Lee S C. Phosphoglucose isomerases of hagfish, zebrafish, gray mullet, toad, and snake, with reference to the evolution of the genes in vertebrates [J]. Molecular Biology & Evolution, 2002, 19(4): 367—374
[2] Repiso A, Andrés R, Climent F, et al. Expression patterns in mouse embryos of neuroleukin/glucose-6-phosphate isomerase and autocrine motility factor receptor [J]. Anatomia Histologia Embryologia, 2008, 37(5): 380—382 doi: 10.1111/ahe.2008.37.issue-5
[3] Xu W, Seiter K, Feldman E, et al. The differentiation and maturation mediator for human myeloid leukemia cells shares homology with neuroleukin or phosphoglucose isomerase [J]. Blood, 1996, 87(11): 4502
[4] Gurney M E, Heinrich S P, Lee M R, et al. Molecular cloning and expression of neuroleukin, a neurotrophic factor for spinal and sensory neurons [J]. Science, 1986, 234(4776): 566—574 doi: 10.1126/science.3764429
[5] Liotta L A, Mandler R, Murano G, et al. Tumor cell autocrine motility factor [J]. Proceedings of the National Academy of Sciences of the United States of America, 1986, 83(10): 3302—3306 doi: 10.1073/pnas.83.10.3302
[6] Niinaka Y, Harada K, Fujimuro M, et al. Silencing of autocrine motility factor induces mesenchymal to epithelial transition and suppression of osteosarcoma pulmonary metastasis [J]. Cancer Research, 2010, 70(22): 9483—9493 doi: 10.1158/0008-5472.CAN-09-3880
[7] Kugler W, Breme K, Laspe P, et al. Molecular basis of neurological dysfunction coupled with haemolytic anaemia in human glucose-6-phosphate isomerase (GPI) deficiency [J]. Human Genetics, 1998, 103(4): 450—454 doi: 10.1007/s004390050849
[8] Niinaka Y, Paku S, Haga A, et al. Expression and secretion of neuroleukin/phosphohexose isomerase/maturation factor as autocrine motility factor by tumor cells [J]. Cancer Research, 1998, 58(12): 2667—2674
[9] 陈锋, 江训良, 谢小兵, 等. 血清葡萄糖-6-磷酸异构酶(GPI)与自身免疫性疾病(AID)相关性研究. 实用预防医学, 2009, 16(1): 235—237 doi: 10.3969/j.issn.1006-3110.2009.01.105 Chen F, Jiang X L, Xie X B, et al. Correlation between serum Glucose-6-phosphate Isomerase (GPI) and Autoimmune Disease (AID) [J]. Practical Preventive Medicine, 2009, 16(1): 235—237 doi: 10.3969/j.issn.1006-3110.2009.01.105
[10] Sun L C, Zhou L G, Du C H, et al. Glucose-6-phosphate isomerase is an endogenous inhibitor to myofibril-bound serine proteinase of crucian carp (Carassius auratus) [J]. Journal of Agricultural and Food Chemistry, 2009, 57: 5549—5555 doi: 10.1021/jf9004669
[11] 王奎旗, 陈梅, 高天翔. 东方鲀属鱼类的分类与区系分布研究. 青岛海洋大学学报, 2001, 31(6): 855—860 doi: 10.3969/j.issn.1672-5174.2001.06.024 Wang K Q, Chen M, Gao T X. Study on taxonomy and fauna of Takifugu [J]. Journal of Ocean University of Qingdao, 2001, 31(6): 855—860 doi: 10.3969/j.issn.1672-5174.2001.06.024
[12] 孙梦蕾, 吕绘倩, 暴宁, 等. 急性低盐胁迫下红鳍东方鲀幼鱼IgM、NKCC1和Hsp70基因的表达. 中国水产科学, 2017, 24(1): 65—72 Sun M L, Lü H Q, Bao N, et al. IgM, NKCC1, and Hsp70 gene expression in juvenile Takifugu rubripes under acute low-salinity stress [J]. Journal of Fishery Sciences of China, 2017, 24(1): 65—72
[13] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) method [J]. Methods, 2001, 25(4): 402—408 doi: 10.1006/meth.2001.1262
[14] Cao M J, Osatomi K, Matsuda R, et al. Purification of a novel serine proteinase inhibitor from the skeletal muscle of white croaker (Argyrosomus argentatus) [J]. Bioche-mical & Biophysical Research Communications, 2000, 272(2): 485
[15] 孙乐常. 鲫鱼肌原纤维结合型丝氨酸蛋白酶内源性抑制剂的研究. 厦门: 集美大学. 2009 Sun L C. Study of a endogenous inhibitor to myofibril-bound serine proteinase of crucian carp (Carassius auratus) [D]. Xiamen: Jimei University. 2009
[16] 苏锦祥. 鱼类学与海水鱼类养殖. 第2版. 北京: 中国农业出版社. 2003, 88—90 Su J X. Ichthyology and Marine Fish Culture [M]. 2nd edition. Beijing: China Agricultural Press. 2003, 88—90
[17] 罗鸣钟, 关瑞章, 靳恒. 盐度对花鳗鲡和太平洋双色鳗鲡幼鳗生长性能及消化酶活力的影响. 水生生物学报, 2015, 39(4): 653—660 Luo M Z, Guan R Z, Jin H. Effects of the salinity on the growth performance and digestive enzyme activities of Anguilla marmorata elver and A. bicolor pacifica elver [J]. Acta Hydrobiologica Sinica, 2015, 39(4): 653—660
[18] 郭勤单, 王有基, 吕为群. 温度和盐度对褐牙鲆幼鱼渗透生理及抗氧化水平的影响. 水生生物学报, 2014, 38(1): 58—67 Guo Q D, Wang Y J, Lü W Q. Combined effects of temperature and salinity on the physiological osmotic induction and antioxidant responses in the juvenile japanese flounder (Paralichthys olivaceus) [J]. Acta Hydrobiologica Sinica, 2014, 38(1): 58—67
[19] Kirschner L B. The energetics of osmotic regulation in ureotelic and hypoosmotic fishes [J]. Journal of Experimental Zoology Part A Ecological Genetics & Physio-logy, 1993, 267(1): 19—26
[20] Kidder G W, Petersen C W, Preston R L. Energetics of osmoregulation: II. Water flux and osmoregulatory work in the euryhaline fish, Fundulus heteroclitus [J]. Journal of Experimental Zoology Part A Ecological Genetics & Physiology, 2006, 305A(4): 318—327
[21] 崔文晓. 大菱鲆(Scophthalmus maximus)盐度胁迫转录组构建及相关功能基因研究. 上海: 上海海洋大学. 2017 Cui W X. Construction of transcriptome under salinity stress and research of related functional genes on Turbot (Scophthalmus maximus) [D]. Shanghai: Shanghai Ocean University. 2017
[22] 房子恒, 田相利, 董双林. 低盐驯化对半滑舌鳎幼鱼生长、渗透生理及糖代谢酶活力影响的研究. 中国海洋大学学报(自然科学版), 2016, 46(8): 19—27 Fang Z H, Tian X L, Dong S L. The growth performance, osmotic physiology and carbohydrate metabolism acti-vity of juvenile Cynoglossus semilaevis acclimated to low salinity water [J]. Periodical of Ocean University of China, 2016, 46(8): 19—27
[23] Sangiao-Alvarellos S, Laiz-Carrión R, Guzmán J M, et al. Acclimation of S. aurata to various salinities alters energy metabolism of osmoregula-tory and nonosmoregulatory organs [J]. American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2003, 285(4): 897—907 doi: 10.1152/ajpregu.00161.2003
[24] Sangiao-Alvarellos S, Arjona F J, Martin del Rio M P, et al. Time course of osmoregulatory and metabolic changes during osmotic acclimation in Sparus auratus [J]. Journal of Experimental Biology, 2005, 208(22): 4291—4304 doi: 10.1242/jeb.01900
-
期刊类型引用(3)
1. 段永强,刘洪岩,王明华,钟立强,苏超凡,刘炬,陈校辉,张世勇. 盐度胁迫对斑点叉尾鮰幼鱼生长及组织酶活性的影响. 中国农学通报. 2025(05): 143-150 .  百度学术
百度学术
2. 张文馨,潘霞,沈锡权,徐永健. 盐度胁迫对幼体大海马基因转录表达的影响. 水生生物学报. 2021(05): 995-1004 .  本站查看
本站查看
3. 欧阳霞辉,徐文凯,郑相相,彭帅,刘丽霞. 意大利蜜蜂amPGI基因的克隆与表达分析. 西北农业学报. 2021(12): 1854-1862 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: