CLONING, EXPRESSION ANALYSIS AND LOCALIZATION OF NEUROPEPTIDE SCAP IN SEPIELLA JAPONICA
-
摘要: 为研究曼氏无针乌贼(Sepiella japonica)小心激肽(small cardioactive peptides, sCAP)生理功能, 通过RACE技术克隆曼氏无针乌贼sCAP基因(简称SjsCAP, GenBank登录号:MG779491), 得到总长度为696 bp的cDNA序列, 包括111 bp的5′非编码区(UTR)和324 bp的3′UTR, 预测的开放阅读框(ORF)共261 bp, 编码86个氨基酸, 相对分子量(MW)为9.331 kD, 等电点(pI)为8.52。信号肽以及跨膜区预测结果表明, sCAP中含有明显的信号肽序列和跨膜区结构。因此, 推测该蛋白可能由细胞内分泌到细胞外发挥作用。亲水性分析显示该蛋白为亲水性蛋白。基于sCAP氨基酸序列进行的系统进化分析表明曼氏无针乌贼与商乌贼(Sepia officinalis)亲缘关系最近, 相似性达到90%。通过荧光定量PCR (Quantitative real-time PCR, qRT-PCR)技术对SjsCAP基因在成熟雄性和雌性曼氏无针乌贼不同组织中的表达量进行分析, 结果显示sCAP主要在视叶中显著表达, 在脑中也有较高的表达量, 其中雄性个体表达量显著高于雌性个体。原位杂交实验结果显示sCAP基因在曼氏无针乌贼的脑组织的视叶、食道上神经团的垂直叶、亚垂直、脑脚叶、背外侧叶和视腺均可以观察到明显的阳性杂交信号。sCAP基因的成功克隆以及组织表达定位分析为sCAP的亚细胞定位以及生物学功能研究奠定一定的基础, 同时为曼氏无针乌贼的种质资源保护与开发提供一定的理论支持。Abstract: sCAP could stimulate heart movement and contraction of muscle and fallopian tube, enhance posterior bowel contraction and participate in biological molting. This study identified the sCAP gene (GenBank accession No. MG779491) from Sepiella japonica as SjsCAP. We cloned a 696 bp full-length cDNA sequence of SjsCAP gene by RT-PCR and RACE techniques including 111 bp 5′ untranslated region (UTR), 324 bp 3′UTR, and 261 bp open reading frame (ORF) encoding a protein with 86 amino acids. The molecular weight of the protein was 9.331 kD and its pI was 8.52. The prediction of signal peptides and transmembrane domain indicated that SjsCAP might play an important role in extracellular. The protein is hydrophilic. Phylogenetics analysis based on SjsCAP amino acid sequences demonstrated that S. japonica has the closest relationship with Sepia officinalis with a 90% similarity. Expression analysis of SjsCAP gene in male and female individuals showed that it mainly expressed in optic lobe and also has the high expression in the brain. The expression level in male was obviously higher than that of female cuttlefish. The results of in situ hybridization assay showed that significant positive hybridization signals were detected in the optic lobe of the brain tissue of S. japonica, the vertical lobe, subvertical lobe, peduncle lobe, dorsolateral lobe of the esophageal nerve mass, and optic gland. These results provide some theoretical basis for genetic resource conservation and development of S. japonica.
-
神经肽是调节动物生理活动的小分子多肽[1]。大量研究表明神经肽在许多软体动物特别是头足纲动物的生理调节中发挥重要作用[2]。然而, 目前关于头足类神经肽的研究主要集中在如GnRH、FaRPs和APGWamide等小分子多肽方面[3], 而在生理调节过程中意义重大的小分子肽——小心激肽(Small cardioactive peptide, sCAP)的研究较少。sCAP在刺激心脏运动[4]、控制肌肉收缩[5]、输卵管收缩、增强后肠收缩[6]及生物蜕皮等生理过程中有重要作用[7]。sCAP最初发现于长蛸(Octopus minor)的脑组织中, 有Ocp-1、Ocp-2、Ocp-3和Ocp-4四种类型[8]。其相关类似物oct-SCPRP也被发现于真蛸(Octopus vulgaris)中, 具有收缩齿舌牵拉肌的作用[9]。有研究表明Ocp-1和Ocp-2是非洲大蜗牛(Achatina fulica)中Achatin-1的同源基因产物, Ocp-1可通过影响脉红螺(Rapana venosa)中谷氨酸含量刺激心脏收缩[3, 10]。综上, 开展sCAP及其生理功能研究具有重要意义。
曼氏无针乌贼(Sepiella japonica)是一种具有很高的营养价值和药用价值的经济头足类, 曾经是东海“四大海产”之一[11]。20世纪70年代以后, 曼氏无针乌贼种质资源出现衰退, 产量明显下降, 为保护这一珍贵物种, 开展其人工繁育就显得尤为重要[12]。本研究团队在前期大量研究的基础上, 采用cDNA末端快速克隆的技术(RACE)克隆获得曼氏无针乌贼sCAP基因的cDNA全长序列并开展生物信息学分析;采用荧光定量PCR(qRT-PCR)技术研究sCAP基因在曼氏无针乌贼雌性和雄性个体不同组织中表达的差异性;采用原位杂交(in situ hybridization, ISH)技术对曼氏无针乌贼sCAP基因mRNA在脑组织中进行细胞定位, 进而推测sCAP基因在曼氏无针乌贼中的可能生理功能, 并为曼氏无针乌贼的种质资源保护和开发奠定一定理论基础。
1. 材料与方法
1.1 实验材料
实验选取性成熟时期的健康、活力强的曼氏无针乌贼(80—100 g)[13], 从浙江温州苍南头足类苗种繁育基地取样, 活体解剖心、脑、视叶、肌肉、胰、胃、肠、肝、鳃、性腺(精巢和卵巢)、缠卵腺和副缠卵腺等组织于装有RNA保存液(CWBIO公司)的冻存管中保存, 用干冰运回实验室后–80℃的超低温冰箱中保存备用。体外解剖成熟曼氏无针乌贼的完整脑组织, 立即于暗处置于预冷的4%多聚甲醛溶液中固定过夜, 然后将组织转移至75%乙醇溶液中带回实验室。
1.2 实验方法
总RNA提取以及cDNA第一条链的合成 曼氏无针乌贼各个组织总RNA使用RNAiso Plus (TaKaRa公司)进行提取。2 μg总RNA用于cDNA第一条链的合成, 实验方法参照M-MLV(Rnase H-)反转录试剂盒(TaKaRa公司)说明书方法进行。
曼氏无针乌贼sCAP基因核心序列的克隆 根据NCBI已有的商乌贼(Sepia officinalis, AFS32691.1)和真蛸(AB198190.1)的sCAP基因序列, 设计曼氏无针乌贼sCAP基因核心片段的简并引物, 见表 1中sCAP-F/sCAP-R。
表 1 克隆sCAP基因所用引物Table 1. Primers used in sCAP gene cloning引物名称
Primer name序列
Primer sequences (5′-3′)sCAP-F ATGGMTAYCTKGSRTTGCC sCAP-R ACCWGGGCARCWTTCCWTTCC sCAP-5′ Outer ACCAGGGCAGCTTTCCTTTCC sCAP-5′ Inner GGCAACCCCAGATAGCCAT sCAP-3′ Outer ATGGCTATCTGGGGTTGCC sCAP-3′ Inner TGTTGCGGAATGCCACTAATGAAG 采用25 μL PCR体系根据Premix Taq试剂(TaKaRa公司)说明书进行, PCR产物经过1.2%琼脂糖凝胶电泳检测后送至上海华大基因进行测序。
曼氏无针乌贼sCAP基因cDNA全长的克隆 根据SjsCAP的核心序列设计5′ RACE(sCAP-5′ outer/sCAP-5′ inner, 表 1)和3′RACE(sCAP-3′ outer/sCAP-3′ inner, 表 1)的引物。全长cDNA的扩增根据SMARTTM RACE试剂盒(TaKaRa公司)说明书进行, PCR产物经纯化、连接、转化最后将菌液送至上海华大基因测序。
曼氏无针乌贼sCAP基因cDNA全长序列分析及生物信息学分析 采用DNAMAN软件对测序结果进行拼接分析, 获得SjsCAP基因的全长序列;在NCBI上预测其ORF区;利用在线软件Expasy-ProtParam (http://we-b.expasy.org/protparam/)[14]将其翻译为氨基酸序列并预测蛋白的相对分子量和等电点;采用TMHMM Server v. 2.0 (http://www.cbs.dtu.dk/services/TMHMM/)对sCAP跨膜结构域进行预测;采用SignalIP[15] (http://www.cbs.dtu.dk/service/SignalP/)预测蛋白质序列中的信号肽, 利用NetNGly 1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/)预测蛋白的糖基化位点;利用NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白的磷酸化位点;利用ClustalX[16]将SjsCAP与已知物种的心激肽基因氨基酸序列进行同源性比对;用MrBayes v3.2.6软件[17]采用贝叶斯推理的方法(BI)构建系统进化树。
曼氏无针乌贼sCAP基因的组织表达特异性分析 选取成熟乌贼的组织:脑、视叶、心、鳃、肝、胃、胰、肠、肌肉、性腺(精巢和卵巢)、缠卵腺、副缠卵腺。雌雄各选择3只乌贼做3次生物学重复, 每个个体的每个组织的定量表达做3次机械重复。选择曼氏无针乌贼β-actin基因(JN564496.1)作为内参, 通过qRT-PCR的方法对SjsCAP基因的组织表达特异性进行分析, 选取肌肉组织作为最小参照, 采用2−ΔΔCt方法计算相对表达量, 数据用SPSS软件进行单因素方差分析及T检验, 处理组之间的显著性差异(P<0.05), 用Origin8制图软件绘制图表。引物信息见表 2。
表 2 SjsCAP荧光定量和原位杂交引物Table 2. Primers of SjsCAP used for qRT-PCR and in situ hybridi-zation assay引物名称
Primer name序列
Primer sequences (5′-3′)RT-sCAP-F CCTGTGCTACTTCCCAAAT RT-sCAP-R TCTCATCTCATAACAATCCCT Actin-F TGAGAGGGAGATTGTGCGTG Actin-R GAACATAGATTCTGGAGCACGG A1F CCTGTGCTACTTCCCAAAT A1R GATCACTAATACGACTCACTATAGGGCCTGTGCTACTTCCCAAAT B1F GATCACTAATACGACTCACTATAGGGTCTCATCTCATAACAATCCCT B1R TCTCATCTCATAACAATCCCT 各种组织的总RNA提取和cDNA第一链合成的方法采用实验方法中所述。400 ng的cDNA模版用于qRT-PCR, 加样体系及反应条件按照SYBR Premix Ex TaqTM II Kit (TaKaRa公司)产品说明书操作。
曼氏无针乌贼神经肽sCAP基因脑组织表达定位分析 sCAP原位杂交探针以乌贼脑组织cDNA为模板进行普通PCR扩增, 纯化的探针模板根据探针标记试剂盒(DIG RNA Labeling kit SP6 / T7 kit, 罗氏)说明书进行探针标记。正义探针与反义探针制作方法相同引物为A1F/A1R和B1F/B1R(表 2), 正义探针作为对照组。将成熟曼氏无针乌贼脑组织采用4%多聚甲醛固定过夜, 采用不同浓度酒精梯度脱水、二甲苯透明、浸蜡、包埋、切片。石蜡切片经二甲苯脱蜡、水化后, 蛋白酶K 37℃处理20min。组织切片在42℃杂交液中预杂交1h, 同样温度下与探针杂交过夜, 10% Blocking溶液室温封闭1h, 加1 鲶500稀释的二抗Anti-DIG-AP 4℃过夜, 在室温下NBT/BCIP染色30min, 封片, Olympus CX31显微镜下观察拍照。
2. 结果
2.1 曼氏无针乌贼sCAP基因cDNA全长分析
曼氏无针乌贼神经肽sCAP基因cDNA全长696 bp, 由111 bp的5′ 非编码区(UTR)、编码86个氨基酸的261 bp开放阅读框(ORF)和324 bp的3′-UTR组成, 预测的蛋白质相对分子量(MW)为9.331 kD, 等电点(pI)为8.52。通过在线软件对该蛋白进行生物学信息分析, 该蛋白具有信号肽在1—20号氨基酸位点;含有一个跨膜区域, 7—29号氨基酸为跨膜区域, 含有1个糖基化位点在5号位点;含有6个丝氨酸(Ser)位点, 位于3、7、23、35、72和79号位点, 3个苏氨酸(Thr)位点, 位于18、22和76号位点, 1个酪氨酸(Tyr)位点, 位于24号位点。
2.2 曼氏无针乌贼sCAP同源性分析及系统进化树建立
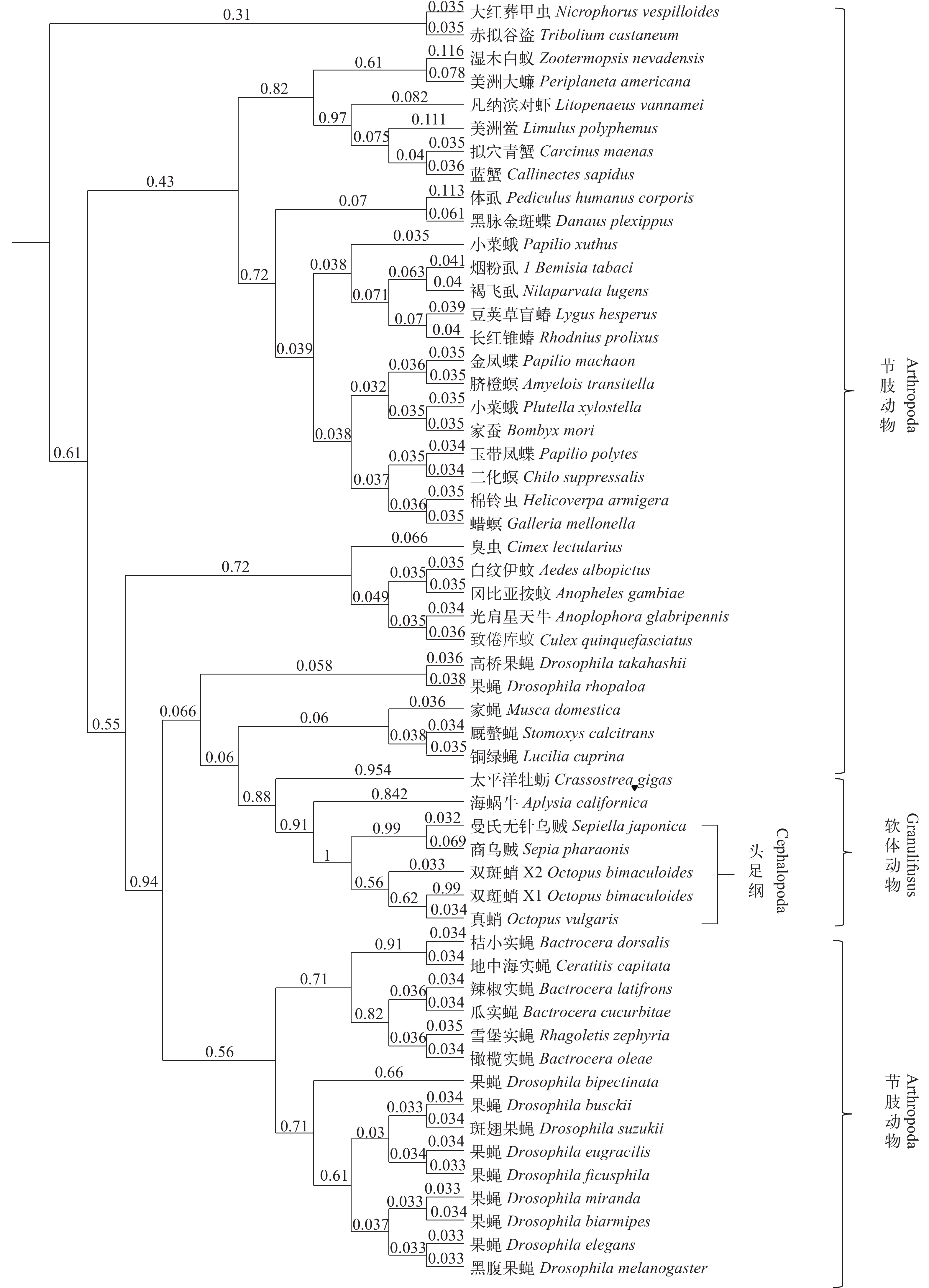
从NCBI选取商乌贼(AFS32691.1)、加州双斑蛸(Octopus bimaculoides, XP_014771607.1)、真蛸(BAE66649.1)、海蜗牛(Aplysia californica, XP_012943902.1)以及太平洋牡蛎(Crassostrea gigas, NP_001292304.1)的sCAP基因氨基酸序列与曼氏无针乌贼sCAP基因氨基酸序列进行对比, 结果表明曼氏无针乌贼sCAP基因与商乌贼同源性最高达到90%, 与加州双斑蛸及真蛸的同源性分别为66%和54%, 与海蜗牛及长牡蛎的同源性低于40%。我们在NCBI中选取了54条已知与sCAP基因有相同功能的其他物种的心激肽氨基酸同源序列, 基于贝叶斯推理方法进行进化树的构建, 在建树时建立4个马尔可夫链, 每100代进行一次抽样, 共运行200万代, 计算后验概率(Posterior probability)。结果表明与曼氏无针乌贼亲缘关系最近的是商乌贼, 其次是加州双斑蛸和真蛸, 与海蜗牛以及太平洋牡蛎等软体动物汇聚为一大支, 与果蝇属等节肢动物的亲缘关系较远(图 1)。
2.3 曼氏无针乌贼sCAP基因组织表达特异性分析
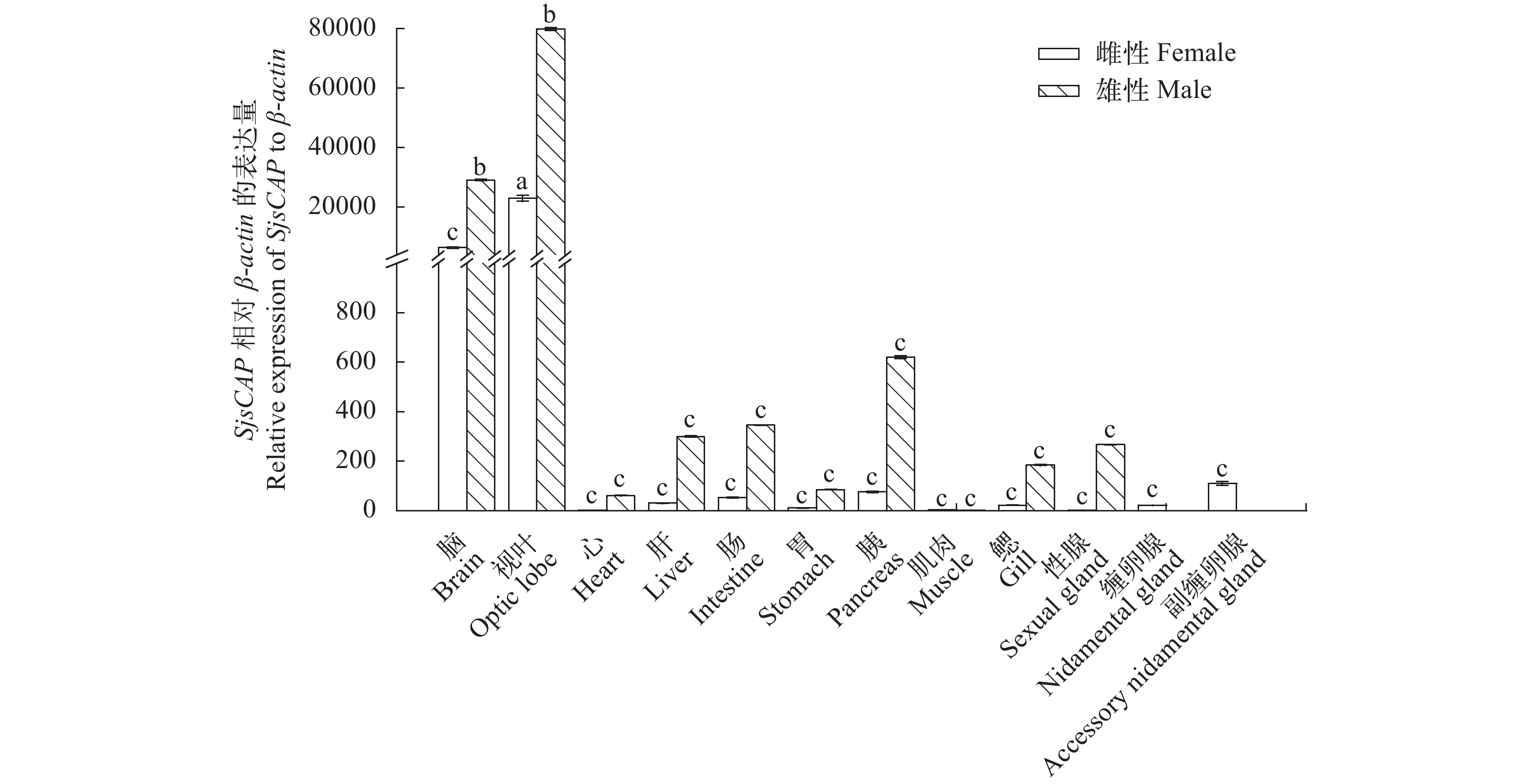
SjsCAP在成熟雌雄个体各个组织中均有一定量表达, 其中在视叶中表达量最高, 脑次之, 在雄性内脏器官胰脏中表达量也较高。在雄性个体中, 视叶和脑与其他组织中SjsCAP表达量具有显著性差异(用abc表示);在雌性个体中视叶的表达量最高且与其他组织有显著性差异。在雌性与雄性视叶组织之间SjsCAP表达量也有显著性差异, 且雄性视叶组织的表达量是雌性的3.4倍。在雌性与雄性脑组织之间SjsCAP表达量也有显著性差异, 且雄性脑组织的表达量是雌性的4.5倍(图 2)。
2.4 曼氏无针乌贼神经肽sCAP基因脑组织表达定位分析
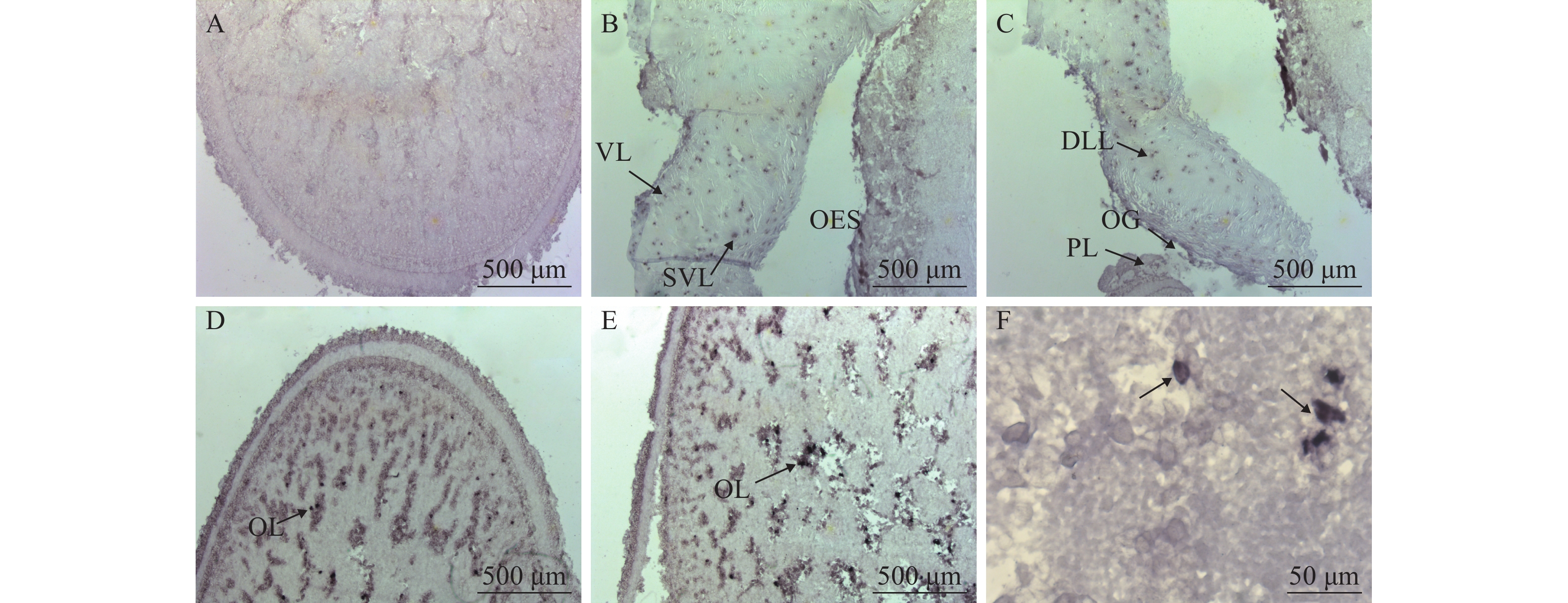
利用原位杂交技术对曼氏无针乌贼sCAP基因mRNA在脑组织中的表达位点进行细胞定位。如图 3所示, 在乌贼脑组织的多个区域均能观察到清晰的sCAP基因mRNA阳性杂交信号, 而用正义探针进行杂交的图 3A中不能观察到信号。乌贼脑组织的3个部分组成:食道上神经团、食道下神经团和视叶[11]。在曼氏无针乌贼脑的食道上神经团的垂直叶及亚垂直叶均能观察的阳性杂交信号(图 3B);在背外侧叶、视腺及脑脚叶也可以观察到阳性杂交信号(图 3C);在视叶细胞中也可观察到较强的阳性杂交信号(图 3D—F)。
![]() 图 3 曼氏无针乌贼sCAP基因mRNA的脑组织原位杂交A. 正义探针对照(视叶); B. 垂直叶(VL), 亚垂直叶(SVL), 食道(OES); C. 背外侧叶(DLL), 视腺(OG), 脑脚叶(PL); D. 视叶; E. 视叶(OL); F. 视叶细胞(40倍镜); 黑色尖头指示阳性区域, 标尺长度标注在图片右下角Figure 3. In situ hybridization of sCAP mRNA in brain of S. japonicaA. a medial sagittal section of the anterior basal lobe stained with the sense sCAP probe; B. vertical lobe (VL), subvertical lobe (SVL), esophagus (OES); C. dorsolateral lobe (DLL), optic gland (OG), peduncle lobe (PL); D. optic lobe; E. optic lobe (OL); F. optic lobe cells for 10×40 times. The black arrows indicate positive signals. Scale bars in the lower right corner of the picture
图 3 曼氏无针乌贼sCAP基因mRNA的脑组织原位杂交A. 正义探针对照(视叶); B. 垂直叶(VL), 亚垂直叶(SVL), 食道(OES); C. 背外侧叶(DLL), 视腺(OG), 脑脚叶(PL); D. 视叶; E. 视叶(OL); F. 视叶细胞(40倍镜); 黑色尖头指示阳性区域, 标尺长度标注在图片右下角Figure 3. In situ hybridization of sCAP mRNA in brain of S. japonicaA. a medial sagittal section of the anterior basal lobe stained with the sense sCAP probe; B. vertical lobe (VL), subvertical lobe (SVL), esophagus (OES); C. dorsolateral lobe (DLL), optic gland (OG), peduncle lobe (PL); D. optic lobe; E. optic lobe (OL); F. optic lobe cells for 10×40 times. The black arrows indicate positive signals. Scale bars in the lower right corner of the picture3. 讨论
本研究首次克隆得到曼氏无针乌贼的sCAP基因的cDNA全长序列, 通过对该基因的生物学信息分析, 我们推测该蛋白是由细胞内分泌到细胞外调节各项生理功能。这些生物信息学分析与蛋白定位、生理功能、信号转导、基因表达调控有关[18]。通过qRT-PCR表达分析, sCAP的表达在雄性及雌性曼氏无针乌贼的视叶中被明显检测到, 其次是脑, 可以推测sCAP是通过控制曼氏无针乌贼的神经系统来控制其活动。sCAP在缠卵腺及副缠卵腺中微量表达说明其可能与输卵管的收缩功能有关[19]。从表达量分析, 雄性个体的表达量明显高于雌性个体, 表达量最显著的视叶组织雄性的表达量与雌性之间也有显著性差异, 可能因为不同性别的组织差异性导致的, 推测该基因在控制雌雄个体生理活动时可能存在性别差异, 还需进一步实验验证。有研究学者用RT-PCR的方法对昆虫中的甲壳类心激肽(Crustacean cardioactive peptide, CCAP)进行了研究, 结果显示其在不同发育阶段都有表达, 表达最多的是在幼虫到蛹过渡的阶段[20]。表达水平波动在几个发育阶段的过程中, 直到发育后期一些细胞依然没有表达[20, 21], 细胞内刺激识别的神经元可以引起心脏运动加速[22, 23]。因此, sCAP在曼氏无针乌贼中不同时期的表达量将作为下一步研究工作。有研究表示小心激肽SCP在静水椎实螺(Lymnaea stagnalis)的内脏和右顶叶神经节以及左侧顶叶神经节中有免疫反应性[24, 25]。有研究表明在烟草天蛾(Manduca sexta)脑中观察到9对细胞被CCAP原位探针标记[26], 同时采用RT-PCR、免疫组化和原位杂交技术在东方果蝇(Bactrocera dorsalis)[27]、凡纳滨对虾(Litopenaeus vannamei)[23]、水蚤(Daphnia longicephala)[28]、长红锥蝽(Rhodnius prolixus)[29]的中枢神经系统检测到CCAP的表达。本文的研究结果也在中枢神经系统中检测到阳性信号, 与上述研究结果一致。
目前有关于心激肽的研究主要集中在甲壳类、昆虫类以及腹足类。黑化诱导神经肽(Corazonin)是从美洲大蠊(American cockroach)中被发现的, 研究表明它可以刺激心脏加速运动[30];CAPs和CAP2是存在于昆虫的中枢神经系统, 也同样具有刺激心脏运动的功能[31], CAP2还参与胚胎发育中肠道运动的调节[32];SCP和SCPB被称为小心激肽, 它们不仅可以刺激心脏运动[4, 33], 还可以控制肌肉的收缩[5];LCP被称为大心激肽, 研究表明它可能具有刺激心脏运动的作用[34];CCAP最初是从三叶真蟹(Carinus maenas)的围心器官中被发现的[35], 它不仅可以刺激心脏运动和参与渗透压调节和淡水适应性[23], 还参与生物的蜕皮[7]、刺激输卵管收缩[6]、增强后肠的收缩[26]、控制肌肉的收缩、调节包括视觉和嗅觉在内的各种神经系统的功能[7], 此外还具有作为脂肪动力激素释放因子的作用[6]和调节口腔胃神经节等功能[36]。此外, 分离纯化于海兔心脏的心激肽(NdWFamide)能够通过激活G蛋白途径提高海兔心室肌细胞的L-型Ca2+流[37];首次分离于罗马蜗牛(Helix pomatia)中的软体动物的CCAP相关肽(M-CCAP)是静水椎实螺口腔摄食网络潜在的外部调节器[38];头足类中的商乌贼CCAPs通过参与输卵管中卵的转运和卵囊物质的机械分泌来参与产卵调控, 进一步的免疫组化实验结果表明, 商乌贼CCAP定位于中枢神经系统和与卵膜合成和分泌相关腺体的神经末梢、下食道神经团[39]。
综上所述, 本文所研究的曼氏无针乌贼心激肽sCAP是首次通过基因克隆的方法在乌贼中获得其基因cDNA全长, 通过多序列比对发现与其他近缘物种有保守的进化关系, 组织特异性表达说明其在不同组织表达可能与多种功能相关, 原位杂交实验说明在曼氏无针乌贼脑中的表达部位可能是控制该基因的功能区域。今后我们会对该基因的细胞定位以及生理功能验证方面开展深入研究。
-
图 3 曼氏无针乌贼sCAP基因mRNA的脑组织原位杂交
A. 正义探针对照(视叶); B. 垂直叶(VL), 亚垂直叶(SVL), 食道(OES); C. 背外侧叶(DLL), 视腺(OG), 脑脚叶(PL); D. 视叶; E. 视叶(OL); F. 视叶细胞(40倍镜); 黑色尖头指示阳性区域, 标尺长度标注在图片右下角
Figure 3. In situ hybridization of sCAP mRNA in brain of S. japonica
A. a medial sagittal section of the anterior basal lobe stained with the sense sCAP probe; B. vertical lobe (VL), subvertical lobe (SVL), esophagus (OES); C. dorsolateral lobe (DLL), optic gland (OG), peduncle lobe (PL); D. optic lobe; E. optic lobe (OL); F. optic lobe cells for 10×40 times. The black arrows indicate positive signals. Scale bars in the lower right corner of the picture
表 1 克隆sCAP基因所用引物
Table 1 Primers used in sCAP gene cloning
引物名称
Primer name序列
Primer sequences (5′-3′)sCAP-F ATGGMTAYCTKGSRTTGCC sCAP-R ACCWGGGCARCWTTCCWTTCC sCAP-5′ Outer ACCAGGGCAGCTTTCCTTTCC sCAP-5′ Inner GGCAACCCCAGATAGCCAT sCAP-3′ Outer ATGGCTATCTGGGGTTGCC sCAP-3′ Inner TGTTGCGGAATGCCACTAATGAAG 表 2 SjsCAP荧光定量和原位杂交引物
Table 2 Primers of SjsCAP used for qRT-PCR and in situ hybridi-zation assay
引物名称
Primer name序列
Primer sequences (5′-3′)RT-sCAP-F CCTGTGCTACTTCCCAAAT RT-sCAP-R TCTCATCTCATAACAATCCCT Actin-F TGAGAGGGAGATTGTGCGTG Actin-R GAACATAGATTCTGGAGCACGG A1F CCTGTGCTACTTCCCAAAT A1R GATCACTAATACGACTCACTATAGGGCCTGTGCTACTTCCCAAAT B1F GATCACTAATACGACTCACTATAGGGTCTCATCTCATAACAATCCCT B1R TCTCATCTCATAACAATCCCT -
[1] 徐卫华. 昆虫神经肽研究进展. 生物化学与生物物理进展, 1997, 24(2): 116—120 Xu W H. Advances in insect neuropeptides [J]. Progress in Biochemistry and Biophysics, 1997, 24(2): 116—120
[2] Arigiolas A. Neuropeptides and sexual behaviour [J]. Neuroscience & Biobehavioral Reviews, 1999, 23(8): 1127—1142
[3] Kamatani Y, Minakata H, Kenny P T, et al. Achatin-I, an endogenous neuroexcitatory tetrapeptide from Achatina fulica Ferussac containing a D-amino acid residue [J]. Biochemical Biophysical Research Communication, 1989, 160(3): 1015—1020 doi: 10.1016/S0006-291X(89)80103-2
[4] Lloyd P E, Mahon A C, Kuppermann I, et al. Biochemi-cal and immunocytological localization of molluscan small cardioactive peptides in the nervous system of Aplysia californica [J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 1985, 5(7): 1851
[5] Cropper E C, Miller M W, Tenenbaum R, et al. Structure and action of buccalin: a modulatory neuropeptide localized to an identified small cardioactive peptide-containing cholinergic motor neuron of Aplysia californica [J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(16): 6177—6181 doi: 10.1073/pnas.85.16.6177
[6] Dulcis D, Levine R B, Ewer J. Role of the neuropeptide CCAP in Drosophila cardiac function [J]. Journal of Neurobiology, 2005, 64(3): 259—274
[7] Gammie S C, Truman J W. Eclosion hormone provides a link between ecdysis-triggering hormone and crustacean cardioactive peptide in the neuroendocrine cascade that controls ecdysis behavior [J]. Journal of Experimental Biology, 1999, 202(4): 343—352
[8] Iwakoshi E, Hisada M, Minakata H. Cardioactive peptides isolated from the brain of a Japanese octopus, Octopus minor [J]. Peptides, 2000, 21(5): 623—630 doi: 10.1016/S0196-9781(00)00201-1
[9] Kanda A, Minakata H. Isolation and characterization of a novel small cardioactive peptide-related peptide from the brain of Octopus vulgaris [J]. Peptides, 2006, 27(7): 1755—1761 doi: 10.1016/j.peptides.2005.12.006
[10] Ohta N, Kubata I, Takao T, et al. Fulicin, a novel neuropeptide containing a D-amino acid residue isolated from the ganglia of Achatina fulica [J]. Biochemical & Biophysical Research Communications, 1991, 178(2): 486—493
[11] 于新秀, 吴常文, 迟长凤. 曼氏无针乌贼(Sepiella main-droni)脑显微结构及视腺超微结构观察. 海洋与湖沼, 2011, 42(2): 300—304 Yu X X, Wu C W, Chi C F. Brain microstructure and optic gland ultrastructure in Sepiella maindroni [J]. Oceanologia et Limnologia Sinica, 2011, 42(2): 300—304
[12] Nabhitabhata J. Mass culture of cephalopods in Thailand [J]. World Aquaculture Magazine, 1995, 26(2): 25—29
[13] 蒋霞敏, 符方尧, 李正, 等. 曼氏无针乌贼的卵子发生及卵巢发育. 水产学报, 2007, 31(5): 607—617 Jiang X M, Fu F Y, Li Z, et al. Study on the oogenesis and ovarial development of Sepiella maindroni [J]. Jour-nal of Fisheries of China, 2007, 31(5): 607—617
[14] Gasteiger E, Gattiker A, Hoogland C, et al. ExPASy: the proteomics server for in-depth protein knowledge and analysis [J]. Nucleic Acids Research, 2003, 31(13): 3784—3788 doi: 10.1093/nar/gkg563
[15] Dyrlov B J, Nielsen H H G, Brunak S. Improved prediction of signal peptides: SignalP 3.0 [J]. Journal of Molecular Biology, 2004, 340(4): 783 doi: 10.1016/j.jmb.2004.05.028
[16] Thompson J D, Gibson T J, Plewniak F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools [J]. Nucleic Acids Research, 1997, 25(25): 4876—4882
[17] Fredrik R, Maxim T, Paul V D M, et al. MrBayes 3.2: Efficient Bayesian Phylogenetic inference and model choice across a large model space [J]. Systematic Biology, 2012, 61(3): 539—542 doi: 10.1093/sysbio/sys029
[18] Bray L, Froment C, Pardo P, et al. Identification and functional characterization of the phosphorylation sites of the neuropeptide FF2 receptor [J]. Journal of Biological Chemistry, 2014, 289(49): 33754—33766 doi: 10.1074/jbc.M114.612614
[19] Richards K S, Marder E. The actions of crustacean car-dioactive peptide on adult and developing stomatogastric ganglion motor patterns [J]. Developmental Neurobiology, 2000, 44(1): 31—44
[20] Nt D, U H, H D, et al. Crustacean cardioactive peptide-immunoreactive neurons in the hawkmoth Manduca sexta and changes in their immunoreactivity during postembryonic development [J]. The Journal of comparative neurology, 1993, 338(4): 612
[21] Klukas K A, Brelje T C, Mesce K A. Novel mouse IgG-like immunoreactivity expressed by neurons in the moth Manduca sexta: developmental regulation and colocalization with crustacean cardioactive peptide [J]. Microscopy Research Technique, 2015, 35(3): 242—264
[22] Mk P, Sg W, Js C, et al. Ecdysis of decapod crustaceans is associated with a dramatic release of crustacean cardioactive peptide into the haemolymph [J]. The Journal of experimental Biology, 2000, 203(Pt 3): 521
[23] Chen T, Ren C H, Wang Y H. Crustacean cardioactive peptide (CCAP) of the Pacific white shrimp (Litopenaeus vannamei): molecular characterization and its potential roles in osmoregulation and freshwater tolerance [J]. Aquaculture, 2016, 451: 405—412 doi: 10.1016/j.aquaculture.2015.10.005
[24] Santama N, Wheeler C H, Burke J F, et al. Neuropeptides myomodulin, small cardioactive peptide, and buccalin in the central nervous system of Lymnaea stagnalis: Purifica-tion, immunoreactivity, and artifacts [J]. Journal of Comparative Neurology, 1994, 342(3): 335
[25] Santama N, Brierley M, Burke J F, et al. Neural network controlling feeding in Lymnaea stagnalis: Immunocytochemical localization of myomodulin, small cardioactive peptide, buccalin, and FMRFamide-related peptides [J]. Journal of Comparative Neurology, 1994, 342(3): 352—365 doi: 10.1002/(ISSN)1096-9861
[26] Stangier J, Hilbich C, Keller R. Occurrence of crustacean cardioactive peptide (CCAP) in the nervous system of an insect, Locusta migratoria [J]. Journal of Comparative Physiology B, 1989, 159(1): 5—11 doi: 10.1007/BF00692677
[27] Shi Y, Liu T Y, Pei Y X, et al. Crustacean cardioactive peptide (CCAP) of the oriental fruit fly, Bactrocera dorsalis (Diptera: Tephritidae): Molecular characterization, distribution and its potential roles in larva-pupa ecdysis [J]. https://doi.org/10.1016/j.peptides.2018.02.007
[28] Weiss L C, Laforsch C, Ioannidou I, et al. Daphnia longicephala neuropeptides: Morphological description of crustacean cardioactive peptide (CCAP) and perivisce-rokinins in the Ctenodaphnia central nervous system [J]. Neuropeptides, 2014, 48: 287—293 doi: 10.1016/j.npep.2014.06.003
[29] Lee D H, Paluzzi K P, Orchard I, et al. Isolation, cloning and expression of the Crustacean Cardioactive Peptide gene in the Chagas’ disease vector, Rhodnius prolixus [J]. Peptides, 2011, 32: 475—482 doi: 10.1016/j.peptides.2010.06.035
[30] Veenster J A. Isolation and structure of corazonin, a cardioactive peptide from the American cockroach [J]. Febs Letters, 1989, 250(2): 231—234 doi: 10.1016/0014-5793(89)80727-6
[31] Tublitz N. Insect cardioactive peptides: neurohormonal regulation of cardiac activity by two cardioacceleratory peptides during flight in the tobacco hawkmoth, Manduca sexta [J]. Journal of Experimental Biology, 1989, 142(142): 31
[32] Tublitz N J, Allen A T, Cheung C C, et al. Insect cardioactive peptides: regulation of hindgut activity by car-dioacceleratory peptide 2 (CAP2) during wandering behaviour in Manduca sexta larvae [J]. Journal of Experimen-tal Biology, 1992, 165: 241
[33] Pe L, Ac M, I K, et al. Biochemical and immunocytological localization of molluscan small cardioactive peptides in the nervous system of Aplysia californica [J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 1985, 5(7): 1851—1861 doi: 10.1523/JNEUROSCI.05-07-01851.1985
[34] Lloyd P E. Distribution and molecular characteristics of cardioactive peptides in the snail, Helix aspersa [J]. Journal of Comparative Physiology, 1978, 128(3): 269—276 doi: 10.1007/BF00656860
[35] 褚衍亮, 姜乃澄, 王玥. 甲壳动物神经肽的结构和功能. 海洋学研究, 2002, 20(1): 43—49 Chu Y L, Jiang N C, Wang Y. Structure and function of crustacean neuropeptides [J]. Donghai Marine Science, 2002, 20(1): 43—49
[36] Dircksen H, Homberg U. Crustacean cardioactive peptide-immunoreactive neurons innervating brain neuropils, retrocerebral complex and stomatogastric nervous system of the locust, Locusta migratoria [J]. Cell & Tissue Research, 1995, 279(3): 495—515
[37] Js C, Dc W, N Z, et al. Identification and developmental expression of mRNAs encoding crustacean cardioactive peptide (CCAP) in decapod crustaceans [J]. The Journal of Experimental Biology, 2006, 209(19): 3862—3872 doi: 10.1242/jeb.02425
[38] Richerds K S, Marder E. The actions of crustacean car-dioactive peptide on adult and developing stomatogastric ganglion motor patterns [J]. Journal of Neurobiology, 2000, 44(1): 31 doi: 10.1002/(ISSN)1097-4695
[39] Kanemaru K, Morishita F, Matsushima O, et al. Aplysia cardioactive peptide (NdWFamide) enhances the L-type Ca2+ current of Aplysia ventricular myocytes [J]. Peptides, 2002, 23: 1991—1998 doi: 10.1016/S0196-9781(02)00186-9
[40] Vehovszkya A′, Agricolab H J, Elliottc C J H, et al. Crustacean cardioactive peptide (CCAP)-related molluscan peptides (M-CCAPs) are potential extrinsic modulators of the buccal feeding network in the pond snail Lymnaea stagnalis [J]. Neuroscience Letters, 2005, 373: 200—205 doi: 10.1016/j.neulet.2004.10.020
[41] Endress M, Zatylny-Gaudin C, Corre E, et al. Crustacean cardioactive peptides: Expression, localization, structure, and a possible involvement in regulation of egg-laying in the cuttlefish Sepia officinalis [J]. General and Compa-rative Endocrinology, 2018, 260: 67—79 doi: 10.1016/j.ygcen.2017.12.009



 下载:
下载: