THE GROWTH CHARACTERISTICS AND HYPOXIA TOLERANT ABILITY OF YELLOW CATFISH AND HYBRID CATFISH
-
摘要: 实验以杂交黄颡鱼(Pelteobagrus fulvidraco)和普通黄颡鱼幼鱼为实验对象, 拟通过8周的投喂生长和低氧胁迫实验, 比较研究杂交黄颡鱼与普通黄颡鱼的生长性能及耐低氧抗逆性。投喂生长实验: 经过8周的养殖, 杂交黄颡鱼平均体重为(19.60±0.88) g/尾, 显著高于普通黄颡鱼平均体重为(15.74±0.42) g/尾(P<0.05), 杂交黄颡鱼幼鱼较普通黄颡鱼幼鱼体重生长快24.52%; 杂交黄颡鱼幼鱼存活率为(87.78±1.92)%, 显著高于普通黄颡鱼幼鱼存活率(67.78±1.92)% (P<0.05), 杂交黄颡鱼幼鱼比普通黄颡鱼幼鱼存活率高 29.51%; 杂交黄颡鱼的饲料系数为1.18±0.14, 普通黄颡鱼饲料系数为1.36±0.21。低氧胁迫实验: 同时将杂交黄颡鱼和普通黄颡鱼置于在溶氧量(1.48 ± 0.27) mg/L的水体中, 分别在低氧胁迫0、6h、12h和24h后, 检测血清和肝脏中抗氧化酶活性以及脑和肝脏中缺氧诱导基因(HIF-1α)的相对表达量发现: 杂交黄颡鱼和普通黄颡鱼血清和肝脏中乳酸脱氢酶(LDH)活性、超氧化物歧化酶(SOD)活性和过氧化氢酶(CAT)活性在低氧胁迫后 6h以及总抗氧化能力(T-AOC)在低氧胁迫后 12h较低氧胁迫 0均出现显著性变化(P<0.05)且在低氧胁迫6h、12h和24h杂交黄颡鱼抗氧化酶活性均高于普通黄颡鱼; 杂交黄颡鱼和普通黄颡鱼脑和肝脏中缺氧诱导基因(HIF-1α)的相对表达量均在低氧胁迫后出现显著性上升(P<0.05)且在低氧胁迫6h、12h和 24h杂交黄颡鱼缺氧诱导基因(HIF-1α)的相对表达量均高于普通黄颡鱼。从无氧代谢能力、抗氧化能力以及缺氧诱导基因相对表达量3方面分析表明杂交黄颡鱼和黄颡鱼低氧胁迫短时间均具有一定的低氧耐受能力但随着胁迫时间延长均会出现氧化损伤且杂交黄颡鱼的耐低氧能力要显著性高于普通黄颡鱼。Abstract: This study investigated growth performance and hypoxia tolerant ability of the yellow catfish and the hybrid catfish called “Huangyou No. 1” for an 8-week trial. The results showed that the average weight of the hybrid catfish was (19.60±0.88) g/tail at week 8, which was significantly higher than that of the yellow catfish was (15.74±0.42) g/tail (P<0.05) with a 24.52% increase. The feed coefficient of the hybrid catfish and the yellow catfish were 1.18±0.14 and 1.36±0.21, respectively. The survival rate of young hybrids catfish was 87.78±1.92, which was significantly higher than that of the yellow catfish at 67.78±1.92 (P<0.05). The survival rate of the hybrid catfish was 29.51% higher than that of the yellow catfish. The hybrid catfish and yellow catfish were placed in water with dissolved oxygen content of (1.48±0.27) mg/L and then hypoxia stress for 0, 6h, 12h and 24h before collecting serum and liver for measurements. Hypoxia stress significantly regulated the LDH activity, SOD activity, CAT activity at 6h and the T-AOC at 12h in the serum and liver of both hybrid catfish and yellow catfish (P<0.05). The brain and liver HIF-1α mRNA level of both hybrid catfish and yellow catfish increased significantly by hypoxic stress (P<0.05) with higher level in hybrid catfish at 6h, 12h and 24h. These results indicated that long-term hypoxic stress may cause oxidative damage to hybrid catfish and yellow catfish, but hypoxia tolerance of hybrid catfish is higher than that of yellow catfish.
-
Keywords:
- Hybrid catfish /
- Growth /
- Survival /
- Hypoxia /
- Antioxidant enzymes
-
黄颡鱼 Pelteobagrus fulvidraco隶属鲇形目(Siluriformes)、鲿科(Bagridae)、黄颡鱼属(Pelteobagrus), 俗名黄姑鱼, 黄腊丁等, 广泛分布于我国江河、湖泊、水库等自然水域的底栖、小型、经济鱼类[1]。据2017年中国渔业统计年鉴报道, 黄颡鱼养殖产量已从 2003 年的5.48×107 kg增长至2016年的41.73×107 kg, 已发展成为南至两广、北至辽宁、东起江浙、西至川陕以及中部各大省份的全国性养殖鱼类。目前, 我国已经形成了以池塘集约化养殖黄颡鱼的产业化生产模式, 随着黄颡鱼养殖产业规模的扩大, 对优质性状、良种多元化的需求不断增加。将生长速度作为选育目标, 以选育三代的普通黄颡鱼为母本, 选育两代的瓦式黄颡鱼为父本杂交获得的子一代, 即杂交黄颡鱼“黄优1号”, 目前已经全国水产原种和良种审定委员会审定通过成为水产新品种。杂交黄颡鱼为黄颡鱼良种培育提供了新的选择, 但有关杂交黄颡鱼相比于其他黄颡鱼品种的优缺点还少有报道。
在自然水体中, 水体低氧是一种常见且频发的现象, 对鱼体产生了很多不利影响甚至可能导致鱼类的大量死亡[2]。水体溶氧水平直接关系着鱼类的生存、生长和鱼体代谢水平, 是影响鱼类生命活动的重要指标。对于绝大多数养殖鱼类而言, 当水中溶解氧含量低于2.0 mg/L, 鱼会因缺氧表现出浮头的症状; 当水中溶解氧含量低于1.0 mg/L, 鱼会表现出严重浮头的症状甚至缺氧死亡[3]。气压、温度、盐度、昼夜节律以及季节变化、水体富营养化、人类行为等都会对水体溶氧平衡造成影响[4]。鱼类的低氧耐受能力是鱼类抗逆性的重要指标, 也是评价水产养殖良种的重要指标。
本研究以相同养殖条件下的杂交黄颡鱼“黄优1号”和普通黄颡鱼幼鱼为研究对象, 比较研究其生长性能和低氧胁迫条件下乳酸脱氢酶和抗氧化酶等活力的变化以及缺氧诱导基因(HIF-1α)的相对表达量变化, 评估杂交黄颡鱼“黄优1号”幼鱼的生长优势以及低氧耐受能力, 为今后选育黄颡鱼养殖新品种提供基础资料和参考数据。
1. 材料与方法
1.1 实验鱼
本研究的杂交黄颡鱼“黄优1号”和普通黄颡鱼苗种由湖北黄优源渔业发展有限公司鲁湖基地提供。杂交黄颡鱼和黄颡鱼苗种均为同批次繁育, 挑选规格一致、健康无病的实验鱼进行实验。在实验开始前, 杂交黄颡鱼“黄优1号”和普通黄颡鱼经过为期2周的驯化暂养以适应实验环境和饲料。
1.2 实验设计与养殖管理
生长性能对比试验 生长性能对比实验在华中农业大学校内基地的流水养殖系统中进行, 选取6个养殖水体体积为250 L的养殖缸进行了杂交黄颡鱼和普通黄颡鱼8周养殖生长对比实验。初始规格分别为: (2.05±0.18) g和(1.95±0.24) g的杂交黄颡鱼和普通黄颡鱼鱼苗各90 尾, 2种实验鱼分别各自随机分成三组, 每组30 尾/缸。实验期间均采用实验室自制的黄颡鱼配合饲料, 每天进行2次饱食投喂(上午8:00和下午19:00), 饲料的主要组成及营养成分见表 1。
表 1 基础饲料组成和营养水平Table 1. Composition and nutrient levels of the basal diet项目Item 含量Content (%) 原料Ingredients 鱼粉Fish meal 30.00 豆粕Soybean meal 40.00 面粉Wheat bran 20.00 氯化胆碱 Choline chloride 0.50 磷酸二氢钙Ca(H2PO4)2 1.00 豆油Soybean oil 6.50 维生素预混料Vitamin premix1 1.00 矿物质预混料Mineral premix2 1.00 合计Total 100.0 营养水平Nutrient levels(实测值) 水分Moisture 9.84 粗蛋白Crude protein 39.35 粗脂肪Crude lipid 7.32 灰分Ash 15.47 注: 1. 维生素预混料为每千克饲料提供: VA 2.5 mg, VD3 0.15 mg, VE 100 mg, VK3 30 mg, VB1 120 mg, VB2 30 mg, VB6 45 mg, VB12 0.1 mg, 烟酰胺 nicotinic acid 150 mg, 生物素1.8 mg, 叶酸2 mg, 肌醇 500 mg, 泛酸钙 150 mg; 2. 矿物质预混料为每千克饲料提供: Ca(H2PO4)·H2O 20 mg, MnSO4·H2O 25 mg, ZnSO4·H2O 60 mg, KI 25 mg, MgSO4·H2O 200 mg, CoCl2·H2O 2 mg, FeSO4·H2O 30 mgNote: 1. The vitamin premix provided the following per kg of diets: VA 2.5 mg, VD3 0.15 mg, VE 100 mg, VK3 30 mg, VB1 120 mg, VB2 30 mg, VB6 45 mg, VB12 0.1 mg, nicotinic acid 150 mg, biotin 1.8 mg, folic acid 2 mg, inositol 500 mg, calcium pantothenate 150 mg; 2. The mineral premix provided the following per kg of diets: Ca(H2PO4)·H2O 20 mg, MnSO4·H2O 25 mg, ZnSO4·H2O 60 mg, KI 25 mg, Mg SO4·H2O 200 mg, CoCl2·H2O 2 mg, FeSO4·H2O 30 mg 低氧胁迫实验 低氧环境设计参考姜景腾等[5]的方法: 用1个体积为2000 L的储水桶, 放于较高位置; 6个体积为250 L的实验桶, 放于较低位置。用氮气把水中的氧排出, 加液体石蜡封闭。选取(38.14±2.35) g 的杂交黄颡鱼和(38.02±2.50) g普通黄颡鱼进行低氧胁迫实验。
选取3个实验桶, 每个实验桶随机放30尾杂交黄颡鱼, 再用另外3个实验桶, 每个实验桶随机放30尾普通黄颡鱼。通过预实验发现当实验鱼在溶氧水平低于1.50 mg/L时实验鱼表现出明显的缺氧症状(烦躁不安, 不时上游到水面), 所以以溶解水平1.50 mg/L作为实验低氧标准。低氧胁迫过程中实验桶内溶解氧含量为(1.48±0.27) mg/L (Winkler 碘量法), 每隔1h重新测定溶解氧含量, 根据需要调节水流速度维持溶氧水平不变。
1.3 测定指标与方法
生长指标测定 杂交黄颡鱼和普通黄颡鱼养殖8周, 禁食24h后取出每个养殖缸中的所有实验鱼, 以MS-222溶液麻醉, 然后计数并称重, 测量鱼体体长, 计算肥满度; 解剖得到肝脏和内脏称重, 计算肝体比和脏体比。计算方法如下:
增重率(Weight gain rate, WGR, %) = 100%×(Wt−W0)/W0
特定生长率 (Special growth rate, SGR, %/d)= 100%×(LnWt–LnW0)/t
饲料系数(Feed conversion ratio, FCR)= 100×Wf/(Wt−W0)
存活率(Survival rate, SR, %)= 100%×Nt/N0
脏体比(Viscerosomatic index, VSI)= 100×WV/Wt
肝体比(Hepatosomatic index, HSI)= 100×WL/Wt
肥满度(Condition factor, CF, g/cm3)= 100×Wt/L3
其中, W0和Wt分别为实验鱼的初始体重和终末体重(g); WL和WV分别为肝脏湿重和内脏湿重(g); t为实验天数; N0和Nt分别为实验开始和结束时养殖缸中实验鱼的尾数; Wf为摄食饲料干重(g); L为鱼的体长(cm)。
血清和肝脏酶活性变化 低氧胁迫0、6h、12h和24h后取杂交黄颡鱼和普通黄颡鱼的血清和肝脏。每个时间点取3尾鱼, 以MS-222溶液麻醉, 尾静脉取血于EP管中混匀, 于4℃, 4000 r/min, 制备血清, −80℃冰箱保存。随后在冰盘上解剖, 分离肝脏, 以体积1﹕9加预冷生理盐水匀浆, 在4℃下3000 r/min离心10min, 取上清液, −20℃冰箱保存。血清和肝脏乳酸脱氢酶(LDH)活性、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、总抗氧化能力(T-AOC)测定采用南京建成生物工程研究所的试剂盒, 具体测定方法见试剂盒说明书。
脑和肝脏缺氧诱导基因(HIF-1α)mRNA 的相对表达量变化 低氧胁迫0、6h、12h和24h后取杂交黄颡鱼和普通黄颡鱼的脑和肝脏。每个时间点取3尾鱼, 以MS-222溶液麻醉, −80℃冰箱保存备用。PCR引物参考张慧[6]根据黄颡鱼HIF-1α基因序列设计的引物HIF-f6与HIF-r6, 以及根据黄颡鱼β-actin 基因序列设计的引物AF和AR, 引物序列见下表 2。
表 2 引物序列Table 2. Primer sequence引物名称Primer name 引物序列Primer sequence (5′-3′) HIF-f6 CCACCTCAACAAGACACAT HIF-f6 GTCACACAACACACACAGT AF GCTATGAGCTGCCTGACGG AR TAAGAAGCATTTGCGGTGG 1.4 数据分析
实验结果数据用平均值±标准差(Mean±SD)来表示, 利用SPSS 18.0软件进行单因素方差分析, 当差异显著时再进行Tukey’s检验分析不同组别之间的差异, 显著水平为P<0.05。
2. 结果
2.1 杂交黄颡鱼和普通黄颡鱼幼鱼生长对比结果
杂交黄颡鱼和普通黄颡鱼幼鱼生长实验结果见表 3和表 4。结果表明: 经过8周的养殖, 杂交黄颡鱼平均体重为 (19.60±0.88) g/尾, 显著高于普通黄颡鱼平均体重为 (15.74±0.42) g/尾(P<0.05), 杂交黄颡鱼幼鱼较普通黄颡鱼幼鱼体重生长快24.52%; 杂交黄颡鱼幼鱼存活率为 (87.78±1.92) %, 显著高于普通黄颡鱼幼鱼存活率 (67.78±1.92) % (P<0.05), 杂交黄颡鱼幼鱼比普通黄颡鱼幼鱼存活率高29.51%; 杂交黄颡鱼的饲料系数为1.18±0.14, 普通黄颡鱼饲料系数为1.36±0.21。杂交黄颡鱼和普通黄颡鱼肝体比、脏体比、肥满度等形态学指标差异不显著(P>0.05)。
表 3 杂交黄颡鱼和普通黄颡鱼幼鱼生长对比Table 3. Growth characteristics of P. fulvidraco and P. vachelii ♂ × P. fulvidraco ♀种类
Species初始体重
IBM (g)终末体重
TBM (g)增重率
WG (%)特定生长率
SGR (%/d)饲料系数
FCR存活率
SR (%)杂交黄颡鱼
P. vachelii ♂ ×P. fulvidraco ♀2.05±0.15 19.42±1.65b 848.42±30.63b 4.02±0.06b 1.18±0.03 87.78±1.92b 普通黄颡鱼
P. fulvidraco1.94±0.14 15.35±1.43a 689.57±23.07a 3.69±0.05a 1.37±0.06 67.78±1.92a 注: 同一列中不同上标表示差异显著Note: The same line values with different shoulder letters indicate significant differences (P<0.05) 表 4 杂交黄颡鱼和普通黄颡鱼幼鱼形态学指标Table 4. The morphological indicators of P. fulvidraco and P. vachelii ♂ ×P. fulvidraco ♀种类
Species脏体比
VSI肝体比
HSI肥满度
CF (g/cm3)杂交黄颡鱼
P. vachelii ♂ ×P. fulvidraco ♀6.33±0.13 1.46±0.07 1.74±0.08 普通黄颡鱼
P. fulvidraco6.14±0.21 1.42±0.10 1.68±0.11 2.2 杂交黄颡鱼和普通黄颡鱼幼鱼酶活力测定
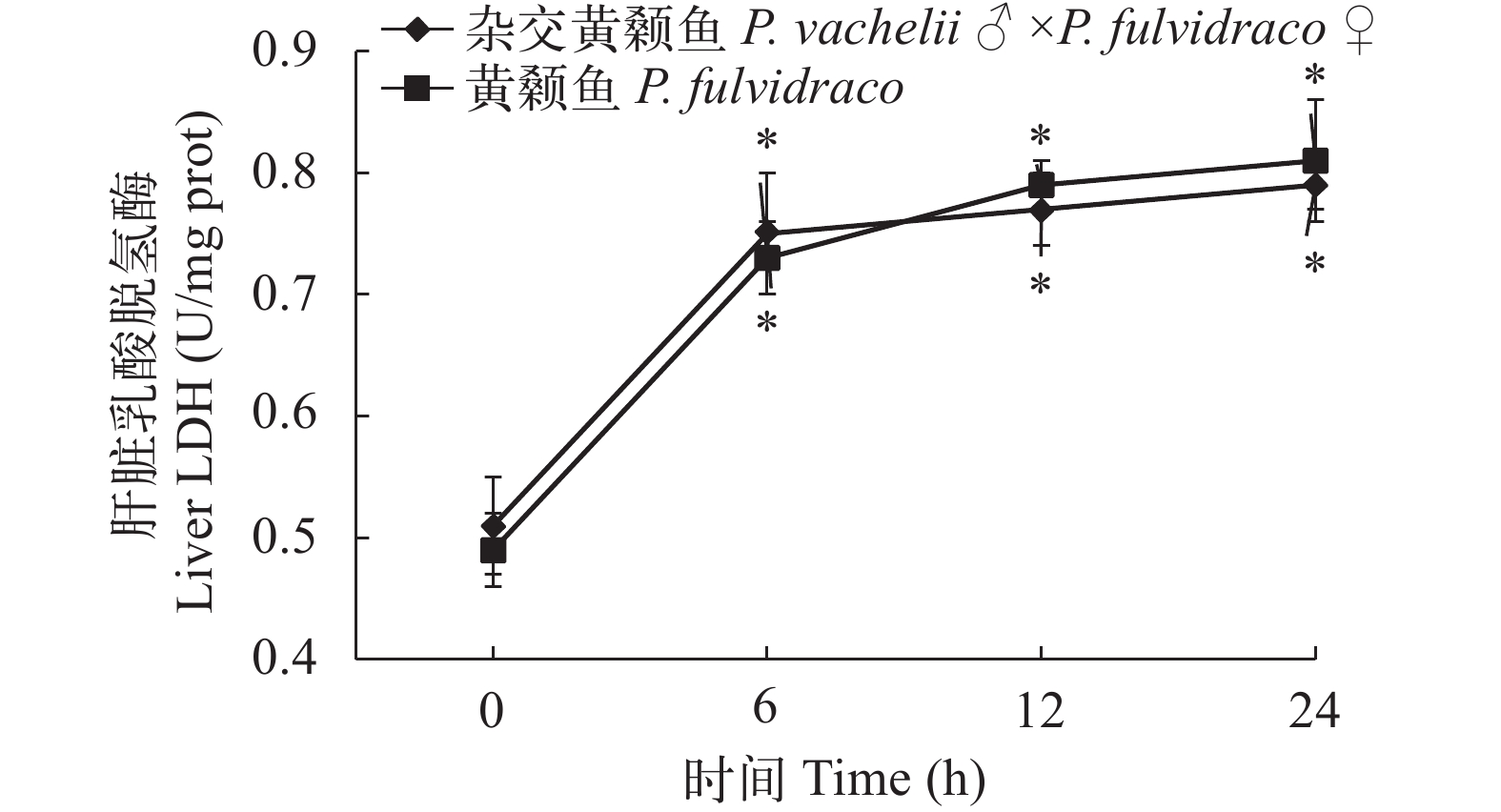
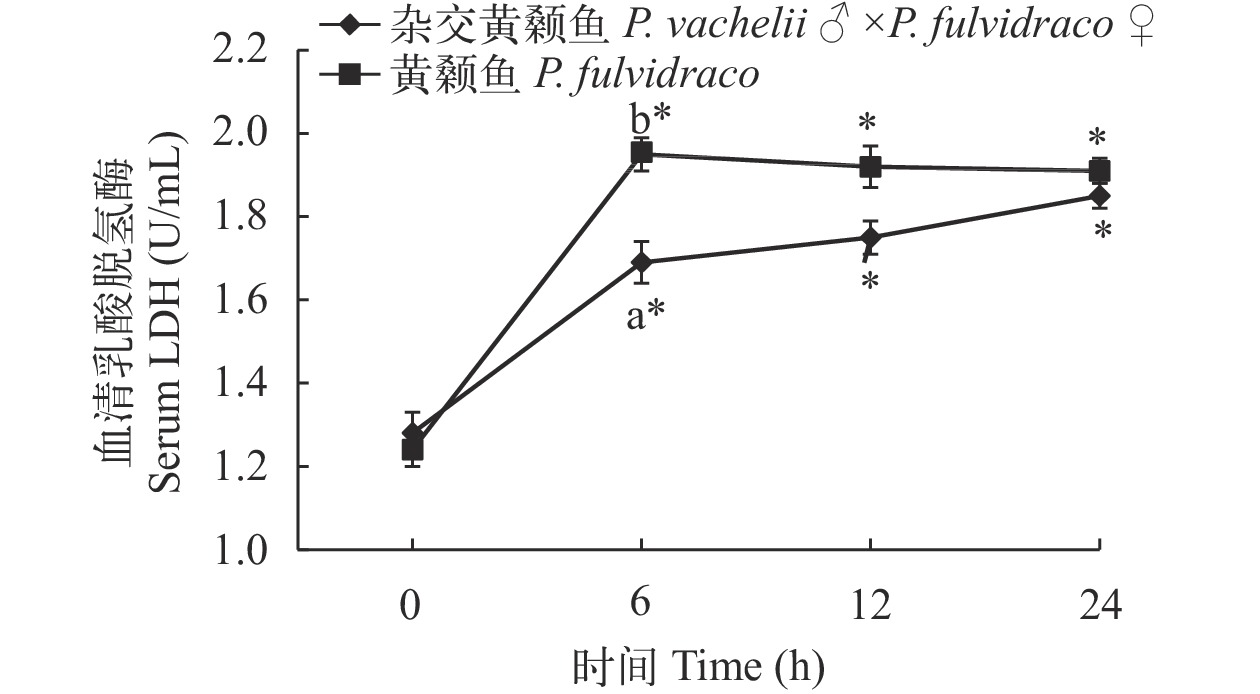
在低氧胁迫下杂交黄颡鱼和普通黄颡鱼幼鱼血清和肝脏乳酸脱氢酶(LDH)活性 从图 1、图 2可以看出: 低氧胁迫0时, 杂交黄颡鱼和普通黄颡鱼血清和肝脏中LDH活性没有显著性差异(P>0.05); 低氧胁迫6h、12h和24h时, 杂交黄颡鱼和普通黄颡鱼血清、肝脏中LDH活性均显著高与低氧胁迫0时LDH活性(P<0.05); 低氧胁迫6h时, 杂交黄颡鱼血清中LDH活性显著低于普通黄颡鱼血清中LDH活性(P<0.05)。
![]() 图 1 杂交黄颡鱼和黄颡鱼幼鱼肝脏乳酸脱氢酶活性不同字母标识表示同一时间点酶活存在显著性差异, “*”表示较低氧胁迫 0 酶活存在显著性差异; 下同Figure 1. The effect of hypoxia on LDH activities in the liver of P. fulvidraco and P. vachelii ♂ ×P. fulvidraco ♀For each time, different shoulder letters indicate significant differences. “*” indicate significant differences in 0 enzyme activity under low oxygen stress; the same applies below
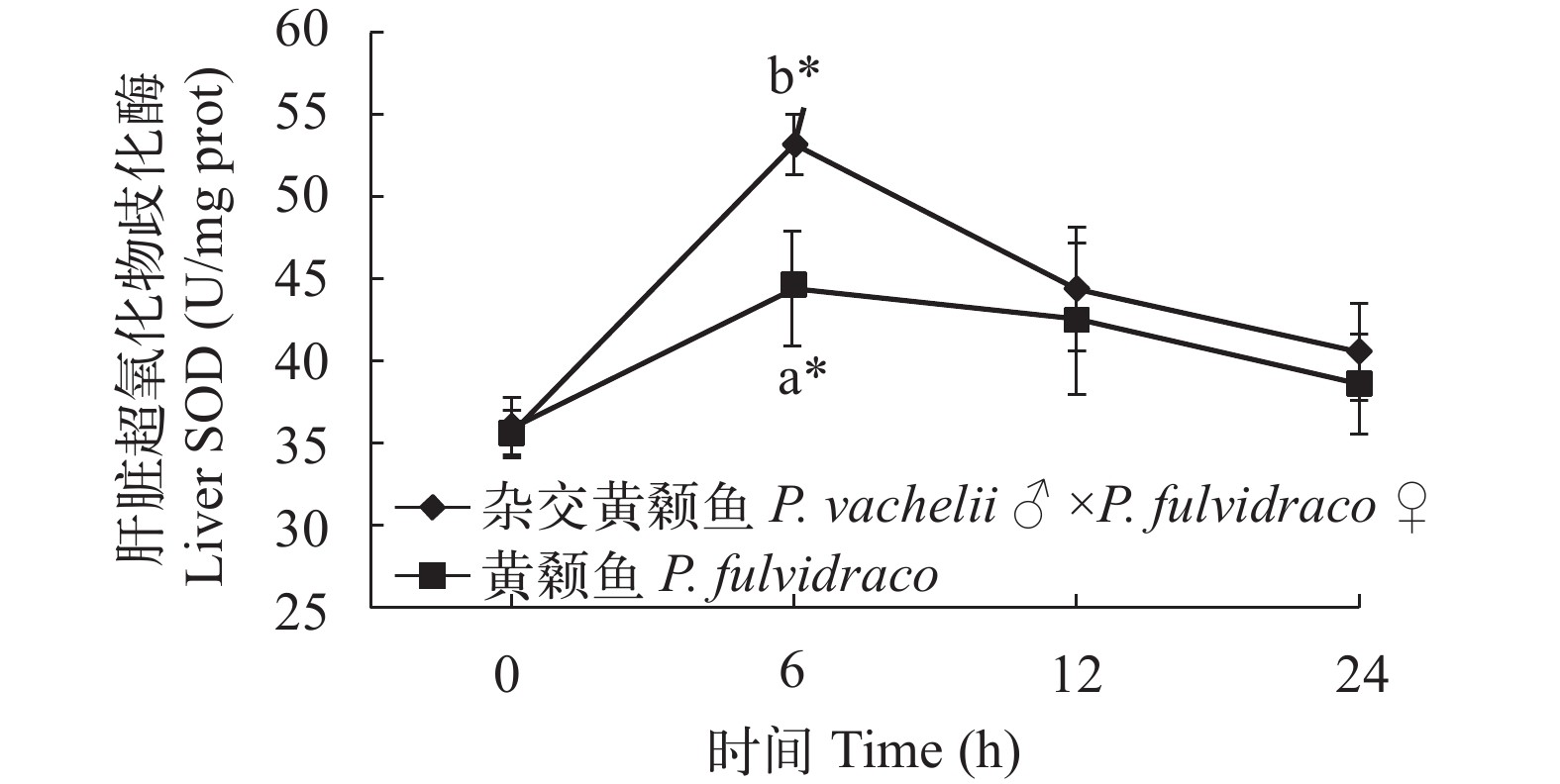
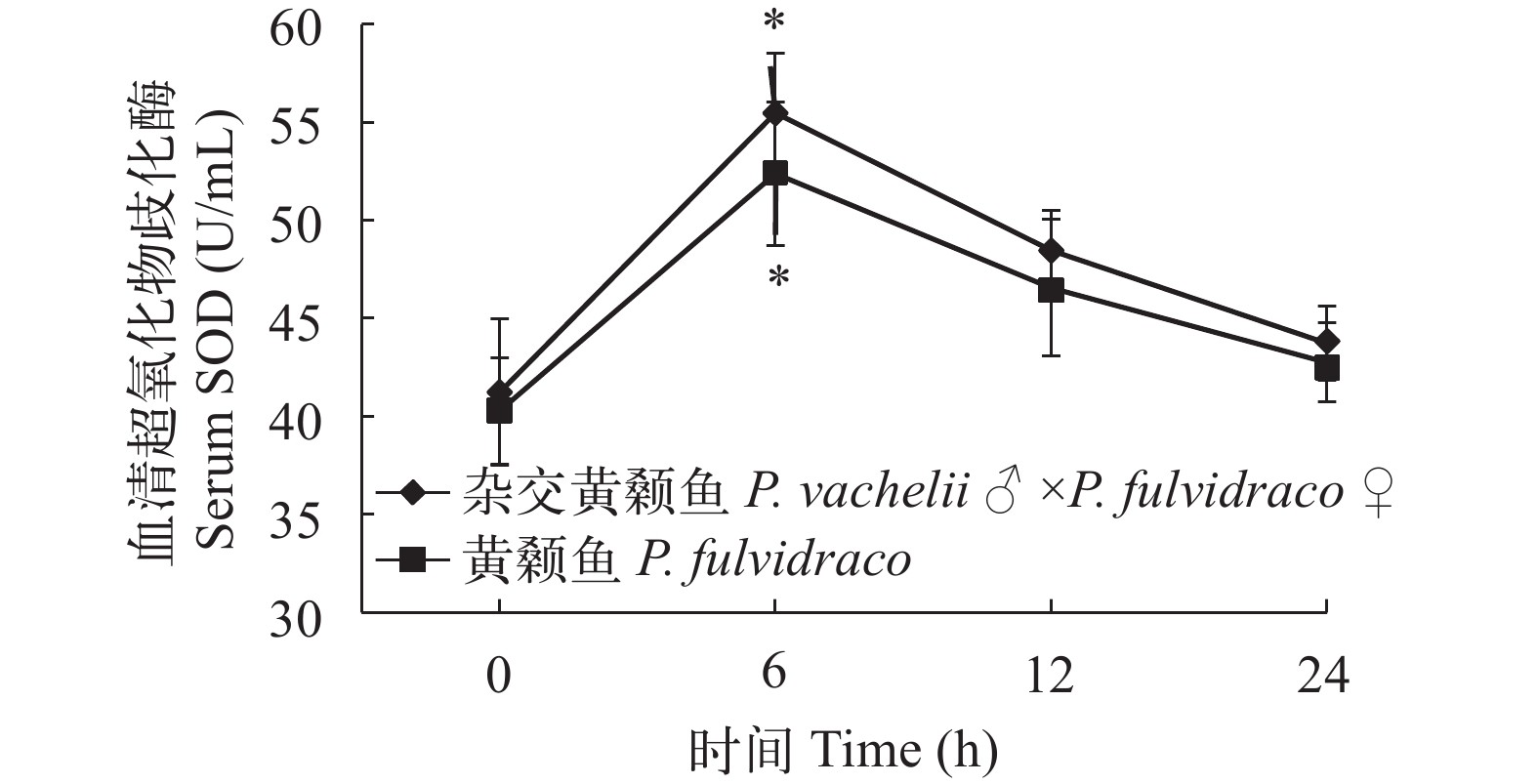
图 1 杂交黄颡鱼和黄颡鱼幼鱼肝脏乳酸脱氢酶活性不同字母标识表示同一时间点酶活存在显著性差异, “*”表示较低氧胁迫 0 酶活存在显著性差异; 下同Figure 1. The effect of hypoxia on LDH activities in the liver of P. fulvidraco and P. vachelii ♂ ×P. fulvidraco ♀For each time, different shoulder letters indicate significant differences. “*” indicate significant differences in 0 enzyme activity under low oxygen stress; the same applies below在低氧胁迫下杂交黄颡鱼和普通黄颡鱼幼鱼血清和肝脏超氧化物歧化酶(SOD)活性 从图 3、图 4可以看出: 低氧胁迫0时, 杂交黄颡鱼和普通黄颡鱼血清和肝脏中SOD活性没有显著性差异(P>0.05), 低氧胁迫后杂交黄颡鱼和普通黄颡鱼血清、肝脏中SOD活性呈现出先升高后降低的趋势。在低氧胁迫6h时, 杂交黄颡鱼和普通黄颡鱼血清和肝脏中SOD活性显著高于低氧胁迫0时SOD活性(P<0.05), 杂交黄颡鱼肝脏中SOD活性显著高于普通黄颡鱼肝脏中SOD活性(P<0.05)。
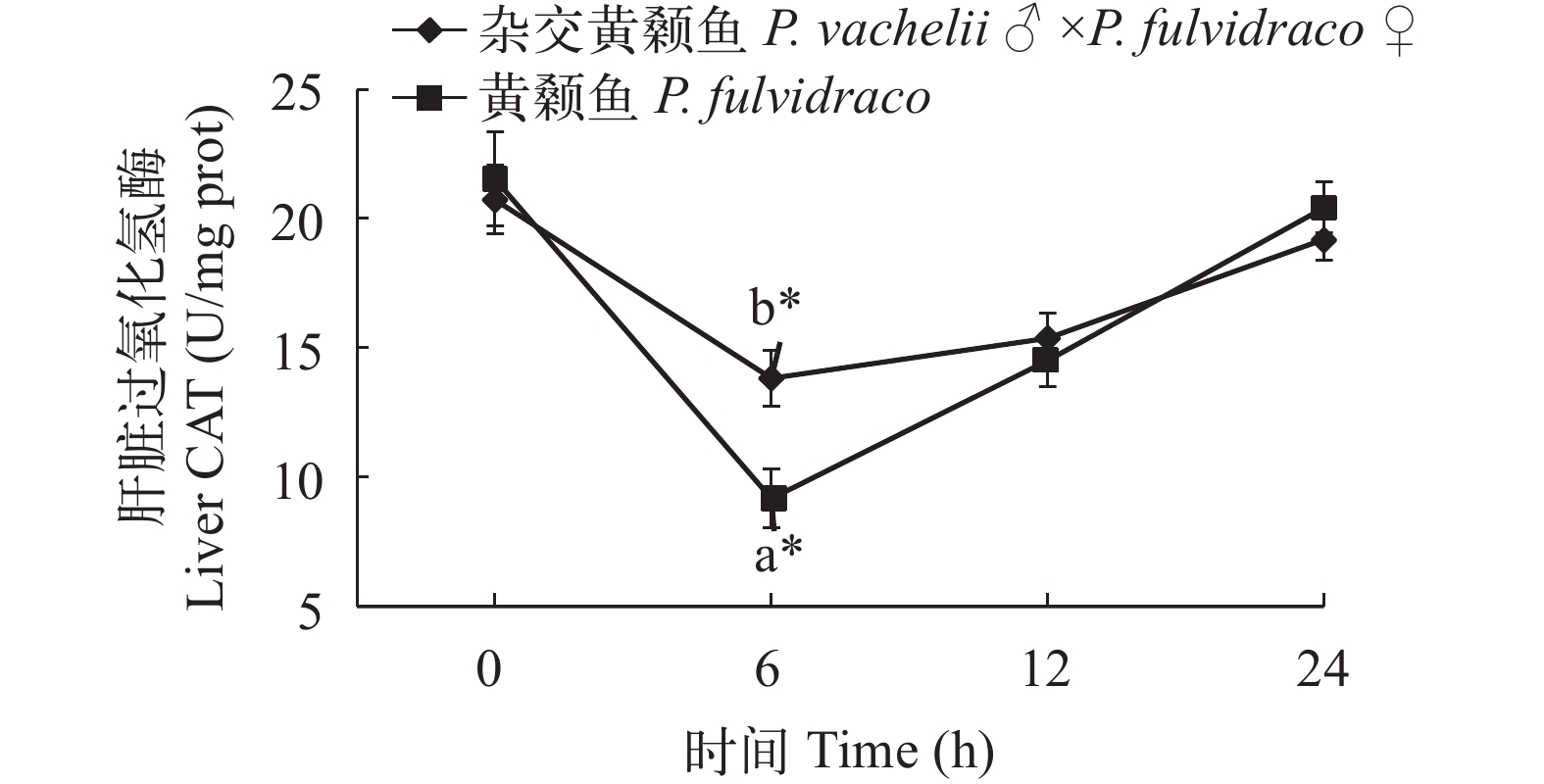
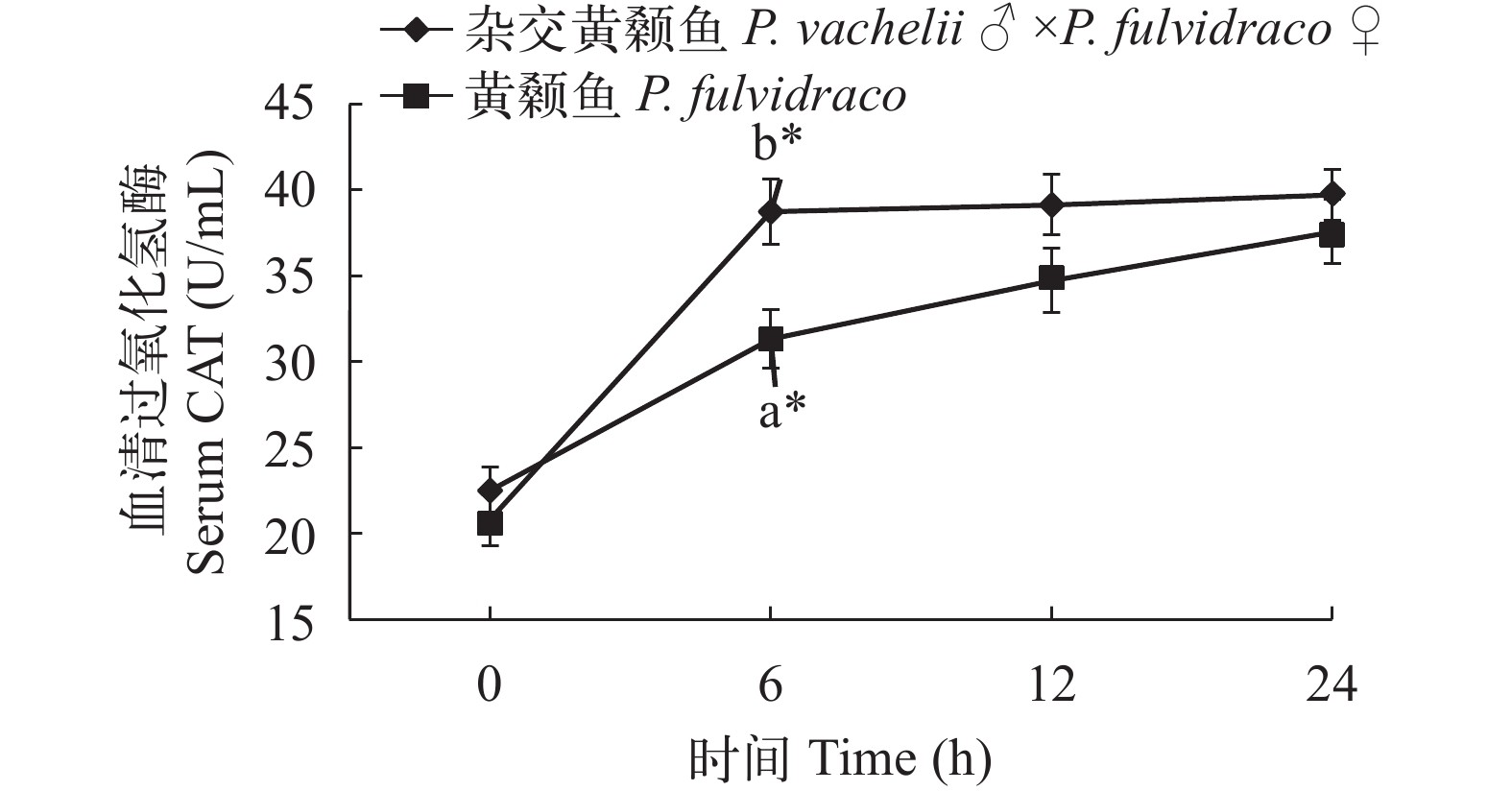
在低氧胁迫下杂交黄颡鱼和普通黄颡鱼幼鱼血清和肝脏过氧化氢酶(CAT)活性 从图 5、图 6可以看出: 低氧胁迫0时, 杂交黄颡鱼和普通黄颡鱼血清和肝脏中CAT活性没有显著性差异(P>0.05)。在低氧胁迫后, 杂交黄颡鱼和普通黄颡鱼肝脏中CAT活性呈现出先降低后升高的趋势, 杂交黄颡鱼和普通黄颡鱼血清中CAT活性呈现逐渐上升趋势。在低氧胁迫6h时, 杂交黄颡鱼和普通黄颡鱼肝脏中CAT活性显著低于低氧胁迫0时 肝脏中CAT活性(P<0.05), 杂交黄颡鱼和普通黄颡鱼血清中CAT活性显著高于低氧胁迫0时血清中CAT活性(P<0.05); 杂交黄颡鱼肝脏中CAT活性显著高于普通黄颡鱼肝脏中CAT活性(P<0.05); 杂交黄颡鱼血清中CAT活性显著高于普通黄颡鱼血清中CAT活性(P<0.05)。
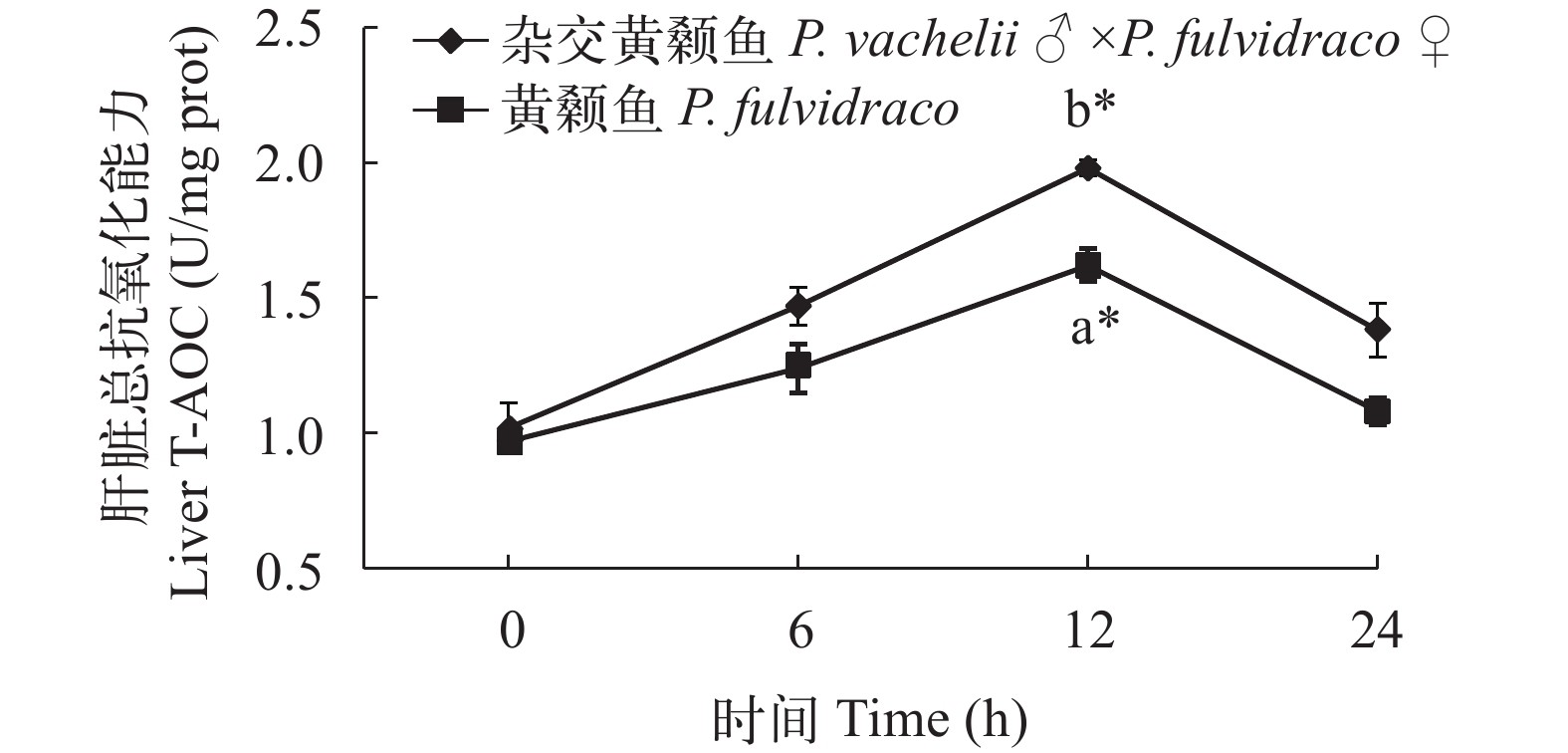
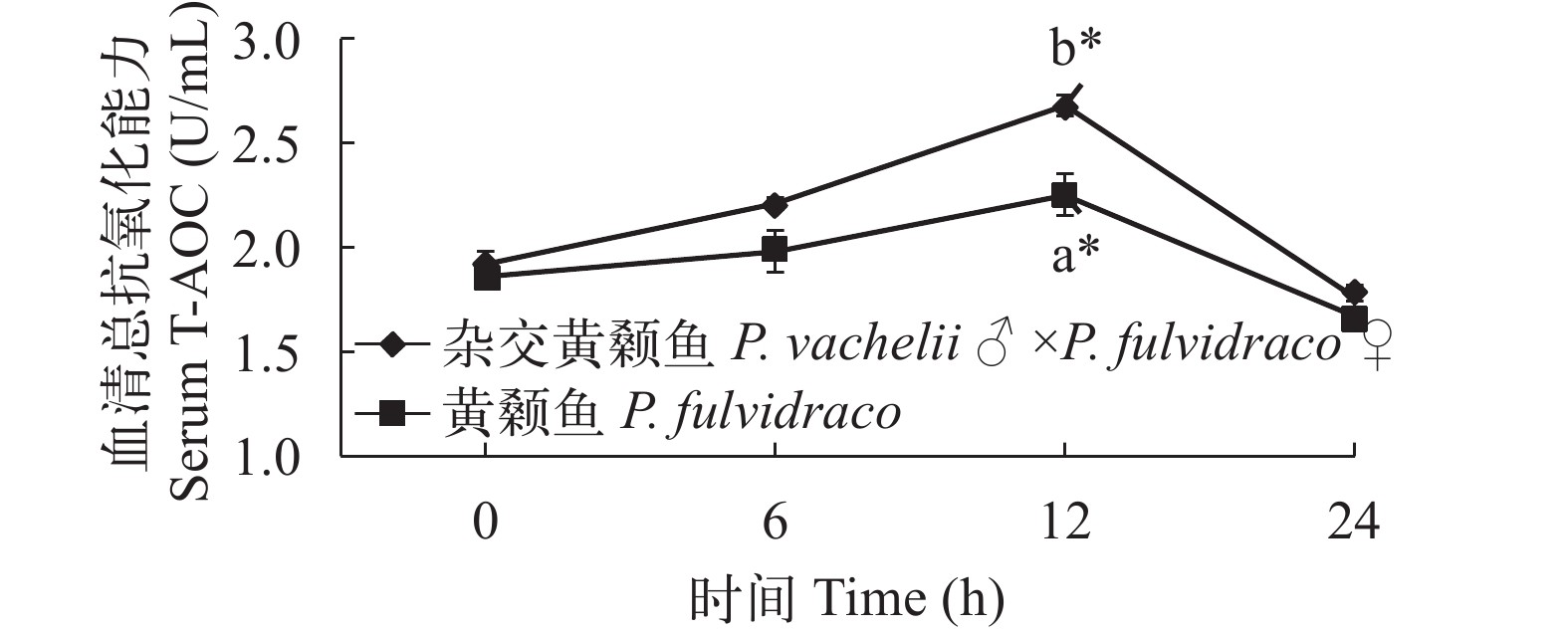
在低氧胁迫下杂交黄颡鱼和普通黄颡鱼幼鱼血清和肝脏总抗氧化能力(T-AOC)活性变化 从图 7、图 8可以看出: 低氧胁迫0时, 杂交黄颡鱼和普通黄颡鱼血清和肝脏中T-AOC活性没有显著性差异(P>0.05), 在低氧胁迫后杂交黄颡鱼和黄颡鱼血清和肝脏中 T-AOC 活性均呈现先升高后降低趋势。在低氧胁迫12h时, 杂交黄颡鱼和黄颡鱼血清和肝脏中 T-AOC 活性显著高于低氧胁迫 0 时T-AOC活性(P<0.05); 杂交黄颡鱼血清和肝脏中T-AOC活性显著高于普通黄颡鱼 T-AOC 活性(P<0.05)。
2.3 杂交黄颡鱼和普通黄颡鱼幼鱼缺氧诱导因子(HIF-1α)mRNA相对表达量
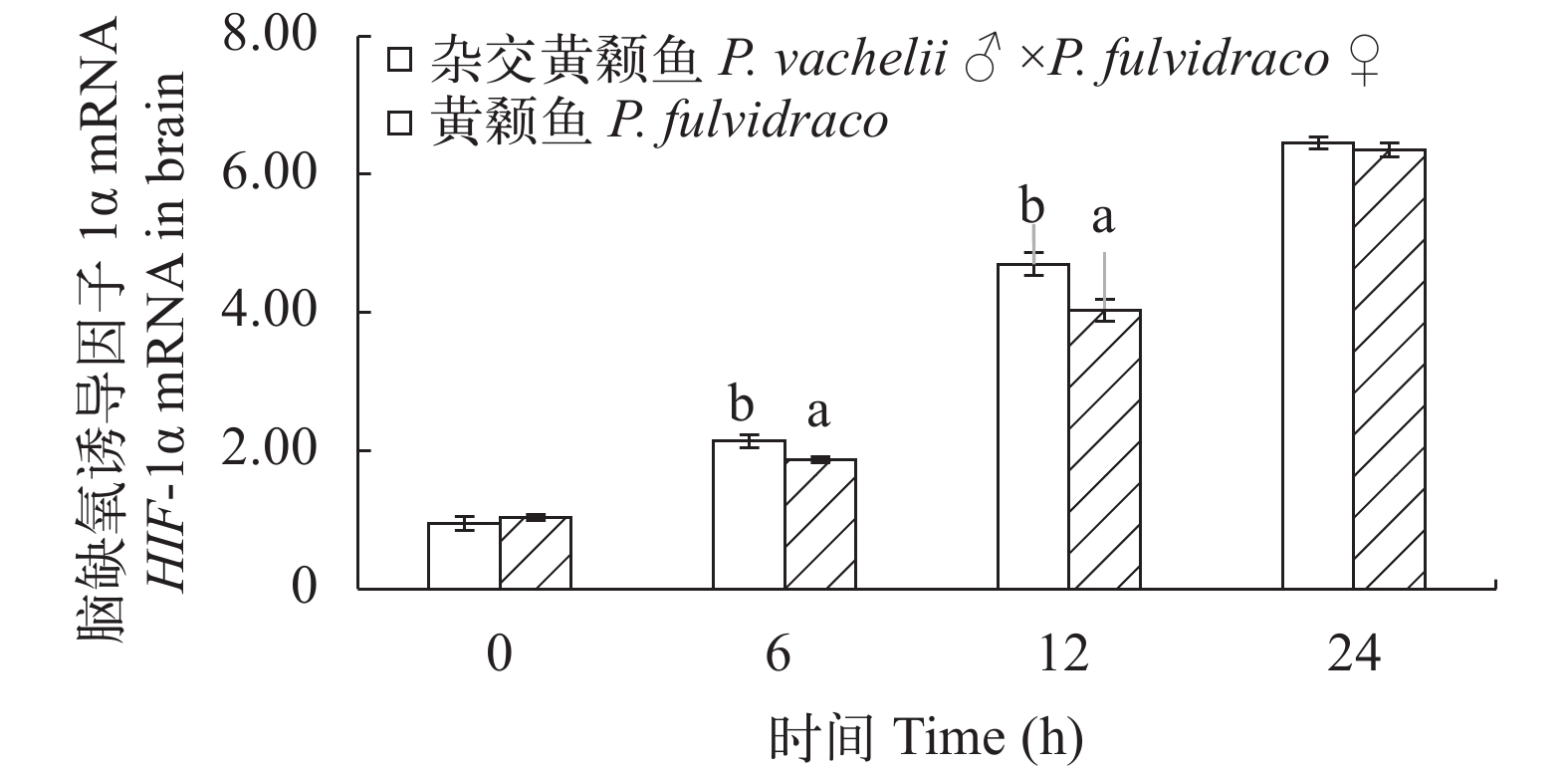
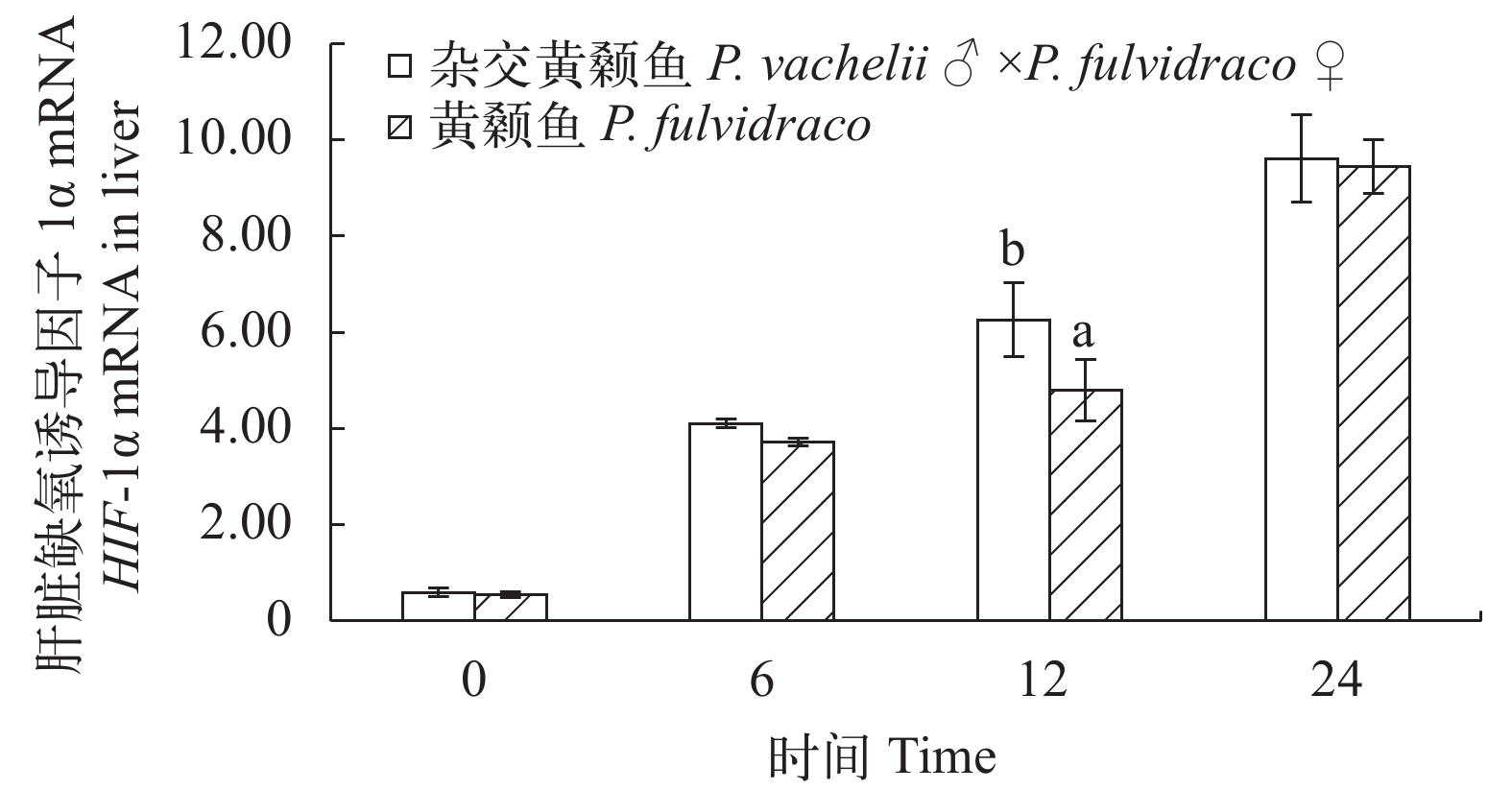
从图 9和图 10可以看出: 低氧胁迫后杂交黄颡鱼和普通黄颡鱼脑和肝脏中HIF-1α mRNA 相对表达量逐渐升高; 低氧胁迫6h和12h杂交黄颡鱼脑中HIF-1α mRNA相对表达量显著高于普通黄颡鱼脑中HIF-1α mRNA 相对表达量(P<0.05); 低氧胁迫 12h 杂交黄颡鱼肝脏中HIF-1α mRNA相对表达量显著高于普通黄颡鱼肝脏中HIF-1α mRNA相对表达量(P<0.05)。
3. 讨论
3.1 杂交黄颡鱼和普通黄颡鱼幼鱼生长性能比较
目前有关杂交黄颡鱼杂交育种的研究, 主要是通过对瓦氏黄颡鱼(Pelteobagrus vachelli)、黄颡鱼(Pelteobagrus fulvidraco)、斑点叉尾鮰(Ietalurus punetaus)、乌苏里拟鲿(Pseudobagrus ussuriensis)和粗唇(Leiocassis crassilabris)等鱼类进行正、反交育种, 就体型特征和生长速度而言, 以黄颡鱼为母本, 瓦氏黄颡鱼为父本杂交得到的杂交黄颡鱼是目前最优的杂交组合[7, 8]。同时, 张佳佳等[9]通过对黄颡鱼 ♀ ×瓦氏黄颡鱼 ♂ 双亲以及杂交子代的营养成分进行对比得出: 杂交黄颡鱼在营养方面不低于其亲本, 甚至优于亲本; 陈建明等[10]通过杂交黄颡鱼、雄性瓦氏黄颡鱼和黄颡鱼的形体指数及肌肉营养组成比较分析发现黄颡鱼 ♀ ×瓦氏黄颡鱼 ♂ 杂交得到的杂交黄颡鱼的体形和出肉率与雄性黄颡鱼一致, 其肌肉为低脂高蛋白食品,营养价值接近黄颡鱼。生长速度、成活率、饲料系数等被认为是评估水产良种的重要指标, 已有研究表明通过杂交育种获得了生长速度更加优良的子代, 如尼罗罗非鱼(Oreochromis niloticus)[11]、鲤(Cyprinus carpio)[12]、石斑鱼(Epinephelus ssp.)[13]等。本研究对杂交黄颡鱼“黄优1号”和普通黄颡鱼幼鱼进行了生长对比试验, 对比分析杂交黄颡鱼“黄优1号”和普通黄颡鱼幼鱼的生长性能。在相同室内流水养殖条件和养殖密度下, 杂交黄颡鱼幼鱼较普通黄颡鱼幼鱼体重生长快24.52%, 存活率高29.51%, 这充分表明杂交黄颡鱼具有优良的生长性能。对于杂交黄颡鱼其他优良性状以及与全雄黄颡鱼生长性能对比将是本研究后续的研究方向。通过与普通黄颡鱼生长对比充分表明: 杂交黄颡鱼幼鱼比普通黄颡鱼幼鱼具有更快的生长速度、更高的存活率以及更低的饲料系数。
3.2 杂交黄颡鱼和普通黄颡鱼幼鱼耐低氧能力比较
黄颡鱼属于小型、底栖鱼类, 目前有关黄颡鱼耐低氧能力的研究主要是围绕黄颡鱼耗氧率[14, 15]和窒息点[15]、在低氧胁迫条件下氧化应激反应[16, 17]以及分子应对机制[6, 17]等几个方面。杨凯等[15]通过对不同规格黄颡鱼的窒息点和瞬时耗氧率研究表明: 黄颡鱼属于低窒息点(0.33—0.60 mg/L)鱼类, 窒息点随体长的增加而逐渐降低; 呼吸类型为顺应型, 瞬时耗氧率随溶氧水平的下降而逐渐降低。张国松等[17]通过对瓦氏黄颡鱼应对低氧胁迫的分子机制研究发现: 瓦氏黄颡鱼为了应对急性低氧环境, 在转录水平上通过miRNA-mRNA pairs调控一些重要的信号通路(如 HIF-1 signaling pathway、Glycolysis/Gluconeogenesis、AMPK signaling pathway等)并导致包括促进血红细胞增殖, 促进血管生成,抑制细胞凋亡; 有氧代谢和无氧代谢的转换; 减少能量消耗和生物合成等一系列生物学过程。同时张国松等[17]对瓦氏黄颡鱼氧化应激反应的研究结果表明: 瓦氏黄颡鱼在同一溶氧水平条件下, 不同组织的耐低氧程度也不同, 导致不同组织在氧化应激下的酶活性和各个指标变化存在差异。
乳酸脱氢酶(LDH)存在于机体所有组织细胞的细胞质内, 是参与糖无氧酵解和糖异生的重要酶可以在缺氧条件下为鱼体生命活动提供能量, 常被用来作为衡量无氧代谢能力的重要指标。在低氧胁迫后LDH活性上升且随着时间延长LDH活性未出现明显下降, 说明杂交黄颡鱼和普通黄颡鱼在低氧条件下均可通过无氧代谢为机体提供能量。乳酸脱氢酶主要存在于机体各组织器官中, 当机体各组织器官受损时, 可引起血液中LDH含量的改变[18]。在低氧胁迫前(0时)杂交黄颡鱼和普通黄颡鱼血清和肝脏中LDH活性没有显著性差异(P>0.05); 在低氧胁迫后 6h 杂交黄颡鱼血清中LDH活性显著低于普通黄颡鱼血清中LDH活性(P<0.05), 说明相比与普通黄颡鱼, 在低氧胁迫条件下杂交黄颡鱼受到的损伤更小。通过杂交黄颡鱼和普通黄颡鱼血清和肝脏中LDH活性变化表明: 相比于普通黄颡鱼, 杂交黄颡鱼的低氧耐受能力要高于普通黄颡鱼。
低氧环境会加速生物体内活性氧(ROS)的产生, 包括一些活性氧自由基和过氧化氢(H2O2)、二氧化氮等活性物质。活性氧会对生物造成氧化胁迫, 导致生物细胞膜流动性降低和通透性增加、蛋白质功能的丧失以及DNA的损伤和突变等, 因此生物能否快速有效地清除活性氧是其能否在低氧环境下生存的关键[19]。超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是生物体中能够对活性氧发挥作用的抗氧化酶, 广泛分布于机体血液和各个组织器官中。SOD可以催化活性氧自由基超氧阴离子转变成 H2O2, 是生物体中最先对活性氧自由基作出反应的抗氧化酶[20], 并且能够对环境胁迫反应表现出明显的活力变化[17]。总抗氧化能力(T-AOC)是生物体内抗氧化酶体系和抗氧化物体系抗氧化能力的总和, 是反映抗氧化能力的重要指标之一。有研究表明在不同溶氧水平条件下, 黄颡鱼体内抗氧化酶活性会发生明显变化[21]。本研究在低氧胁迫条件下, 杂交黄颡鱼和普通黄颡鱼血清和肝脏中SOD活性均呈现出先升高后降低的趋势, 这一结果与姜景腾等[5]研究低氧胁迫对真鲷(♀)与黑鲷(♂)杂交子一代体内酶活力的影响中肝脏SOD活性变化趋势以及强俊[22]、谢明媚等[23]研究低温胁迫对尼罗罗非鱼幼鱼和银鲳幼鱼血清和肝脏中SOD活性变化趋势相似。当低氧胁迫时杂交黄颡鱼和普通黄颡鱼机体产生更多的活性氧自由基对机体细胞和组织器官造成损伤促使机体SOD活性升高, 随着胁迫时间的延长, 过量的活性氧自由基可能会超过机体自我调节阈值导致SOD活性降低。CAT能够将SOD催化活性氧自由基超氧阴离子生成的H2O2分解成 H2O与O2使得 H2O2 不至于与O2反应生成危害性更大的−OH。CAT与SOD接连发挥作用, 但本研究发现肝脏CAT的活性变化与SOD的活性变化趋势相反, 这一结果与姜景腾等[5]研究低氧胁迫对真鲷(♀)与黑鲷(♂)杂交子一代体内酶活力的影响中肝脏CAT活性呈先下降后上升变化趋势相同; 与王春琳等[24]在曼氏无针乌贼耗氧率及溶氧胁迫对其体内酶活力的影响研究中低氧胁迫后CAT活性呈先升后降趋势相反。杂交黄颡鱼和普通黄颡鱼血清中CAT活性呈现上升趋势, 肝脏中CAT活性先降低后升高, 这一结果与谢明媚等[23]研究急性温度胁迫对银鲳幼鱼抗氧化和免疫指标的影响中高温胁迫对肝脏造成损伤促使鱼体细胞通透性增加因此肝脏 CAT 活性降低而血清CAT活性升高这一结果相似。因此, 在不同物种不同胁迫条件下肝脏CAT活性变化趋势还有待研究。在低氧胁迫后, 杂交黄颡鱼和黄颡鱼血清和肝脏中SOD活性和T-AOC较低氧胁迫前(0时)均会表现出明显上升, 而随着胁迫时间的延长, 抗氧化酶活性降低, 这一结果表明: 在低氧胁迫条件下, 杂交黄颡鱼和普通黄颡鱼短时间均可以通过改变血清和肝脏中抗氧化酶活性来适应低氧环境, 但随着胁迫时间的延长超过自身调节阈值仍会对鱼体造成氧化损伤。在低氧胁迫后, 肝脏中CAT活性下降有学者认为是低氧胁迫条件下活性氧的大量产生直接抑制了CAT活性[25]。在低氧胁迫后, 杂交黄颡鱼血清和肝脏中LDH活性、SOD活性、CAT活性和 T-AOC变化幅度大于普通黄颡鱼血清和肝脏中LDH活性、SOD活性、CAT活性和T-AOC变化幅度, 表明在低氧胁迫条件下, 相比于普通黄颡鱼, 杂交黄颡鱼抗氧化能力更高。
缺氧诱导基因(HIF-1)是细胞缺氧应答反应的全局性调控因子, 广泛存在于各种高低等动物体内[26], 被喻为哺乳动物在转录水平上应答低氧的总开关[27]。HIF-1由HIF-1α和HIF-1β两部分构成, 在细胞核内聚合生成具有生物活性的HIF-1。HIF-1α是HIF-1独有亚基, 也是功能单位。细胞内HIF-1α mRNA持续表达, 在常氧条件下HIF-1α生成后会迅速分解, 在细胞内水平很低, 当细胞内氧分压变化时HIF-1α降解途径被破坏在细胞内会迅速积累[28]; HIF-1β是HIF-1的结构单位且 HIF-1βmRNA和蛋白水平均不受氧分压影响[6]。张慧[6]通过对黄颡鱼 HIF-1α 基因克隆和表达分析发现, 常氧条件下HIF-1α mRNA在肝脏、肾脏、腮中均有表达而在低氧诱导后表达量均显著升高。本研究通过低氧胁迫后0、6h、12h 和 24h杂交黄颡鱼和普通黄颡鱼缺氧诱导基因(HIF-1α)的相对表达量变化发现杂交黄颡鱼和普通黄颡鱼脑和肝脏中HIF-1α的相对表达量均在低氧胁迫后出现显著性上升(P<0.05)且在低氧胁迫6h和12h杂交黄颡鱼缺氧诱导基因(HIF-1α)的相对表达量均高于普通黄颡鱼。
综合研究结论表明: 在相同养殖条件下, 杂交黄颡鱼幼鱼比普通黄颡鱼幼鱼具有更快的生长速度、更高的存活率以及更低的饵料系数。通过对杂交黄颡鱼幼鱼和普通黄颡鱼幼鱼低氧胁迫条件下无氧代谢能力、抗氧化能力以及缺氧诱导基因相对表达量三方面分析, 表明表明杂交黄颡鱼“黄优1号”幼鱼比普通黄颡鱼幼鱼具有更好的低氧耐受能力。
-
图 1 杂交黄颡鱼和黄颡鱼幼鱼肝脏乳酸脱氢酶活性
不同字母标识表示同一时间点酶活存在显著性差异, “*”表示较低氧胁迫 0 酶活存在显著性差异; 下同
Figure 1. The effect of hypoxia on LDH activities in the liver of P. fulvidraco and P. vachelii ♂ ×P. fulvidraco ♀
For each time, different shoulder letters indicate significant differences. “*” indicate significant differences in 0 enzyme activity under low oxygen stress; the same applies below
表 1 基础饲料组成和营养水平
Table 1 Composition and nutrient levels of the basal diet
项目Item 含量Content (%) 原料Ingredients 鱼粉Fish meal 30.00 豆粕Soybean meal 40.00 面粉Wheat bran 20.00 氯化胆碱 Choline chloride 0.50 磷酸二氢钙Ca(H2PO4)2 1.00 豆油Soybean oil 6.50 维生素预混料Vitamin premix1 1.00 矿物质预混料Mineral premix2 1.00 合计Total 100.0 营养水平Nutrient levels(实测值) 水分Moisture 9.84 粗蛋白Crude protein 39.35 粗脂肪Crude lipid 7.32 灰分Ash 15.47 注: 1. 维生素预混料为每千克饲料提供: VA 2.5 mg, VD3 0.15 mg, VE 100 mg, VK3 30 mg, VB1 120 mg, VB2 30 mg, VB6 45 mg, VB12 0.1 mg, 烟酰胺 nicotinic acid 150 mg, 生物素1.8 mg, 叶酸2 mg, 肌醇 500 mg, 泛酸钙 150 mg; 2. 矿物质预混料为每千克饲料提供: Ca(H2PO4)·H2O 20 mg, MnSO4·H2O 25 mg, ZnSO4·H2O 60 mg, KI 25 mg, MgSO4·H2O 200 mg, CoCl2·H2O 2 mg, FeSO4·H2O 30 mgNote: 1. The vitamin premix provided the following per kg of diets: VA 2.5 mg, VD3 0.15 mg, VE 100 mg, VK3 30 mg, VB1 120 mg, VB2 30 mg, VB6 45 mg, VB12 0.1 mg, nicotinic acid 150 mg, biotin 1.8 mg, folic acid 2 mg, inositol 500 mg, calcium pantothenate 150 mg; 2. The mineral premix provided the following per kg of diets: Ca(H2PO4)·H2O 20 mg, MnSO4·H2O 25 mg, ZnSO4·H2O 60 mg, KI 25 mg, Mg SO4·H2O 200 mg, CoCl2·H2O 2 mg, FeSO4·H2O 30 mg 表 2 引物序列
Table 2 Primer sequence
引物名称Primer name 引物序列Primer sequence (5′-3′) HIF-f6 CCACCTCAACAAGACACAT HIF-f6 GTCACACAACACACACAGT AF GCTATGAGCTGCCTGACGG AR TAAGAAGCATTTGCGGTGG 表 3 杂交黄颡鱼和普通黄颡鱼幼鱼生长对比
Table 3 Growth characteristics of P. fulvidraco and P. vachelii ♂ × P. fulvidraco ♀
种类
Species初始体重
IBM (g)终末体重
TBM (g)增重率
WG (%)特定生长率
SGR (%/d)饲料系数
FCR存活率
SR (%)杂交黄颡鱼
P. vachelii ♂ ×P. fulvidraco ♀2.05±0.15 19.42±1.65b 848.42±30.63b 4.02±0.06b 1.18±0.03 87.78±1.92b 普通黄颡鱼
P. fulvidraco1.94±0.14 15.35±1.43a 689.57±23.07a 3.69±0.05a 1.37±0.06 67.78±1.92a 注: 同一列中不同上标表示差异显著Note: The same line values with different shoulder letters indicate significant differences (P<0.05) 表 4 杂交黄颡鱼和普通黄颡鱼幼鱼形态学指标
Table 4 The morphological indicators of P. fulvidraco and P. vachelii ♂ ×P. fulvidraco ♀
种类
Species脏体比
VSI肝体比
HSI肥满度
CF (g/cm3)杂交黄颡鱼
P. vachelii ♂ ×P. fulvidraco ♀6.33±0.13 1.46±0.07 1.74±0.08 普通黄颡鱼
P. fulvidraco6.14±0.21 1.42±0.10 1.68±0.11 -
[1] 王令玲, 仇潜如, 邹世平, 等. 黄颖鱼生物学特点及其繁殖和饲养. 淡水渔业, 1989, (6): 23—24 Wang L L, Qiu Q R, Zou S P, et al. Biological characteristics of yellow catfish and its reproduction and breeding [J]. Freshwater Fisheries, 1989, (6): 23—24 [
[2] Secor D H, Gunderson T E. Effects of hypoxia and the temperature on survival, growth and respiration of juvenile Atlantic sturgeon, Acipenser oxyrinchus [J]. Fishery Bulletin-National Oceanic and Atmospheric Aelministration, 1998, (96): 603—613
[3] Richards, J G. Physiological, behavioral and biochemical adaptations of intertidal fishes to hypoxia [J]. Journal of Experimental Biology, 2011, 214(2): 191—199 doi: 10.1242/jeb.047951
[4] 杨晗. 周期性低氧驯化对南方鲇(Silurus meridionalis Chen)幼鱼耐低氧能力、运动及生长的影响. 硕士学位论文. 重庆师范大学, 重庆. 2013 Yang H. Effects of cyclic hypoxia domestication on the tolerance, movement and growth of juvenile Silurus meridionalis Chen [D]. Thesis for Master of Science. Chongqing Normal University, Chongqing. 2013
[5] 姜景腾, 吴雄飞, 蒋宏雷. 低氧胁迫对真鲷(♀)与黑鲷(♂)杂交子一代体内酶活力的影响. 宁波大学学报(理工版), 2010, 23(4): 10—14 doi: 10.3969/j.issn.1001-5132.2010.04.003 Jiang J T, Wu X F, Jiang H L. Hypoxia stress on red porgy (♀) with black bream (♂) hybrid generation of the influence of enzyme in the body [J]. Journal of Ningbo University (
Natural Science & Engineering Edition ) , 2010, 23(4): 10—14 [ doi: 10.3969/j.issn.1001-5132.2010.04.003 [6] 张慧. 黄颡鱼HIF-1α基因克隆与表达特征分析. 硕士学位论文. 河北大学, 保定. 2010 Zhang H. Cloning and expression of HIF-1α in yellow catfish [D]. Thesis for Master of Science. Hebei University, Baoding. 2010
[7] 李镕, 韩林强, 艾丽, 等. 两种杂交黄颡鱼的生长与形态差异分析. 水产养殖, 2016, 37(10): 29—35 doi: 10.3969/j.issn.1004-2091.2016.10.006 Li R, Han L Q, Ai L, et al. Analysis of the growth and morphological differences of two hybrid catfishes [J]. Aquaculture, 2016, 37(10): 29—35 [ doi: 10.3969/j.issn.1004-2091.2016.10.006
[8] 张国松, 陶攀峰, 陈嘉玮, 等. 黄颡鱼属鱼类遗传育种研究进展. 水产科技情报, 2015, 42(3): 123—128 Zhang G S, Tao P F, Chen J W, et al. Progress in the study of the genetic breeding of the yellow catfish genus [J]. Fisheries Science & Teehnology Information, 2015, 42(3): 123—128 [
[9] 张佳佳, 张国松, 张宏叶, 等. 黄颡鱼(♀) × 瓦氏黄颡鱼(♂)双亲及其杂交子代核型和营养成分分析. 海洋渔业, 2017, 39(2): 149—161 doi: 10.3969/j.issn.1004-2490.2017.02.004 Zhang J J, Zhang G S, Zhang H Y, et al. Pelteobagrus fulvidraco (♀) x Pelteobagrus vachell (♂) parents and their hybrid offspring karyotype and nutrition analysis [J]. Marine Fisheries, 2017, 39(2): 149—161 [ doi: 10.3969/j.issn.1004-2490.2017.02.004
[10] 陈建明, 黄爱霞, 沈斌乾, 等. 杂交黄颡鱼、雄性瓦氏黄颡鱼和黄颡鱼的形体指数及肌肉营养组成比较分析. 水产科技情报, 2017, 44(6): 320—324 Chen J M, Huang A X, Shen B Q, et al. Comparative analysis of body indices and muscle nutrient composition of hybrid catfish, male Pelteobagrus vachell and Pelteobagrus fulvidraco [J]. Fisheries Science & Teehnology Information, 2017, 44(6): 320—324 [
[11] Hulata G, Wohlfarth G W, Karplus I, et al. Evaluation of Oreochromus niloticus × O. arueus hybrid progeny of different geographical isolates, reared under varying management regimes [J]. Aquaculture, 1993, 115(3-4): 253—271 doi: 10.1016/0044-8486(93)90141-K
[12] Hulata G. A review of genetic improvement of the common carp (Cyprinus carpio L.) and other cyprinids by crossbreeding, hybridization and selection [J]. Aquaculture, 1995, 129(1-4): 481—491
[13] 李炎璐, 陈超, 翟介明, 等. 鱼类杂交育种技术及其在石斑鱼类中的应用. 海洋渔业, 2012, 34(1): 102—109 doi: 10.3969/j.issn.1004-2490.2012.01.016 Li Y L, Chen C, Zhai J M, et al. Fish hybridization and its application in grouper [J]. Marine Fisheries, 2012, 34(1): 102—109 [ doi: 10.3969/j.issn.1004-2490.2012.01.016
[14] 庞旭, 袁兴中, 曹振东, 等. 溶氧水平对瓦氏黄颡鱼幼鱼静止耗氧率和临界游泳运动能力的影响. 水生生物学报, 2012, 36(2): 255—261 Pang X, Yuan X Z, Cao Z D, et al. Effects of dissolved oxygen level on static oxygen consumption rate and critical swimming ability of juvenile Pelteobagrus vachelli [J]. Acta Hydrobiologica Sinica, 2012, 36(2): 255—261 [
[15] 杨凯, 樊启学, 张磊, 等. 黄颡鱼瞬时耗氧率与窒息点的研究. 水生态学杂志, 2012, 33(2): 127—131 Yang K, Fan Q X, Zhang L, et al. Cloning and expression of HIF-1α in yellow catfish [J]. Journal of Hydroecology, 2012, 33(2): 127—131 [
[16] 杨凯. 溶氧水平对黄颡鱼生长、代谢及氧化应激的影响. 硕士学位论文, 华中农业大学, 武汉. 2010 Yang K. Effects of dissolved oxygen level on growth, metabolism and oxidative stress of yellow catfish [D]. Thesis for Master of Science. Huazhong Agriculture University, Wuhan. 2010
[17] 张国松. 瓦氏黄颡鱼应对低氧胁迫的分子机制研究. 硕士学位论文, 南京师范大学, 南京. 2017 Zhang G S. Research on the molecular mechanism of Pelteobagrus vachelli in coping with hypoxic stress [D]. Thesis for Master of Science. Nanjing Normal University, Nanjing. 2017
[18] 冀德伟, 李明云, 王天柱, 等. 不同低温胁迫时间对大黄鱼血清生化指标的影响. 水产科学, 2009, 28(1): 1—4 doi: 10.3321/j.issn:1005-8737.2009.01.001 Ji D W, Li LY, Wang T Z, et al. Effects of different low temperature stress time on serum biochemical parameters of Larimichthys crocea [J]. Fisheries Science, 2009, 28(1): 1—4 [ doi: 10.3321/j.issn:1005-8737.2009.01.001
[19] Storey K B. Oxidative stress: Animal adaptations in nature [J]. Brazilian Journal of Medical and Biological Research, 1996, 29(12): 1715—1733
[20] Jm M C, Fridovich I. Superoxide dismutase: An enzymeatic function for erythrocuprein (Hemocuprein) [J]. Journal of Biological Chemistry, 1969, 244(6): 49—55
[21] 江天久, 牛涛. 重金属Cu2+, Pb2+和Zn2+胁迫对近江牡蛎(Crassostrea rivularis) SOD活性影响研究. 生态环境学报, 2006, 15(2): 289—294 doi: 10.3969/j.issn.1674-5906.2006.02.018 Jiang T J, Niu T. Effects of heavy metals Cu2+, Pb2+ and Zn2+ on SOD activity of Crassostrea rivularis [J]. Ecological and Environmental Sciences, 2006, 15(2): 289—294 [ doi: 10.3969/j.issn.1674-5906.2006.02.018
[22] 强俊, 杨弘, 王辉, 等. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响. 海洋与湖沼, 2012, 43(5): 943—953 doi: 10.11693/hyhz201205011011 Qiang J, Yang H, Wang H, et al. Effects of acute temperature stress on biochemical parameters and HSP70 mRNA expression in juvenile Oreochromis niloticus of gifu strain [J]. Oceanologia et Limnologia Simca, 2012, 43(5): 943—953 [ doi: 10.11693/hyhz201205011011
[23] 谢明媚, 彭士明, 张晨捷, 等. 急性温度胁迫对银鲳幼鱼抗氧化和免疫指标的影响. 海洋渔业, 2015, 37(6): 541—549 doi: 10.3969/j.issn.1004-2490.2015.06.009 Xie M M, Peng S M, Zhang C J, et al. Effects of acute temperature stress on antioxidant and immune indexes of juvenile silver pomfret [J]. Marine Fisheries, 2015, 37(6): 541—549 [ doi: 10.3969/j.issn.1004-2490.2015.06.009
[24] 王春琳, 吴丹华, 董天野. 曼氏无针乌贼耗氧率及溶氧胁迫对其体内酶活力的影响. 应用生态学报, 2008, 19(11): 2420—2427 Wang C L, Wu D H, Dong T Y. Effects of oxygen consumption rate and dissolved oxygen stress on the enzyme activity in Sepiella maindroni de Rochebrune [J]. Chinese Journal of Applied Ecology, 2008, 19(11): 2420—2427 [
[25] Lushchak V I, Bagnyukova T V, Lushchak O V. Hypoxia and recovert perturb free radical processess and anti- oxidant potential in commom carp (Cyprinus carpio) tissues [J]. International Journal of Biochemistry & Cell Biology, 2005, 37(6): 1319—1330
[26] Kalle T, Rytkönen, Kristiina A M, et al. Comparison of hypoxia-inducible factor-1alpha in hypoxia-sensitive and hypoxia-tolerant fish species [J]. Comparative Biochemistry and Physiology,Part D Genomics & Proteomics, 2007, 2(2): 177—186
[27] Nikinmaa M, Rees B B. Oxygen-dependent gene expression in fishes [J]. Regulatory Integrative and Comparative Physiology, 2005, 288(5): 1079—1090 doi: 10.1152/ajpregu.00626.2004
[28] Kallio P J, Wilson W J, O'Brian S, et al. Regulation of the hypoxia-inducible transcription factor1α by the ubiquitin proteasome pathway [J]. Journal of Biological Chemistry, 1999, 274(10): 6519—6525 doi: 10.1074/jbc.274.10.6519
-
期刊类型引用(22)
1. 左鹏翔,金方彭,王志飞,吴俊颉,赵静霞,赵利刚,王文玉,毕晓敏,沈智敏,李波,冷云. 细鳞裂腹鱼(♀)与鲈鲤(♂)杂交及生长对比试验初报. 中国农学通报. 2024(11): 159-164 .  百度学术
百度学术
2. 曹文韬,秦溱,王晓清. 同工酶技术及其在水产动物中的应用. 江西水产科技. 2024(04): 69-74 .  百度学术
百度学术
3. 赵诚,李谣,宁先会,王涛,尹绍武. 我国鲿科鱼类遗传育种研究进展. 水产学报. 2024(11): 93-109 .  百度学术
百度学术
4. 余志德,黄小林,庄杰贵,陈怡飚,李涛,杨育凯,黄忠,舒琥. 紫红笛鲷幼鱼环境耐受能力研究. 水产科技情报. 2024(06): 354-361 .  百度学术
百度学术
5. 唐东姣,冯鹏霏,黄亮华,何金钊,秦秀东,马华威,陈子桂,李恩军,易祖晓,陈少翠,秦荣娟,徐佳智,潘传燕. 饲料蛋白质水平对杂交黄颡鱼生长、消化酶活性和抗氧化能力的影响. 渔业研究. 2023(03): 280-286 .  百度学术
百度学术
6. 王岳松,李鸿,矣林圆,刘婧文,沈志刚,杨慧君,袁勇超. 大豆皂甙对杂交黄颡鱼生长、免疫及肠道健康的影响. 水生生物学报. 2023(09): 1386-1395 .  本站查看
本站查看
7. 冯鹏霏,潘传燕,马华威,陈秀荔,杨琼,陈子桂,冯勇翔,唐东姣,李华. 饲料中添加马尾藻多糖对杂交黄颡鱼生长性能、血清生化指标、消化酶活性和抗氧化能力的影响. 动物营养学报. 2023(07): 4485-4494 .  百度学术
百度学术
8. 杨贺舒,孙俊霄,杨慧君,樊启学,袁勇超. 低蛋白饲料对杂交黄颡鱼幼鱼生长性能、体组成、转氨酶活性和抗氧化能力的影响. 水生生物学报. 2022(01): 79-87 .  本站查看
本站查看
9. 陆泽峰,黄和,黄湘湄,黄伟镇. 低氧胁迫对珍珠龙胆石斑鱼氧化应激及能量代谢的影响. 广东海洋大学学报. 2022(01): 13-19 .  百度学术
百度学术
10. 段鹏飞,田永胜,李振通,李子奇,陈帅,黎琳琳,王心怡,王林娜,刘阳,李文升,王晓梅,李波. 棕点石斑鱼(♀)×蓝身大斑石斑鱼(♂)杂交后代与棕点石斑鱼低氧耐受能力初步研究. 中国水产科学. 2022(02): 220-233 .  百度学术
百度学术
11. 张美东,凌晨,沙航,陈梦,王丹,罗相忠,邹桂伟,梁宏伟. 低氧-复氧胁迫对鲢抗氧化酶活性及Cu/Zn-SOD和Mn-SOD基因表达的影响. 水生生物学报. 2022(04): 498-506 .  本站查看
本站查看
12. 宋立民,刘肖莲,贾磊,蔡超,姚学良,薄其康,郝俊,丁子元. 牙鲆“鲆优2号”试养效果评估. 北方农业学报. 2022(03): 104-110 .  百度学术
百度学术
13. 程景颢,李谣,沈铭浩,杨智茹,张伟健,张凯,王涛,张国松,尹绍武. 低氧胁迫和恢复对杂交黄颡鱼“黄优1号”肠道组织的影响. 水生生物学报. 2022(11): 1598-1608 .  本站查看
本站查看
14. 余锐,何珊,梁旭方. 翘嘴鳜与斑鳜、花鲈、大口黑鲈杂交试验. 淡水渔业. 2021(02): 103-106 .  百度学术
百度学术
15. 杨贺舒,孙俊霄,袁勇超,樊启学,李明波,莫爱杰. 蝇蛆粉替代鱼粉对杂交黄颡鱼生长性能、体组成和抗氧化能力的影响. 水生生物学报. 2021(03): 573-581 .  本站查看
本站查看
16. 凌晨,张美东,沙航,邹桂伟,罗相忠,梁宏伟. 低氧胁迫对鲢抗氧化酶活性及SODs基因表达的影响. 淡水渔业. 2021(03): 53-59 .  百度学术
百度学术
17. 宋立民,张韦,刘肖莲,徐晓丽,姜巨峰,焦万明,阚峥,杨文颖,吴会民. 杂交黄颡鱼新品种试养效果评估. 农学学报. 2021(12): 100-104 .  百度学术
百度学术
18. 陈付菊,付生云,令小东,常兰,李雪源. 低氧胁迫对青海湖裸鲤肌肉线粒体呼吸链复合体酶及抗氧化酶活性的影响. 广东海洋大学学报. 2021(06): 118-124 .  百度学术
百度学术
19. 徐畅,丁炜东,曹哲明,邴旭文,张晨光,谷心池,刘雨. 急性低氧胁迫对翘嘴鳜抗氧化酶、呼吸相关酶活性及相关基因表达的影响. 南方农业学报. 2020(03): 686-694 .  百度学术
百度学术
20. 李明波,沈凡,崔庆奎,齐飘飘,王银海,张海龙,丁运敏,沈志刚. 壳寡糖对杂交黄颡鱼“黄优1号”(黄颡鱼♀×瓦氏黄颡鱼♂)生长性能与免疫机能的影响. 水生生物学报. 2020(04): 707-716 .  本站查看
本站查看
21. 齐明,侯懿玲,刘韬,苗艺馨,庄淑婷,曲宪成,刘其根. 急性低氧胁迫和复氧恢复对青田田鱼幼鱼氧化应激和能量代谢的影响. 淡水渔业. 2020(06): 92-98 .  百度学术
百度学术
22. 宋立民,李明泽,李仰真,马林,吴会民,刘义,李楠. 不同条件下牙鲆血清免疫学指标的比较. 安徽农业科学. 2020(22): 94-98 .  百度学术
百度学术
其他类型引用(16)



 下载:
下载: