SPECIES DIVERSITY AND COMMUNITY STRUCTURE OF ZOOPLANKTON IN SUMMER AND WINTER IN THE EAST LAKE, WUHAN
-
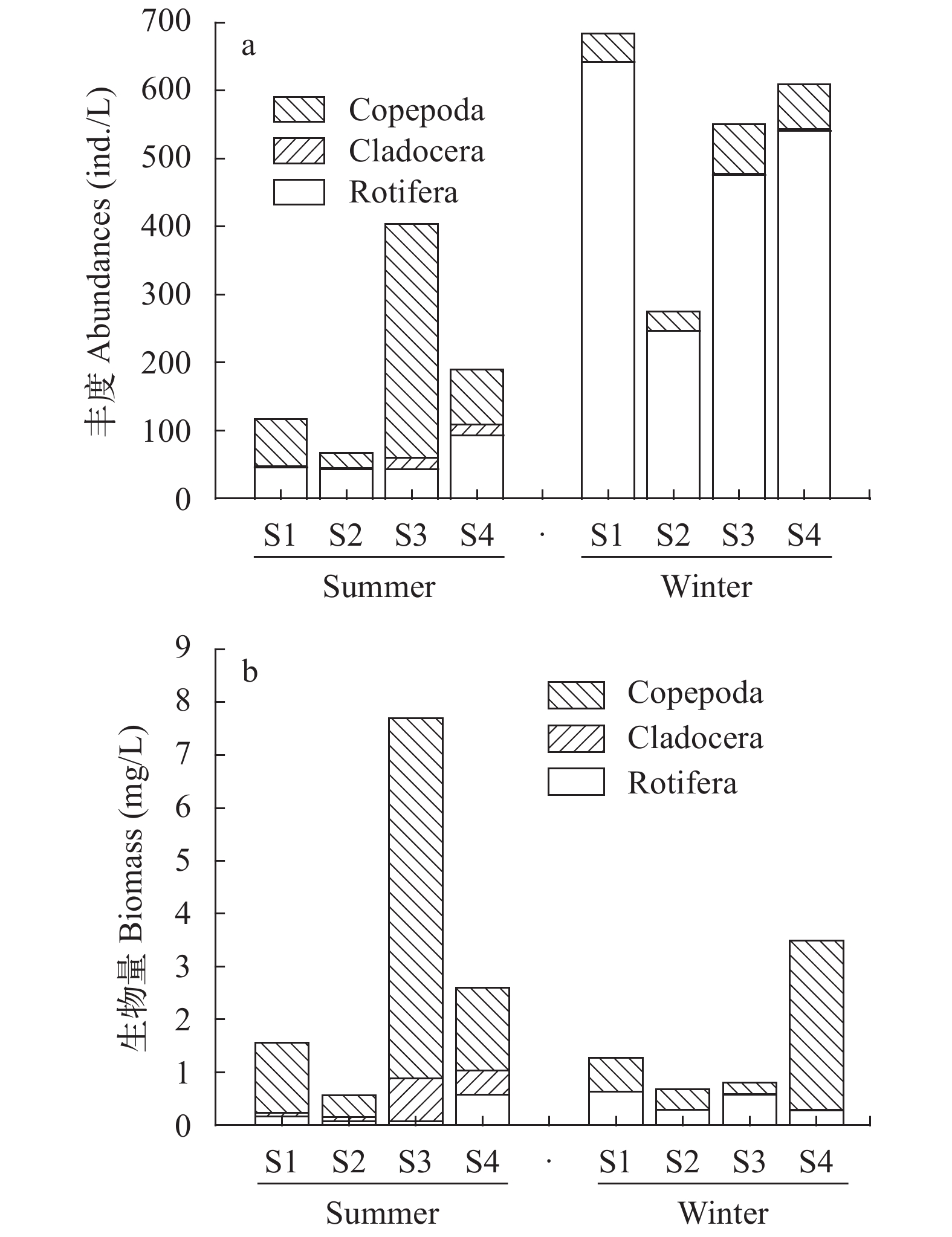
摘要: 2018年7月、8月、12月及2019年1月, 对武汉东湖沿岸带的浮游动物群落分夏冬两季进行了调查研究。共鉴定出浮游动物35属50种, 其中轮虫22属37种、枝角类10属10种、桡足类3属3种。夏季优势物种为跨立小剑水蚤(Microcyclops varicans)、裂足臂尾轮虫(Brachionus diversicornis)和微型裸腹溞(Moina micrura); 冬季优势物种为长肢多肢轮虫(Polyarthra dolichoptera)、疣毛轮虫(Synchaeta spp.)、角突臂尾轮虫(Brachionus angularis)和犀轮虫(Rhinoglena sp.)。将观察到的浮游动物进行了图像信息采集, 并确定了部分物种SSU rRNA序列, 为淡水浮游动物的研究提供了参考资料。参考武汉东湖浮游动物研究的历史文献数据, 东湖数十年来浮游动物物种数逐渐下降, 轮虫优势物种由寡污型转为β-中污型甚至α-中污型。夏冬两季东湖浮游动物群落结构具有明显差异, 夏季轮虫平均密度(56.2 ind./L)和生物量(0.22 mg/L)低于冬季(476.3 ind./L、0.44 mg/L), 而甲壳类密度(137.8 ind./L)和生物量(2.88 mg/L)高于冬季(53.1 ind./L、1.12 mg/L)。夏季浮游动物群落Margalef丰富度指数、Shannon-Wiener多样性指数和Simpson多样性指数均高于冬季, 夏冬两季Pielou均匀度指数差异不大, 水质评价表明东湖夏季(中污染)优于冬季(重污染)。夏冬两季温度、溶解氧、pH、盐度和ORP五种环境因子均存在极显著差异, RDA分析表明, 其中温度对浮游动物群落结构的影响最大。Abstract: This study investigated the zooplankton community in the East Lake in July, August, December 2018 and January 2019 and identified a total of 50 species of the zooplankton belonged to 35 genera, including 37 Rotifera belonged to 22 genera, 10 Cladocera belonged to 10 genera, and 3 copepoda belonged to 2 genera. The dominant species were Microcyclops varicans, Brachionus diversicornis, and Moina micrura in summer and Polyarthra dolichoptera, Synchaeta spp., Brachionus angularis, and Rhinoglena sp. in winter. The image information of all observed zooplankton was collected, and the SSU rRNA gene sequences of dominant species were determined to provide reference data for the identification of freshwater zooplankton. According to the historical data about zooplankton in Wuhan East Lake, the number of zooplankton species in the East Lake has decreased gradually in the past few decades, and the dominant species of rotifers have changed from oligosaprophyte to beta-mesosaprobity or even alpha-mesosaprobity. The zooplankton community structure in East Lake was significantly different in summer and winter. The rotifer density (56.2 ind./L) and biomass (0.2188 mg/L) in summer were lower than those in winter (476.3 ind./L, 0.4415 mg/L), while the crustacean density (137.8 ind./L) and biomass (2.8831 mg/L) were higher than those in winter (53.1 ind./L, 1.1187 mg/L). The Margalef richness index, Shannon-Wiener diversity index and Simpson diversity index of the zooplankton community in summer were higher than those in winter. The Pielou evenness index is not different between summer and winter. The water quality evaluation showed that the water quality in summer (moderately polluted) was better than that in winter (heavily polluted). There were significant differences in temperature, dissolved oxygen, pH, salinity and ORP between summer and winter. Redundancy Analysis (RDA) indicated that temperature had the greatest influence on zooplankton community structure.
-
Keywords:
- the East Lake /
- Zooplankton /
- Species diversity /
- Community structure
-
微藻在水产养殖中的作用越来越重要, 不但可以作为饵料生物, 提高水产动物幼体的成活率[1]; 而且可以调节水质, 消除氮磷, 抑制病害发生[2]。温度、盐度、光照是影响海洋微藻生长和代谢的重要生态因子, 直接影响细胞内的光合电子传递、代谢途径调控、特异性酶反应和细胞的通透性等, 是影响藻细胞生长、油脂积累和脂肪酸组成的重要因素。大量研究表明改变微藻的培养条件和培养周期, 不但会影响微藻生长速率, 还会影响海洋微藻的油脂含量以及脂肪酸组成, 特别是PUFA、EPA和DHA的含量, 而且两者往往不同步, 所以很多学者提出“分级培养”或“二次培养”[3—6]。
STR01是一种扭鞘藻(Streptotheca sp.), 是本实验室从象山港海区新分离的一株生长快、不易老化和污染、耐高温的浮游硅藻。该藻隶属于硅藻门、中心纲、盒形硅藻目、真弯藻科、扭鞘藻属。该藻壳面呈椭圆形, 壳环面长方形, 壳长22—38 μm, 壳宽12—19 μm, 色素体黄褐色片状。初步试验表明是一种理想的贝类育苗饵料。但有关该藻的生态习性及培养方法迄今为止未见报道。为此, 本文通过单因子和正交试验进行了温度、盐度、光照强度对该藻的生长、总脂和脂肪酸组成影响的研究, 以期为扭鞘藻的进一步开发利用提供理论依据。
1. 材料与方法
1.1 藻种及培养
STR01藻种保藏于宁波大学饵料生物培养室, 实验药品均为分析纯; 培养用水为象山港海域天然海水, 经沙滤、暗沉淀、脱脂棉过滤、烧开, 凉冷后使用; 培养液采用宁波大学#3母液配方[4]。藻种置于GXZ智能型光照培养箱(宁波江南仪器厂)中活化和扩大, 培养静置不充气, 每天定时摇藻 2 次, 早晚各1次。培养条件: 温度 (25±1)℃, 光照 60 μmol/(m2·s), 光暗周期(L﹕D) 12﹕12。
1.2 实验方法
温度试验 设置温度梯度10、15、20、25、30和35℃, 培养容器为消毒的1000 mL三角烧瓶, 各6平行。每瓶加培养液900 mL(宁波大学3#培养液配方), 接种100 mL, 其他培养条件: 光照强度60 μmol/(m2·s), 光周期(L﹕D) 12﹕12, 盐度25, pH 8.10, 所有试验瓶均放在GXZ智能型光照培养箱, 培养时间7d。接种后计数N0, 7d后计数Nt, 采用离心机(Centrifuge 5430 R)藻液离心(6000 r/min)收集藻, 存放并冷冻干燥(–80℃, FD5-3T, Gold-SIM), 测定总脂和脂肪酸。
光照强度试验 设置光照强度梯度40、60、80、100和120 μmol/(m2·s), 各6平行。培养条件: 温度25℃, 光周期(L﹕D) 12﹕12, 盐度25, pH 8.1, 其他条件同上。
盐度试验 盐度梯度设置为10、15、20、25、30和35, 各6平行。培养条件: 光照强度60 μmol/(m2·s), 光周期(L﹕D) 12﹕12, 温度25℃, pH 8.1。其他条件同上。
温、光、盐正交试验 本试验采用温度(A)、光照强度(B)和盐度(C)三因素三水平正交试验(表 1), 其他培养条件: 光周期(L﹕D) 12﹕12, pH 8.1, 其他条件同上。
表 1 正交试验参数因数水平表Table 1. The orthogonal test parameter-factor level水平
Level因素
FactorA B C 1 20 40 20 2 25 60 25 3 30 80 30 1.3 总脂含量及脂肪酸的测定
总脂的抽取及测定 采用改良Bligh-Dyer方法[7, 8]。取一定体积藻液, 6000 r/min离心10min, 再用消毒淡水清洗2—3次, 冷冻干燥保存(FD5-3T, Gold-SIM)。将干燥的藻泥用研钵研碎后, 采用氯仿﹕甲醇提取法, 得出总脂含量。
脂肪酸组成分析 采用KOH甲醇水法[9, 10]。总脂用5%—6%KOH-甲醇﹕水(体积比为4﹕1)皂化2h(60℃水浴), 2 mL氯仿: 正己烷(体积比1﹕4)提取; 后甲酯化, 旋转蒸发蒸用正己烷(色谱纯)到离心管中离心, 取上清液, 再进行GL-MS分析。用6890N/5973气相色谱-质谱联用仪按照面积归一化法计算各组分的相对百分含量。
1.4 统计与数据处理
平均相对生长速率计算公式为: K=(ln Nt-ln N0) /t(式中, N0为初始细胞数目、Nt为培养7d后的细胞数、t为培养时间)。得出的实验数据用平均值(Mean)±标准差(SD)表示, 单因素方差分析(ANOVA)和多元方差分析(MANOVA)以及Duncan多重比较分析(α=0.05)均用SPSS 17.0 统计软件, 用2007版Excel进行图表制作。
2. 结果
2.1 温度对STR01的生长、总脂含量及脂肪酸的影响
温度对STR01生长和总脂含量的影响 不同温度对STR01的平均相对生长速率影响显著(P<0.05)。该藻在15—35℃内, 随着温度升高平均相对生长速率呈先上升后降低趋势, 在30℃时该藻的平均相对生长速率最大(K值为0.682), 但25℃组与30℃组平均相对生长速率差异不显著(P>0.05), 温度在10℃条件下, 培养7d大部分藻死亡分解, 藻液颜色变白。所以该藻适合的温度是15—35℃, 最适温度为25—30℃(图 1)。
在温度10—35℃内, 温度10℃时, 由于藻体死亡分解, 无法收集, 量不足无法完成总脂含量的测定。在15—35℃的温度下, 温度对该藻的总脂含量有影响显著(P<0.05), 随着温度升高, 该藻总脂含量先增加后减少, 其中25℃时总脂含量最高(17.23%), 且显著高于其他组(P<0.05)(表 2)。
表 2 温度对STR01的脂肪酸组成和含量的影响(%)Table 2. Effects of temperature on fatty acid composition and content in STR01 (%)脂肪酸
Fatty acid温度
Light intensity (℃)15 20 25 30 35 C14﹕1 2.51±0.02a 1.29±0.01c 1.11±0.03d 1.43±0.02b 2.40±0.01a C14﹕0 11.70±0.11c 11.80±0.19c 14.40±0.23a 12.85±0.09b 8.94±0.19d C15﹕0 1.20±0.25b 1.51±0.17a 0.53±0.05c 1.01±0.07b 0.23±0.06d C16﹕1 8.66±0.22c 9.51±0.25b 10.60±0.26a 10.20±0.16a 5.44±0.18d C16﹕0 31.20±0.20b 25.00±0.17c 25.60±0.13bc 24.90±0.18d 32.60±0.28a C18﹕2 (n–6) 1.12±0.21b 0.80±0.25c 1.10±0.17b 1.10±0.12b 1.35±0.13a C18﹕3 (n–3) 3.75±0.32e 5.03±0.14c 7.25±0.24a 6.23±0.16b 4.10±0.05d C18﹕0 24.70±0.10b 16.80±0.31d 15.30±0.23e 20.40±0.13c 31.20±0.42a C20﹕5 (n–3) 0.11±0.02d 0.41±0.20c 0.44±0.09c 0.52±0.09b 1.11±0.29a C20﹕4 (n–6) 10.47±0.12d 24.80±0.34a 20.10±0.26b 16.32±0.28c 9.59±0.17e C20﹕2 1.17±0.08b 0.21±0.06d 0.66±0.14c 2.40±0.36a 1.32±0.26b C22﹕6 (n–3) 1.87±0.09b 2.16±0.17a 2.12±0.23a 1.76±0.23b 0.07±0.02c C22﹕2 1.54±0.41a 0.82±0.22c 0.83±0.16c 0.92±0.06b 1.47±0.21a SFA 68.80±0.31b 55.11±0.20d 55.83±0.33d 59.16±0.07c 72.97±0.17a MUFA 11.17±0.16b 10.80±0.12c 11.71±0.30a 11.63±0.32a 7.84±0.24d PUFA 20.03±0.11d 34.23±0.23a 32.50±0.35b 29.52±0.16c 19.01±0.08e n–3 PUFA 5.73±0.23d 7.60±0.04c 9.81±0.17a 8.51±0.26b 5.28±0.05e n–6 PUFA 11.59±0.29d 25.60±0.09a 21.20±0.34b 17.42±0.30c 10.94±0.13e 温度对STR01脂肪酸组成和含量的影响 本试验共测定出该藻含13种主要脂肪酸, 其中饱和脂肪酸(SFA) 4种, 单不饱和脂肪酸(MUFA) 2种, 多不饱和脂肪酸(PUFA) 7种。主要脂肪酸为C14﹕0、C16﹕1、 C16﹕0、 C18﹕0和C20﹕4 (n–6)。试验结果表明, 温度对该藻PUFA、EPA含量影响显著(P<0.05), 在温度15—30℃内, 该藻PUFA的含量随着温度的升高呈现先上升后下降的趋势, PUFA的含量为19.01%—34.23%, 30℃时PUFA的含量最高(34.23%)。该藻的EPA和DHA含量极少, 在15—35℃条件下EPA含量为0.11%—1.11%, DHA含量为0.07%—2.16%。
2.2 光照强度对STR01的生长、总脂含量及脂肪酸的影响
光照强度对STR01生长和总脂含量的影响 不同的光照强度对STR01的平均相对生长速率影响显著(P<0.05)。该藻在40—120 μmol/(m2·s), 随着光照强度的升高生长速率呈先上升后降低趋势, 60 μmol/(m2·s)时平均相对生长速率最大(K值0.630), 且显著高于其他组。该藻生长的适合的光照强度是40—120 μmol/(m2·s), 最适光强为60 μmol/(m2·s)。
光照强度在60 μmol/(m2·s)时该藻的总脂含量显著高于较其他组(P<0.05), 此时含量最高(16.73%)。总脂含量按照从高到低的排序60 μmol/(m2·s)(16.73%)>40 μmol/(m2·s)(13.07%)≥100 μmol/(m2·s)(9.37%)>80 μmol/(m2·s)(6.87%)>120 μmol/(m2·s)(6.67%)(图 2)。
光照强度对STR01脂肪酸组成和含量的影响 由表 3所示, 不同光照强度对该藻PUFA影响显著(P< 0.05), 低光照[40 μmol/(m2·s)]时PUFA含量最高(34.29%)。PUFA中主要是C20﹕4 (n–6)的含量, 光照[80 μmol/(m2·s)]时达18.20%。该藻的EPA和DHA含量不高, 各组差异显著(P< 0.05)。光照强度为20 μmol/(m2·s)该藻EPA最高(2.88%), 光照强度为80 μmol/(m2·s)该藻DHA最高(2.23%)。
表 3 光照强度对STR01的脂肪酸组成和含量的影响Table 3. Effects of light intensity on fatty acid composition and content in STR01 (%)脂肪酸
Fatty acid光照强度
Light intensity [μmol/(m2·s)]40 60 80 100 120 C14﹕1 2.23±0.21a 1.51±0.25b 0.82±0.43c 1.67±0.16b 2.50±0.20a C14﹕0 9.64±0.11d 12.00±0.19c 17.30±0.26a 8.00±0.20e 13.20±0.21b C15﹕0 1.02±0.13c 1.13±0.10b 1.89±0.08a 1.08±0.07c 1.32±0.12b C16﹕1 7.38±0.11c 8.25±0.18b 10.40±0.23a 7.20±0.07c 10.40±0.27a C16﹕0 31.20±0.19a 31.90±0.15a 25.10±0.13c 31.80±0.21a 29.90±0.13b C18﹕2 (n–6) 1.68±0.12a 1.61±0.21a 1.47±0.32b 1.26±0.07b 1.19±0.09c C18﹕3 (n–3) 2.58±0.31d 4.16±0.26b 5.99±0.24a 4.18±0.11a 3.68±0.17c C18﹕0 16.70±0.09c 19.00±0.19b 13.10±0.12d 20.10±0.22a 21.40±0.15a C20﹕5 (n–3) 2.88±0.09a 1.08±0.19c 1.71±0.12b 1.53±0.12b 1.10±0.07c C20﹕4 (n–6) 17.70±0.13b 14.21±0.25c 18.20±0.21a 17.90±0.29b 12.00±0.21d C20﹕2 2.26±0.11a 1.84±0.18c 0.09±0.01e 2.03±0.09b 1.05±0.16d C22﹕6 (n–3) 1.09±0.10c 1.20±0.09b 2.23±0.28a 1.32±0.14b 0.91±0.21c C22﹕2 3.09±0.15a 2.03±0.17b 0.79±0.16d 1.94±0.15b 1.25±0.15c SFA 59.76±0.18c 64.03±0.13b 57.39±0.23d 65.98±0.10a 66.82±0.17a MUFA 10.01±0.21c 9.76±0.12d 11.22±0.11b 8.87±0.17e 13.00±0.22a PUFA 34.29±0.45a 27.72±0.05d 33.29±0.15b 28.16±0.10c 23.08±0.31e n–3 PUFA 18.58±0.17c 20.16±0.21b 24.22±0.08a 17.32±0.22d 20.59±0.28b n–6 PUFA 19.48±0.18c 15.61±0.29d 20.57±0.30b 21.90±0.14 a 13.19±0.12e 2.3 盐度对STR01的生长、总脂含量及脂肪酸的影响
盐度对STR01生长的影响 不同的盐度对STR01的平均相对生长速率影响显著(P<0.05)。在盐度10—35, 随着盐度的升高STR01平均相对生长速率呈先上升后降低趋势, 盐度25时平均相对生长速率最高(K为0.634), 盐度为10时扭鞘藻的数量几乎没有增加(图 3)。该藻生长的适合盐度范围是10—35, 最适盐度为25。
盐度对STR01的总脂含量影响显著(P< 0.05)。在盐度10—35, 随着盐度的升高, 该藻总脂含量呈先增加后减少趋势, 盐度30时最高(13.66%), 且显著高于其他组(图 3)。
盐度对STR01脂肪酸组成和含量的影响 盐度对STR01的脂肪酸组成及含量影响显著(P< 0.05)。盐度10—35 时PUFA的含量随着温度的升高呈现先上升后下降的趋势, 盐度25时PUFA的含量最高(43.42%)。PUFA中主要是C20﹕4 (n–6)的含量, 盐度25时达27.20%。在盐度10—35 条件下EPA含量为1.06%—9.80%, DHA含量为1.92%—2.66%。在盐度25、30、35时EPA含量大幅度增加, 分别达9.80%、9.16%和7.25%, 特别是盐度25时, EPA含量高达9.80%(表 4)。
表 4 盐度对STR01的脂肪酸组成和含量的影响Table 4. Effects of salinity on fatty acid composition and content in STR01 (%)脂肪酸
Fatty acid盐度
Salinity10 15 20 25 30 35 C14﹕1 1.44±0.11a 1.45±0.18a 1.47±0.24a 0.53±0.12b 0.57±0.14b 0.43±0.06c C14﹕0 11.80±0.25e 12.40±0.33d 12.60±0.28d 17.80±0.19c 18.50±0.09b 22.20±12a C15﹕0 1.80±0.04a 1.79±0.19a 1.76±0.07a 1.16±0.20b 0.91±0.18c 0.90±0.23c C16﹕1 10.20±0.13d 10.80±0.24d 10.90±0.21d 12.10±0.12c 14.80±0.09b 16.80±0.11a C16﹕0 31.40±0.23a 31.40±0.22a 30.50±0.09b 18.90±0.25d 20.10±0.17c 21.00±0.09c C18﹕2 (n–6) 0 1.46±0.21b 1.60±0.20b 1.89±0.13a 1.46±0.07b 1.06±0.11c C18﹕3 (n–3) 5.37±0.10a 4.67±0.30b 4.75±0.05b 1.44±0.12c 1.46±0.20c 0.95±0.34d C18﹕0 16.80±0.19a 16.20±0.15a 16.20±0.05a 6.13±0.14b 6.72±0.10b 5.97±0.14c C20﹕5 (n–3) 1.24±0.32c 1.07±0.03d 1.06±0.12d 9.80±0.11a 9.16±0.09a 7.25±0.17b C20﹕4 (n–6) 14.50±0.07d 14.00±0.18d 14.50±0.11d 27.20±0.32a 22.10±0.16b 20.10±0.23c C20﹕2 1.18±0.21a 1.20±0.22a 0.97±0.09a 0.35±0.11c 0.75±0.11b 0.69±0.09c C22﹕6 (n–3) 2.42±0.12a 2.04±0.08a 2.35±0.13a 2.23±0.25a 2.66±0.31a 1.92±0.04b C22﹕2 1.87±0.17a 1.59±0.09b 1.33±0.26c 0.51±0.05e 0.76±0.11d 0.62±0.21d SFA 61.80±0.34a 61.79±0.03a 61.06±0.22a 43.99±0.13d 46.23±0.19c 50.07±0.23b MUFA 11.64±0.09d 12.26±0.22c 12.37±0.17c 12.63±0.19c 15.37±0.34b 17.23±0.26a PUFA 26.58±0.40d 26.03±0.32d 26.56±0.12d 43.42±0.36a 38.35±0.11b 32.59±0.15c n–3 PUFA 9.03±0.14c 7.78±0.21d 8.16±0.31d 13.47±0.05a 13.28±0.10a 10.12±0.11b n–6 PUFA 14.50±0.03f 15.46±0.40e 16.10±0.25d 29.09±0.31a 23.56±0.13b 21.16±0.06c 2.4 温光盐正交试验对STR01生长、总脂及脂肪酸的影响
温光盐正交试验对STR01生长和总脂的影响 采用温度(A)、光照强度(B)、盐度(C)进行正交试验, 结果藻细胞生长和总脂含量见表 5。生长最优组合为: A3B2C2, 即温度30℃、光照强度60 μmol/(m2·s)、盐度25, 该组合时平均相对生长速率最大(K值达0.756); 总脂含量积累的最优组合为A3B2C1即温度30℃、光照强度60μmol/(m2·s)、盐度20, 总脂含量可达20.00%。
表 5 STR01生长速率和总脂正交试验设计Table 5. Orthogonal test design of the relative growth ratio and total lipid combination of STR01试验号
Test numberA B C 生长速率
K-value总脂含量
Total fat
content (%)1 1 1 1 0.385 14.8 2 1 1 2 0.419 12.3 3 1 1 3 0.288 16.4 4 1 2 1 0.382 14.2 5 1 2 2 0.328 12.8 6 1 2 3 0.285 13.6 7 1 3 1 0.160 12.5 8 1 3 2 0.318 15.7 9 1 3 3 0.223 12.3 10 2 1 1 0.333 13.8 11 2 1 2 0.524 14.4 12 2 1 3 0.606 17.5 13 2 2 1 0.360 17.0 14 2 2 2 0.723 16.4 15 2 2 3 0.580 13.1 16 2 3 1 0.406 17.1 17 2 3 2 0.619 12.6 18 2 3 3 0.641 14.3 19 3 1 1 0.560 12.2 20 3 1 2 0.506 13.5 21 3 1 3 0.571 14.7 22 3 2 1 0.494 20.0 23 3 2 2 0.756 16.2 24 3 2 3 0.673 16.1 25 3 3 1 0.460 14.1 26 3 3 2 0.521 13.7 27 3 3 3 0.504 14.4 影响STR01生长的正交因素主次为A>C>B, 3因素中温度对STR01平均相对生长速率影响最大(表 6), 在置信区间95%的情况下, 得出3个因素对平均相对生长速率影响的显著性排序为FA>FC>FB, 即温、光、盐对该藻平均相对生长速率的可靠性影响的大小顺序为A>C>B, 与方差分析的结果一致(表 7)。温度和盐度对该藻生长速率的影响有高度显著差异(P=0.000); 光照强度对STR01平均相对生长速率有显著差异(P=0.012); 温度和盐度有交互作用, 且交互作用极度显著(P=0.000); 温度、光照强度和盐度这三者的交互作用显著(P=0.001)。
表 6 生长速率极差分析Table 6. Range analyses of relative growth ratio试验号
Test number温度
Temperature光照强度
Light intensity盐度
Salinity第一水平均值Ki1 0.310 0.466 0.393 第二水平均值Ki2 0.532 0.509 0.524 第三水平均值Ki3 0.561 0.428 0.486 极差R 0.251 0.081 0.131 极差顺序
Extreme order1 3 2 表 7 生长速率方差分析Table 7. ANOVA of the relative growth ratio来源
SourceⅢ型平方和
Type Ⅲ SS自由度
df均方
MSF值
F valuesP值
P values温度
Temperature0.835 2 0.418 59.921 0.000 光照
Light intensity0.066 2 0.033 4.759 0.012 盐度
Salinity0.244 2 0.122 17.490 0.000 温度×光照
Temperature×
Light intensity0.038 4 0.009 1.357 0.261 温度×盐度
Temperature×
Salinity0.212 4 0.053 7.614 0.000 光照×盐度
Light intensity×
Salinity0.002 4 0.001 0.084 0.987 温×光×盐
Temperature×Light
intensity×Salinity0.209 8 0.026 3.753 0.001 同样影响STR01总脂正交因素主次为B>A>C, 即光照强度对总脂含量的影响最大(表 8、表 9)。温度和光照强度对该藻总脂含量影响高度显著(P=0.000), 盐度对该藻总脂含量影响有显著差异(P=0.002)。温度和光照、光照和盐度之间有交互作用(P=0.000); 温、光、盐三者有交互作用(P=0.000)。
表 9 总脂含量方差分析Table 9. ANOVA of total lipid content来源
SourceⅢ型平方和
Type Ⅲ SS自由度
df均方
MSF值
F valuesP值
P values温度
Temperature28.583 2 14.292 17.659 0.000 光照
Light intensity29.858 2 14.929 18.446 0.000 盐度
Salinity11.807 2 5.904 7.294 0.002 温度×光照
Temperature×
Light intensity61.505 4 15.376 18.999 0.000 温度×盐度
Temperature×
Salinity5.218 4 1.305 1.612 0.185 光照×盐度
Light intensity×
Salinity68.540 4 17.135 21.172 0.000 温×光×盐
Temperature×Light
intensity×Salinity82.101 8 10.263 12.681 0.000 表 8 总脂含量极差分析Table 8. Range analyses of total lipid content实验号
Test number温度
Temperature光照强度
Light intensity盐度
Salinity第一水平均值Ki1 13.844 14.400 15.078 第二水平均值Ki2 15.133 15.489 14.178 第三水平均值Ki3 14.989 14.078 15.300 极差R 1.289 1.411 1.122 极差顺序
Extreme order2 1 3 温光盐正交试验对STR01脂肪酸组成和含量的影响 在试验设定的组合下, PUFA含量最高时的组合为A2B2C1(温度25℃、光照强度60 μmol/(m2·s)、盐度20), 此时PUFA含量为35.37%, 该组合与组合为A2B3C1(温度25℃、光照强度80 μmol/(m2·s)、盐度20)无显著性差异。PUFA中主要是C20﹕4 (n–6)的含量, 组合为A2B2C1(温度25℃、光照强度 60 μmol/(m2·s)、盐度20)时C20﹕4 (n–6)的含量最高为23.80%, 组合为A3B2C1(温度30℃、光照强度60 μmol/(m2·s)、盐度20)时含量最高为21.90%。该藻的EPA和DHA含量虽然极少, 但在A3B2C1(温度30℃、光照强度60 μmol/(m2·s)、盐度20)条件下该藻的EPA含量达到最高(2.91%) A2B2C1 (温度25℃、光照强度60 μmol/(m2·s)、盐度20)条件下该藻的DHA含量达到最高(2.56%)(表 10)。
表 10 正交试验对扭鞘藻的脂肪酸组成和含量的影响Table 10. Effect of orthogonal test on fatty acid composition and content in STR01 (%)脂肪酸
Fatty acid三因子
Three-factorA1B1C1 A1B2C1 A1B3C1 A1B1C2 A1B2C2 A1B3C2 A1B1C3 A1B2C3 A1B3C3 C14﹕1 2.10±0.27b 1.72±0.19c 1.85±0.21c 1.84±0.13c 1.98±0.22c 1.72±0.09c 3.29±0.10a 2.36±0.31b 1.96±0.11c C14﹕0 11.70±0.52e 14.80±0.25c 11.00±0.13e 11.60±0.08e 10.80±0.12e 10.30±0.14e 6.69±0.22g 8.45±0.03f 11.40±0.17d C15﹕0 1.35±0.43b 1.67±0.18b 1.41±0.45b 1.17±0.04c 1.02±0.36c 1.22±0.08c 0.65±0.15c 1.09±0.34c 1.78±0.03b C16﹕1 10.60±0.75a 10.10±0.43b 11.20±0.06a 9.80±0.13b 10.10±0.21b 11.40±0.56a 7.48±0.22c 10.30±0.07b 10.20±0.61b C16﹕0 29.70±0.27b 27.80±0.76c 28.40±0.14c 26.60±0.04d 28.74±0.14b 27.80±0.94c 30.57±0.65a 28.10±0.90b 27.70±0.54c C18﹕2 (n–6) 0.66±0.09e 1.03±0.07d 0.58±0.17f 0.63±0.34f 0.99±0.28d 0.75±0.08e 1.11±0.09d 0.62±0.08f 0.93±0.04e C18﹕3 (n–3) 3.16±0.09e 4.00±0.04f 5.83±0.12d 5.66±0.08d 5.59±0.18e 5.89±0.18d 7.91±0.14b 6.68±0.17bc 5.22±0.24e C18﹕0 17.10±0.75d 16.30±0.61e 16.40±0.56e 16.80±0.59e 18.70±0.60d 17.00±0.43d 24.90±0.91a 20.70±0.23c 17.10±0.67d C20﹕5 (n–3) 0.24±0.05d 1.01±0.14c 0.55±0.04c 1.01±0.01c 0.59±0.02c 0.58±0.01c 0 0.36±0.07d 0.91±0.05c C20﹕4 (n–6) 19.90±0.21b 17.60±0.45d 16.80±0.87d 20.70±1.01b 16.50±0.88d 18.60±1.41c 11.40±0.55g 15.90±0.82d 17.50±0.98d C20﹕2 1.21±0.07c 1.44±0.07c 1.26±0.01c 0.99±1.01b 1.38±0.04c 1.27±0.03c 2.68±0.04a 1.53±0.02c 1.32±0.07c C22﹕6 (n–3) 1.23±0.32d 1.48±0.23c 1.45±0.19c 0.98±0.08bc 1.33±0.01d 1.57±0.01c 0.78±0.13e 1.59±0.16c 1.72±0.05c C22﹕2 1.09±0.02d 1.00±0.23c 3.31±0.04a 2.21±0.23d 2.28±0.17d 2.30±0.03d 2.57±0.03c 2.32±0.08bd 2.25±0.01d SFA 59.85±0.99c 60.57±1.32c 57.21±1.45e 56.17±0.85f 59.26±1.02d 56.32±0.90e 62.81±1.17b 58.34±1.81d 57.98±0.83d MUFA 12.70±0.15a 11.82±0.13b 13.05±0.08a 11.64±0.34a 12.08±0.42a 13.12±0.27a 10.77±0.51b 12.66±0.46a 12.16±0.29a PUFA 27.49±0.97e 27.56±1.45e 29.78±0.90c 32.18±1.07b 28.66±0.86d 30.96±1.21c 26.45±0.94e 29.00±0.99d 29.85±1.27c n–3PUFA 4.63±0.02f 6.49±0.04d 7.83±0.03b 7.65±0.07b 7.51±0.25c 8.04±0.24b 7.91±0.42a 8.63±0.99e 7.85±0.21c n–6PUFA 20.56±0.76b 18.63±0.23c 17.38±0.65d 21.33±0.78b 17.49±0.08d 19.35±0.93c 12.51±0.67g 16.52±0.87e 18.43±0.96d 3. 讨论
3.1 温度对微藻的影响
温度是影响微藻生长和代谢的重要环境因子之一[11]。温度对海洋微藻的生长及发育等具有调节作用, 对营养物的吸收利用效率、酶的活性、及细胞分裂的周期等存在不同程度不同方式的影响[12]。正交试验结果表明, 温度对STR01平均相对生长速率影响最大, 单因子试验表明: STR01生长的适温为15—35℃, 最适温度25—30℃ (0.679—0.682)。该藻在15—35℃内, 随着温度升高平均相对生长速率呈先上升后降低趋势, 在30℃时该藻的平均相对生长速率最大(K值为0.682), 但25℃组与30℃组平均相对生长速率差异不显著(P> 0.05), 温度在10℃条件下, 培养7d大部分藻死亡分解, 藻液颜色变白。这一结果与金德祥等[13]研究扭鞘藻对温度的适应范围是在10—30℃, 最适温度是在20—25℃的试验结果不一致, 可能由于其试验环境、条件和藻种不同所致。不同海洋微藻对不同的温度的适应能力不同, 海链藻(Thalassiossira sp.)在温度24—27℃时, 其生长则明显受到抑制, 在30℃时则完全不能生长, 但在18—24℃温度范围内, 海链藻具有较高的生长速率[14], 而牟氏角毛藻(Chaetoceros muelleri)是一种耐高温藻种, 其生长的最佳温度为25—35℃。本试验STR01在10℃以下完全不能生长, 在35℃时平均相对生长速率明显降低。
有研究表明, 在极端低温或高温情况下, 微藻合成油脂的含量减少[15—17], STR01在低温15℃和高温35℃时总脂积累很少, 总脂含量也相差不大, 低温和高温对微藻的危害方式并不相同。Opute[16]认为海洋微藻的油脂合成, 在极端温度下微藻的油脂合成受限, 可能是由于合成脂肪相关的酶发生不可逆损伤。低温对微藻的破坏是机械性, 而高温对微藻的破坏是化学性, 大量的研究表明微藻对低温的抵抗和忍耐性较强。不同藻种总脂含量积累的最适温度不同, 本试验总脂含量积累的最适温度是25℃(总脂含量可达17.23%)。三角褐指藻(Phaeodactylum tricornutum)的诱变株MP-2, 总脂积累的最适温度是20℃[18]。硅藻的脂肪酸主要成分有C14﹕0、C16﹕1 (n–7)、C16﹕0, 有些硅藻的富含EPA。扭鞘藻属于硅藻, 本试验表明其主要脂肪酸成分是C14﹕0、C16﹕1、C16﹕0、C18﹕0和C20﹕4 (n–6), 其EPA含量不高。有研究表明海链藻低温处理可明显提高长链多不饱和脂肪酸含量, 但并不是其积累PUFAs的最佳温度[11]。在本试验的单因子试验中, 温度20℃下, PUFA含量最高达34.23%, 在正交试验中, 温度为25℃时, PUFA积累较多, 而30℃该藻平均相对生长速率最高, 若要获得较多的不饱和脂肪酸可考虑分步培养。
3.2 光照强度对微藻的影响
光照影响微藻的生长速率和光合作用, 对细胞体内生化成分产生影响, 光强和照射时间的长短影响微藻光合作用的效率[14, 19]。光是影响海洋微藻生化成分种类和含量多少及其生长的最重要的因子之一, 有研究实验结果表明超过一定的光照强度范围, 微藻生长会受到抑制。本次试验光照强度为60 μmol/(m2·s)时, STR01平均相对生长速率K值达到最大(0.630), 当光照强度超过100 μmol/(m2·s)时, STR01的平均相对生长速率明显降低, 说明高光强不利于该藻的生长。不同的藻种的生长适应的光强不一样, 如后棘藻(Ellipsoidion sp.)在光强较高下生长速率高, 其适宜光强范围为108.75—244.15 μmol/(m2·s), 光强低于71.12 μmol/(m2·s)时生长速率有所降低[20]。多方面的研究显示, 浮游海洋微藻在变化的环境中生存和生长的, 其生理适应是关键过程, 水生浮游植物为了提高其不同环境中生存能力, 可以通过提高对环境因子的适应能力来实现, 特别是在资源能够循环再生的情况下, 这种调节机制更加的明显[21]。
正交试验结果表明, 光照强度对STR01总脂含量的积累影响最大, 单因子试验表明光照强度为60 μmol/(m2·s)时, STR01的总脂含量最高可达 16.73%。单因子试验结果表明, 随着光照强度的升高, 总脂含量呈下降趋势, 表明高光不利于STR01总脂的积累。国内学者对微绿球藻[22]、后棘藻[19]、小球藻和三角褐指藻[23]的研究中也发现PUFA含量随光强增加而呈下降趋势。低光下两种藻小新月菱形藻和等鞭金藻的脂肪含量多, 而高光下则相反[23]。低光照[20 μmol/(m2·s)]更有利于2 株曼氏骨条藻(Skeletonema munzelii)总脂及PUFA的积累[22], 单因子光照强度试验和正交试验都结果表明光强[60 μmol/(m2·s)]有利于STR01的PUFA的积累, 单因子试验结果表明, 随着光照强度的升高, PUFA呈下降趋势, 表明高光不利于STR01PUFA的积累。
3.3 盐度对微藻的影响
本试验结果表明, 适合STR01生长的盐度为15—35, 最适生长盐度为25(K值0.634)。盐度影响藻类的渗透压和营养盐的吸收。当微藻生活的盐度环境发生改变时, 细胞的渗透压受到影响也随之改变, 过低或过高的盐度均会对微藻造成伤害[24, 25]。盐度在 10 以下, STR01几乎完全不能生长, 在盐度 15—35 时, K值呈现先上升后下降趋势。藻种不同, 对盐度的适应力也不同, 亚历山大藻(Alexandrium sp.) 偏嗜较高盐度环境, 在低盐度下几乎不能生长。蛋白核小球藻适盐范围比较广, 在盐度15—45范围内均可以快速生长。
不同藻种的在不同的盐度下, 总脂含量的积累也不同, 本试验STR01总脂含量积累的适宜盐度范围是10—35, 盐度30时, 总脂含量最高(13.66%)。有研究表明高盐有利于总脂的积累, 虽然高盐下微藻的生长率不高。在高盐度下微藻的生长需要更多能量, 藻细胞内的储存的脂肪的含量相应增加[26, 27]。三角褐指藻在较高盐度30—35条件下, 其总脂含量显著高于其他组[18], 本试验在高盐度 30 时总脂含量最高, 与上述试验结果吻合。这种藻产脂应用中可分两步培养。增大培养基的盐度虽使得微绿球藻的生长速率降低, 但有利于油脂积累[28]。本试验的盐度单因子试验表明, 在盐度25时, PUFA含量最高(43.42%), 在正交试验中, 较低盐度(20)有利于该藻PUFA的积累, 在25℃、光照强度60 μmol/(m2·s)和盐度20的条件下STR01的PUFA含量达到35.37%。有试验研究表明, 低盐有利于微藻PUFA的积累, 如盐度(15)更有利于2 株曼氏骨条藻PUFA的积累[22]; 在对绿色巴夫藻的研究中, 低盐度条件下有利于PUFA (n–3)的合成, 盐度为6时C20﹕5 (n–3)的含量最高, 为总脂的6.02%。在实际的大规模培养中, 可以考虑现在最适微藻生长的盐度下培养藻细胞, 然后再转到低盐下培养收集到更多的PUFA。
-
图版 Ⅰ 东湖水体中分离获得的浮游动物的形态学观察图片(标尺: 1、3—13为50 μm; 2为20 μm)
1. 转轮虫; 2. (转轮虫)趾; 3. 尖尾鞍甲轮虫; 4. 盘状鞍甲轮虫; 5. 壶状臂尾轮虫; 6. 剪形臂尾轮虫; 7—8. 裂足臂尾轮虫; 9—10. 萼花臂尾轮虫; 11. 矩形臂尾轮虫; 12. 方形臂尾轮虫; 13—14. 角突臂尾轮虫; 15. 竖琴须足轮虫; 16. 大肚须足轮虫; 17. 裂痕龟纹轮虫; 18. 螺形龟甲轮虫. 其中1、2、5—7、9—12、14—16、 18为活体观察, 3、4、8、13、17经鲁哥染色后观察
图版 Ⅰ. Pictures of zooplankton isolated from the East Lake (Scale bars: 50 μm for 1, 3—13; 20 μm for 2)
1. Rotaria rotatoria; 2. (Rotaria rotatoria) toes; 3. Lepadella ovalis; 4. Lepadella patella; 5. Brachionus urceus; 6. Brachionus forficula; 7—8. Brachionus diversicornis; 9—10. Brachionus calyciflorus; 11. Brachionus leydigi; 12. Brachionus quadridentatus; 13—14. Brachionus angularis; 15. Euchlanis lyra; 16. Euchlanis dilalata; 17. Anuraeopsis fissa; 18. Keratella cochlearis. Among them, 1, 2, 5—7, 9—12, 14—16, 18 are observed in vivo, 3, 4, 8, 13, 17 are observed after staining with Lug’s iodine solution
图版 Ⅳ 东湖中分离的浮游动物的形态学观察图片(续)(标尺: 1为100 μm; 2为20 μm; 3、4、6—8、10、 11、14、15为50 μm; 5、9、12、13为200 μm)
1. 矩型尖额溞; 2. (矩形尖额溞)尾爪; 3. 吻状异尖额溞; 4. 圆形盘肠溞; 5. 球状许水蚤; 6—7. (球状许水蚤)第五胸足; 8. 无节幼体; 9. 近邻剑水蚤; 10. (近邻剑水蚤)第五胸足; 11. (近邻剑水蚤)尾刚毛; 12—13. 跨立小剑水蚤; 14. (跨立小剑水蚤)尾刚毛; 15. (跨立小剑水蚤)第五胸足; 其中1—15均为活体观察
图版 Ⅳ. Pictures of zooplanktons isolated from the East Lake (Continued) (Scale bars: 100 μm for 1; 20 μm for 2; 50 μm for 3, 4, 6—8, 10, 11, 14, 15; 200 μm for 5, 9, 12, 13)
1. Alona rectangula; 2. (Alona rectangula) post-abdominal claw; 3. Disparalona rostrata; 4. Chydorus sphaericus; 5. Schmackeria forbesi; 6—7. (Schmackeria forbesi) the fifth thoracic legs; 8. nauplius; 9. Cyclops vicinus; 10. (Cyclops vicinus) the fifth thoracic legs; 11. (Cyclops vicinus) caudal setae; 12—13. Microcyclops varicans; 14. (Microcyclops varicans) abdominal setae; 15. (Microcyclops varicans) the fifth thoracic legs. All of them are observed in vivo
图版 Ⅲ 东湖水体中分离获得的浮游动物的形态学观察图片(续)(标尺: 2、3、8、11、12、15、16、21为20 μm; 1、4—7、17、19为50 μm; 10、13、14、18为100 μm; 9为200 μm)
1. 长肢多肢轮虫; 2. (长肢多肢轮虫)附肢; 3. (长肢多肢轮虫)腹小鳍; 4. 角三肢轮虫; 5. 端生三肢轮虫; 6. 奇异六腕轮虫; 7. 敞水胶鞘轮虫; 8. 休眠卵; 9. 晶莹仙达溞; 10. 短尾秀体溞; 11. (短尾秀体溞)尾爪; 12. (短尾秀体溞)第一触角; 13. 壳纹船卵溞; 14. 微型裸腹溞; 15. (微型裸腹溞)第一触角; 16. (微型裸腹溞)尾爪; 17. (微型裸腹溞)第二触角; 18. 长额象鼻溞; 19. (长额象鼻溞)额毛; 20. 底栖泥溞; 21. (底栖泥溞)尾爪及肛门; 其中除4为经鲁哥染色后观察外, 其余均为活体观察
图版 Ⅲ. Pictures of zooplankton isolated from the East Lake (Continued) (Scale bars: 20 μm for 2, 3, 8, 11, 12, 15, 16, 21; 50 μm for 1, 4—7, 17, 19; 100 μm for 10, 13, 14, 18; 200 μm for 9)
1. Polyarthra dolichoptera; 2. (Polyarthra dolichoptera) appendage; 3. (Polyarthra dolichoptera) ventral fin; 4. Filinia cornuta; 5. Filinia terminalis; 6. Hexarthra mira; 7. Collotheca pelagica; 8. rotifer resting egg; 9. Sida crystallina; 10. Diaphanosoma brachyurum; 11. (Diaphanosoma brachyurum) post-abdominal claw; 12. (Diaphanosoma brachyurum) first tentacles; 13. Scapholeberis kingi; 14. Moina micrura; 15. (Moina micrura) the first tentacles; 16. (Moina micrura) post—abdominal claw; 17. (Moina micrura) second tentacles; 18. Bosmina longirostris; 19. (Bosmina longirostris) front hair; 20. Ilyocryptus sordidus; 21. (Ilyocryptus sordidus) post—abdominal claw and anus. Among them, 1—3, 5—21 are observed in vivo, 4 is observed after staining with Lug’s iodine solution
图版 Ⅱ 东湖水体中分离获得的浮游动物的形态学观察图片(续)(标尺: 1—5、8—9、11—22为50 μm, 6—7为10 μm, 10为100 μm)
1—2. 曲腿龟甲轮虫; 3. 微型多突轮虫; 4—5. 犀轮虫; 6. (犀轮虫)咀嚼器; 7. (犀轮虫)趾; 8. 蹄形腔轮虫; 9. 囊形单趾轮虫; 10. 多突囊足轮虫; 11. 卜氏晶囊轮虫; 12. 眼镜柱头轮虫; 13. 圆盖柱头轮虫; 14. 椎轮属; 15—16. 巨头轮属; 17. 高蹻轮虫; 18. 暗小异尾轮虫; 19. 等棘异尾轮虫; 20—21. 疣毛轮属; 22. 梳状疣毛轮虫. 其中2、4—16、19、20、22为活体观察, 1、3、17、18、21经鲁哥染色后观察
图版 Ⅱ. Pictures of zooplankton isolated from the East Lake (Continued) (Scale bars: 50 μm for 1—5, 8—9, and 11—22; 10 μm for 6—7; 100 μm for 10)
1—2. Keratella valga; 3. Liliferotrocha subtails; 4—5. Rhinoglena sp.; 6. (Rhinoglena sp.) trophus; 7. (Rhinoglena sp.) toes; 8. Lecane ungulata; 9. Monostyla bulla; 10. Asplanchnopus multiceps; 11. Asplanchna brightwelli; 12. Eoaphora najas; 13. Eosphora thoa; 14. Notommata sp.; 15—16. Cephalodella spp.; 17. Scaridium longicaudum; 18. Trichocerca pusilla; 19. Trichocerca similis; 20—21. Synchaeta spp.; 22. Synchaeta pectinata. Among them, 2, 4—16, 19, 20, 22 are observed in vivo, 1, 3, 17, 18, 21 are observed after staining with Lug’s iodine solution
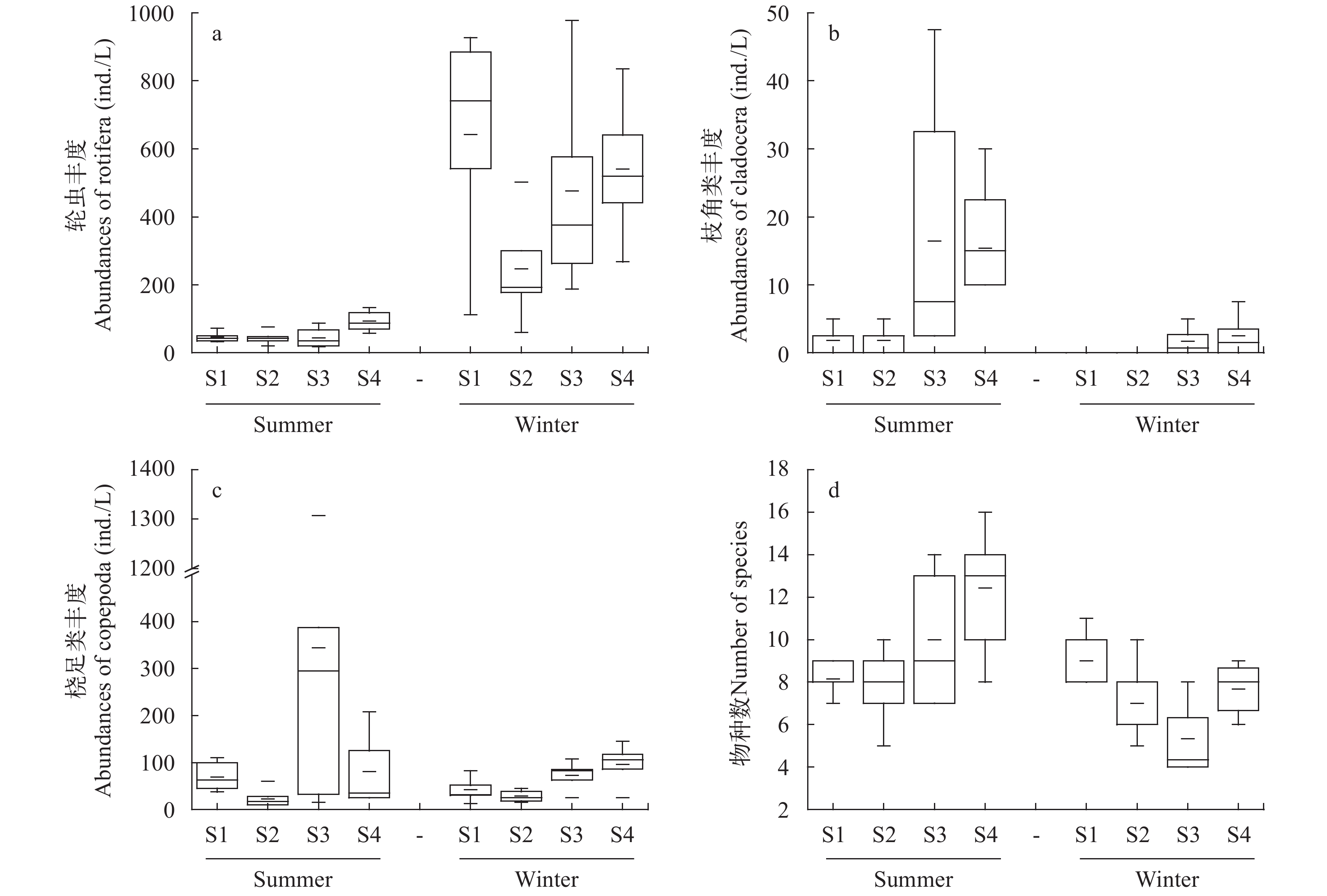
图 3 夏冬两季东湖各点浮游动物类群丰度和物种数比较
a. 轮虫丰度比较; b. 枝角类丰度比较; c. 桡足类丰度比较; d. 定量统计物种数比较
Figure 3. The comparison of the abundance and species number of zooplankton groups in summer and winter in the East Lake
a. comparison of rotifer abundance; b. comparison of cladoceratae abundance; c. comparison of copepods abundance; d. comparison of the total zooplankton species number
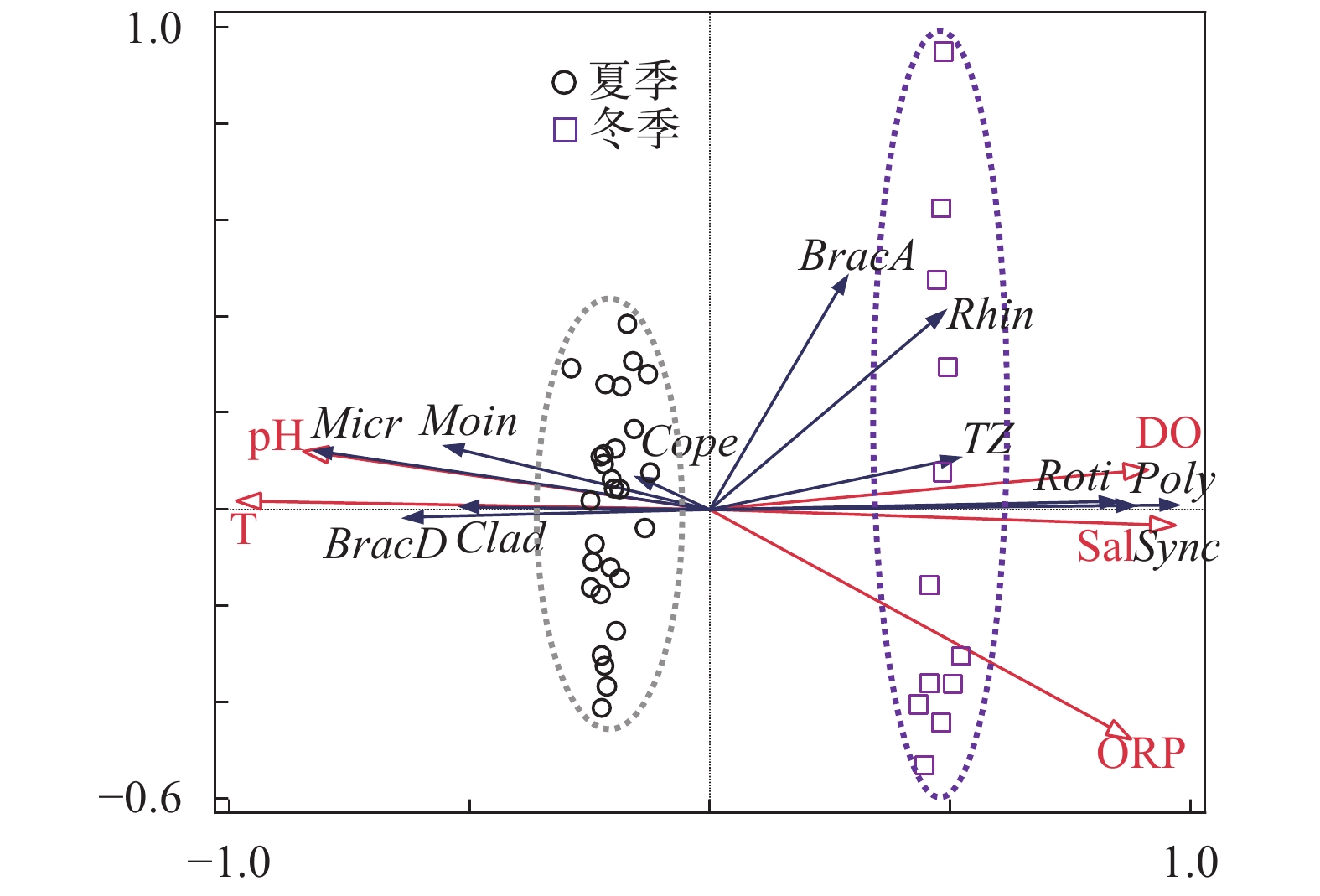
图 4 东湖夏冬两季环境因子与浮游动物种群的冗余分析
T. 温度; pH. 酸碱度; DO. 溶解氧; Sal. 盐度; ORP. 氧化还原电位; BracA. 角突臂尾轮虫; BracD. 裂足臂尾轮虫; Rhin. 犀轮虫; Poly. 长肢多肢轮虫; Sync. 疣毛轮虫; Moin. 微型裸腹溞; Micr. 跨立小剑水蚤; Roti. 轮虫总量; Clad. 枝角类总量; Cope. 桡足类总量; TZ. 浮游动物总量
Figure 4. Redundancy analysis of zooplankton species-environmental factors in summer and winter of the East Lake
T. temperature; pH. pH value; DO. dissolved oxygen; Sal. salinity; ORP. Oxidation-Reduction Potential; angu. Brachionus angularis; dive Schizocerca diversicornis; toki. Rhinoglena sp.; trig. Polyarthra dolichoptera; sync. Synchaeta spp.; chan. Moina chankensis; vari. Microcyclops varicans; Roti. Rotifera; Clad. Cladocera; Cope. Copepoda; TZ. Total zooplankton
表 1 东湖冬夏两季浮游动物的物种组成
Table 1 Species composition of zooplankton in the East Lake in summer and winter
类群
Groups属名
Genus物种
Species夏季
Summer冬季
Winter类群
Groups属名
Genus物种
Species夏季
Summer冬季
Winter轮虫Rotifera 轮虫属 转轮虫Rotaria rotatoria √ 圆盖柱头轮虫Eosphora thoa √ 龟纹轮属 裂痕龟纹轮虫Anuraeopsis fissa √ 椎轮属 椎轮虫Notommata sp. √ 臂尾轮属 矩形臂尾轮虫Brachionus leydigi √ √ 巨头轮属 巨头轮虫Cephalodella spp. √ √ 方形臂尾轮虫Brachionus quadridentatus √ 高蹻轮属 高蹻轮虫Scaridium longicaudum √ 壶状臂尾轮虫Brachionus urceus √ √ 异尾轮属 暗小异尾轮虫Trichocerca pusilla √ 角突臂尾轮虫Brachionus angularis √ √ 等棘异尾轮虫Trichocerca stylata √ 萼花臂尾轮虫Brachionus calyciflorus √ √ 疣毛轮属 疣毛轮虫Synchaeta spp. √ √ 裂足臂尾轮虫Brachionus diversicornis √ 多肢轮属 长肢多肢轮虫Polyarthra dolichoptera √ √ 蒲达臂尾轮虫Brachionus budapestinensis √ 三肢轮属 角三肢轮虫Filinia cornuta √ 尾突臂尾轮虫Brachionus caudatus √ 端生三肢轮虫Filinia maior √ √ 剪形臂尾轮虫Brachionus forficula √ 六腕轮属 奇异六腕轮虫Hexarthra mira √ 龟甲轮属 螺形龟甲轮虫Keratella cochlearis √ 胶鞘轮属 敞水胶鞘轮虫Conochilus unicornis √ √ 曲腿龟甲轮虫Keratella valga √ √ 枝角类Cladocera 薄皮溞属 透明薄皮溞Leptodora Lilljeborg √ 鞍甲轮属 尖尾鞍甲轮虫Lepadella ovalis √ 仙达溞属 晶莹仙达溞Sida crystallina √ 盘状鞍甲轮虫Lepadella patella √ 秀体溞属 短尾秀体溞Diaphanosoma brachyurum √ 须足轮属 竖琴须足轮虫Euchlanis lyra √ 船卵溞属 壳纹船卵溞Scapholeberis kingi √ √ 大肚须足轮虫Euchlanis dilalata √ √ 象鼻溞属 长额象鼻溞Bosmina longirostris √ 多突轮属 微型多突轮虫Liliferotrocha subtilis √ 泥溞属 底栖泥溞Ilyocryptus sordidus √ 犀轮属 犀轮虫Rhinoglena sp. √ 尖额溞属 矩形尖额溞Alona rectangula √ √ 腔轮属 蹄形腔轮虫Lecane ungulata √ 异尖额溞属 吻状异尖额溞Disparalona rostrata √ 单趾轮属 囊形单趾轮虫Monostyla bulla √ 盘肠溞属 圆形盘肠溞Chydorus sphaericus √ 囊足轮属 多突囊足轮虫Asplanchnopus multiceps √ 裸腹溞属 微型裸腹溞Moina micrura √ 晶囊轮属 前节晶囊轮虫Asplanchna priodonta √ 桡足类Copepoda 许水蚤属 球状许水蚤Schmackeria forbesi √ √ 卜氏晶囊轮虫Asplanchna brightwelli √ 剑水蚤属 近邻剑水蚤Cyclops vicinus √ √ 柱头轮属 眼镜柱头轮虫Eoaphora najas √ √ 小剑水蚤属 跨立小剑水蚤Microcyclops varicans √ √ 合计 35属 50种 43种 24种 表 2 东湖水体中优势浮游动物种类的SSU rRNA序列信息
Table 2 SSU rRNA gene sequence information of dominant zooplankton in the East Lake
物种Species 拉丁名Scientific name Genbank登录号Sequence ID 序列长度Sequence length (bp) 比对序列Alignment sequence* 比对物种Alignment species 相似度Similarity (%) 首次上传The first time to submit** 角突臂尾轮虫 Brachionus angularis MK564749 1809 KF141790 Brachionus calyciflorus 98.89 + 萼花臂尾轮虫 Brachionus calyciflorus MK271750 1809 KF141790 Brachionus calyciflorus 99.72 — 裂足臂尾轮虫 Brachionus diversicornis MK106113 1812 KF141790 Brachionus calyciflorus 98.90 + 卜氏晶囊轮虫 Asplanchna brightwelli MK106105 1806 KY859765 Lecane inermis 98.34 + 疣毛轮虫 Synchaeta sp. MK644612 1807 MH481727 Synchaeta oblonga 99.77 — 端生三肢轮虫 Filinia terminalis MK352482 1818 DQ079914 Filinia longiseta 97.85 + 圆形盘肠溞 Chydorus sphaericus MK568074 2121 AM490277 Chydorus sphaericus 98.21 — 跨立小剑水蚤 Microcyclops varicans MK106114 1806 KR048728 Mesocyclops pehpeiensis 98.54 + 注: *比对序列为Genbank上相似度最高的序列; **SSU rRNA全长序列是否首次上传Note: The alignment sequence is the most similar sequence in Genbank. Whether to submit the full-length sequence of SSU rRNA for the first time 表 3 东湖夏冬两季各采样点浮游动物的最大丰度和优势度
Table 3 The highest density and the dominance index of zooplankton detected in the East Lake in summer and winter from four different sampling sites (S1—S4)
物种Species 夏季最大丰度(ind./L)及优势度 The maximum abundance and dominance in summer 冬季最大丰度(ind./L)及优势度 The maximum abundance and dominance in winter S1 S2 S3 S4 Y S1 S2 S3 S4 Y 转轮虫 Rotaria rotatoria 2.5 2.5 2.5 7.5 0.001 0 0 0 0 0 裂痕龟纹轮虫 Anuraeopsis fissa 5 5 5 7.5 0.001 0 0 0 0 0 矩形臂尾轮虫 Brachionus leydigi 0 0 0 2.5 <0.001 0 0 0 0 0 方形臂尾轮虫 Brachionus quadridentatus 0 2.5 0 2.5 <0.001 0 0 0 0 0 壶状臂尾轮虫 Brachionus urceus 0 0 0 0 0 0 0 0 10 <0.001 角突臂尾轮虫 Brachionus angularis 2.5 2.5 17.5 30 0.01 125 7.5 27.5 5 0.024 萼花臂尾轮虫 Brachionus calyciflorus 2.5 20 2.5 25 0.009 2.5 0 0 0 <0.001 裂足臂尾轮虫 Brachionus diversicornis 7.5 32.5 37.5 45 0.048 0 0 0 0 0 蒲达臂尾轮虫 Brachionus budapestinensis 0 0 5 2.5 <0.001 0 0 0 0 0 尾突臂尾轮虫 Brachionus caudatus 0 2.5 2.5 10 <0.001 0 0 0 0 0 剪形臂尾轮虫 Brachionus forficula 2.5 2.5 5 0 <0.001 0 0 0 0 0 螺形龟甲轮虫 Keratella cochlearis 0 0 0 0 0 22.5 10 2.5 0 0.002 曲腿龟甲轮虫 Keratella valga 0 0 0 0 0 2.5 5 2.5 0 <0.001 大肚须足轮虫 Euchlanis dilalata 15 12.5 2.5 12.5 0.011 2.5 2.5 0 0 <0.001 犀轮虫 Rhinoglena sp. 0 0 0 0 0 197.5 2.5 0 7.5 0.021 蹄形腔轮虫 Lecane ungulata 5 10 15 20 0.01 0 0 0 0 0 囊形单趾轮虫 Monostyla bulla 0 0 2.5 2.5 <0.001 0 0 0 0 0 晶囊轮虫 Asplanchna spp. 10 2.5 5 17.5 0.009 0 0 0 0 0 暗小异尾轮虫 Trichocerca pusilla 20 5 12.5 7.5 0.016 0 0 0 0 0 疣毛轮虫 Synchaeta spp. 0 0 0 0 0 237.5 142.5 295 97.5 0.219 长肢多肢轮虫 Polyarthra dolichoptera 10 2.5 5 15 0.008 352.5 305 472.5 480 0.407 角三肢轮虫 Filinia cornuta 0 0 12.5 0 <0.001 0 0 0 0 0 端生三肢轮虫 Filinia terminalis 0 0 2.5 0 <0.001 0 0 0 0 0 奇异六腕轮虫 Hexarthra mira 0 2.5 2.5 0 <0.001 0 0 0 0 0 休眠卵 Eggs 32.5 17.5 27.5 25 0.067 127.5 30 177.5 247.5 0.162 矩形尖额溞 Alona rectangula 2.5 2.5 2.5 17.5 0.003 0 0 0 7.5 <0.001 圆形盘肠溞 Chydorus sphaericus 0 0 0 0 0 0 0 5 0 <0.001 微型裸腹溞 Moina micrura 2.5 5 47.5 22.5 0.024 0 0 0 0 0 近邻剑水蚤 Cyclops vicinus 0 0 0 0 0 7.5 2.5 0 57.5 0.006 跨立小剑水蚤 Microcyclops varicans 97.5 52.5 1262.5 190 0.612 2.5 0 0 7.5 <0.001 球状许水蚤 Schmackeria forbesi 0 0 2.5 0 <0.001 0 2.5 0 0 <0.001 无节幼体 Nauplius 22.5 7.5 45 17.5 0.047 82.5 40 107.5 72.5 0.084 注: 若优势度≥0.02, 即为优势种Note: If the dominance is ≥ 0.02, it is the dominant species 表 4 冬夏两季东湖浮游动物的多样性指数
Table 4 Environmental factors for four stations in the East Lake in summer and winter
采样点Sample sites 夏季 Summer 冬季 Winter Margalef Pielou Shannon-wiener Simpson Margalef Pielou Shannon-wiener Simpson 丰富度指数 均匀度指数 多样性指数 多样性指数 丰富度指数 均匀度指数 多样性指数 多样性指数 S1 1.189 0.620 1.138 0.536 1.035 0.703 1.347 0.698 S2 1.410 0.804 1.473 0.720 0.820 0.593 0.924 0.542 S3 1.350 0.498 0.954 0.446 0.381 0.746 0.694 0.456 S4 1.860 0.737 1.699 0.719 0.809 0.479 0.830 0.421 平均值Mean 1.452 0.665 1.316 0.605 0.762 0.630 0.949 0.529 表 5 东湖浮游动物物种历年组成
Table 5 Comparison of the composition of zooplankton species in East Lake over the years
物种 Species 1960s 1980s 1990s 2006 2018 优势物种Dominant species 角突臂尾轮虫 — + — — + 萼花臂尾轮虫 — + — — — 矩形臂尾轮虫 — + — — — 裂足臂尾轮虫 — — — — + 矩形龟甲轮虫 — + — — — 螺形龟甲轮虫 + + + — — 暗小异尾轮虫 + + + — — 对棘同尾轮虫 + + — — — 特异同尾轮虫 + — — — — 二突异尾轮虫 + — — — — 鼠异尾轮虫 + — — — — 前节晶囊轮虫 — + — — — 疣毛轮虫 — — — — + 尖尾疣毛轮虫 + — — — — 针簇多肢轮虫 + + + — — 长肢多肢轮虫 — — — — + 多须拟前翼轮虫 — — + — — 六腕轮虫 — — + — — 犀轮虫 — — — — + 透明薄皮溞 — + — — — 透明溞 + + — — — 短尾秀体溞 — — + — — 微型裸腹溞 — — + — + 隆线溞 + — — — — 特异荡镖水蚤 + + — — — 长江新镖水蚤 + — — — — 球状许水蚤 — + — — — 近邻剑水蚤 + + + — — 台湾温剑水蚤 — — + — — 广布中剑水蚤 + + + — — 跨立小剑水蚤 — — — — + 物种组成Species composition 轮虫 56—82种 57种 23—59种 39种 21属37种 枝角类 13属24种* — 18种 — 10属10种 桡足类 7—14种 10种 7—10种 — 3属3种 参考文献References [25—29] [26, 29—31] [8, 10, 12, 31—33] [3] 本文 注: *仅指60年代盘肠溞科Note: *Chydoridae of the 1960s only 表 6 多样性指数对水质评价的标准[35]
Table 6 Standards of water quality assessed in terms of diversity index
指数范围Index range 级别Level 评价状态Evaluation of state 水体污染程度Pollution level H'>3 dM>3 丰富 物种种类丰富, 个体分布均匀 清洁 2<H'≤3 2<dM≤3 较丰富 物种丰富度较高, 个体分布比较均匀 轻污染 1<H'≤2 1<dM≤2 一般 物种丰富度较低, 个体分布比较均匀 中污染 0<H'≤1 0<dM≤1 贫乏 物种丰富度低, 个体分布不均匀 重污染 H'=0 dM=0 极贫乏 物种单一, 多样性基本丧失 严重污染 表 7 东湖历年夏冬两季浮游动物数量
Table 7 Comparison of the number of zooplankton (ind./L) in the East Lake over the summer and winter
站点Station 类群Group 1962年[25] 1974年[6] 1975年[6] 1979年[6] 1980年[6] 1991年[8] 2018
年本文I 站Station I 轮虫(夏) 1476 520 112 2450 175 2613 56 轮虫(冬) 409 162 394 800 440 476 枝角类(夏) 11 11 24 204 210 10 9 枝角类(冬) 29 10 31 0 24 1 桡足类(夏) 46.1 8 12 120 25 46 129 桡足类(冬) 27 16 80 40 24 52 II 站Station II 轮虫(夏) 1127 275 3750 5900 525 1127 56 轮虫(冬) 132 190 3000 2800 800 476 枝角类(夏) 10.7 28 28 102 125 11 9 枝角类(冬) 39 38 22 4 22 1 桡足类(夏) 58.6 13 28 48 41 59 129 桡足类(冬) 10 23 30 2 29 52 注: 1962年的数据直接引自相应参考文献; 1974、1975、1979和1980年的数据根据相应文献中对应月份的数据提取而来(夏季取7、8月份数据的平均值;冬季取12月份与1月份数据的平均值); 1991年的参考文献中由于轮虫、枝角类和桡足类在不同月份的丰度的数据不易提取, 所以直接列出了全年的平均值Note: The data of 1962 are directly cited from the corresponding references; The data of 1974, 1975, 1979 and 1980 were extracted according to the data of corresponding months in the corresponding references. In summer, the average data of July and Augest is taken, and the average data of December and January is taken. In the 1991 references, annual averages were listed directly because of the difficulty in extracting data on the abundance of rotifers, clade and copepods in different months -
[1] 王胜男, 陈卫. 浅析淡水浮游动物的种类组成及其生态功能作用 [J]. 生物学通报, 2012, 47(10): 10-13. doi: 10.3969/j.issn.0006-3193.2012.10.004 Wang S N, Chen W. A brief analysis of the species composition and ecological functions of freshwater zooplankton [J]. Bulletin of Biology, 2012, 47(10): 10-13. doi: 10.3969/j.issn.0006-3193.2012.10.004
[2] Aoyagui A S M, Bonecker C C. Rotifers in different environments of the Upper Paraná River floodplain (Brazil): richness, abundance and the relationship with connectivity [J]. Hydrobiologia, 2004, 522(1): 281-290.
[3] 颜庆云. 浮游生物群落DNA指纹分析及其在生态学研究中的应用 [D]. 武汉: 中国科学院水生生物研究所, 2009: 72-74 Yan Q Y. DNA fingerprinting analysis of plankton community and its applications in ecological study [D]. Wuhan: Institute of Hydrobiology, Chinese Academy of Sciences, 2009: 72-74
[4] 李海燕, 施银桃, 曾庆福. 东湖水质分析及光催化氧化降解研究 [J]. 武汉科技学院学报, 2002, 15(5): 51-53. Li H Y, Shi Y T, Zeng Q F. Analysis and photocatalytic degradation for East Lake water sample [J]. Journal of Wuhan Institute of Science and Technology, 2002, 15(5): 51-53.
[5] 饶钦止, 章宗涉. 武汉东湖浮游植物的演变(1956-1975年)和富营养化问题 [J]. 水生生物学集刊, 1980, 7(1): 1-17. Rao Q Z, Zhang Z S. Ecology changes of phytoplankton in lake Dong Hu, Wuhan, during 1956-1975 and the eutrophication problem [J]. Acta Hydrobiologica Sinica, 1980, 7(1): 1-17.
[6] 黄祥飞, 陈雪梅, 伍焯田, 等. 武汉东湖浮游动物数量和生物量变动的研究 [J]. 水生生物学集刊, 1984, 8(3): 345-358. Huang X F, Chen X M, Wu C T, et al. Studies on the changes in abundance and biomass of zooplankton in Lake Donghu Wuhan [J]. Acta Hydrobiologica Sinica, 1984, 8(3): 345-358.
[7] 省政府批准东湖污染综合治理方案 [J]. 湖北环境保护, 1980(4): 65 The provincial government approved a comprehensive pollution control plan for Donghu Lake [J]. Environmental Science & Technology, 1980(4): 65
[8] 杨宇峰, 黄祥飞. 武汉东湖浮游动物群落结构的研究 [J]. 应用生态学报, 1994, 5(3): 319-324. Yang Y F, Huang X F. Structure of zooplankton community in Donghu Lake of Wuhan [J]. Chinese Journal of Applied Ecology, 1994, 5(3): 319-324.
[9] Yang Y F, Huang X F, Liu J K, et al. Effects of fish stocking on the zooplankton community structure in a shallow lake in China [J]. Fisheries Management and Ecology, 2005, 12(2): 81-89. doi: 10.1111/j.1365-2400.2004.00423.x
[10] 杨宇峰, 黄祥飞. 武汉东湖主要养殖水域的浮游甲壳动物群落分析 [J]. 生态学报, 2002, 22(3): 318-325. doi: 10.3321/j.issn:1000-0933.2002.03.005 Yang Y F, Huang X F. Community analysis of crustacean zooplankton in main culture areas of Lake Donghu, Wuhan [J]. Acta Ecologica Sinica, 2002, 22(3): 318-325. doi: 10.3321/j.issn:1000-0933.2002.03.005
[11] 鲁敏, 谢平. 武汉东湖后湖区浮游甲壳动物群落结构的研究 [J]. 水生生物学报, 2002, 26(2): 123-129. doi: 10.3321/j.issn:1000-3207.2002.02.003 Lu M, Xie P. Comparative study on crustacean zooplankton communities in different areas in Lake Donghu, Wuhan [J]. Acta Hydrobiologica Sinica, 2002, 26(2): 123-129. doi: 10.3321/j.issn:1000-3207.2002.02.003
[12] 鲁敏, 谢平. 武汉东湖不同湖区浮游甲壳动物群落结构的比较 [J]. 海洋与湖沼, 2002, 33(2): 174-181. doi: 10.3321/j.issn:0029-814X.2002.02.009 Lu M, Xie P. Comparative study on crustacean zooplankton communities in different areas in Lake Donghu, Wuhan [J]. Acta Hydrobiologica Sinica, 2002, 33(2): 174-181. doi: 10.3321/j.issn:0029-814X.2002.02.009
[13] Koste W. Rotatoria: Die Rädertiere Mitteleuropas [M]. Berlin: Publ. Gebrüder Borntraeger, 1978: 2-673
[14] 王家楫. 中国淡水轮虫志 [M]. 北京: 科学出版社, 1961: 21-288 Wang J J. Freshwater Rotifer Fauna in China [M]. Beijing: Science Press, 1961: 288
[15] 蒋燮治, 堵南山. 中国动物志 (淡水枝角类) [M]. 北京: 科学出版社, 1979: 79-273 Jiang X Z, Du N S. Fauna of China (Freshwater Cladocera) [M]. Beijing: Science Press, 1979: 79-273
[16] 中国科学院动物研究所甲壳动物研究组. 中国动物志 (淡水桡足类) [M]. 北京: 科学出版社, 1979: 53-420 Crustacean Research Group, Institute of Zoology, Chinese Academy of Science. Fauna of China (Freshwater Copepoda) [M]. Beijing: Science Press, 1979: 53-420
[17] Fernando C H. The freshwater zooplankton of Sri Lanka, with a discussion of tropical freshwater zooplankton composition [J]. International Review of Hydrobiology, 2010, 65(1): 85-125.
[18] 黄祥飞. 淡水浮游动物的定量方法 [J]. 水库渔业, 1982(4): 52-59. Huang X F. Quantitative methods of freshwater zooplankton [J]. Reservoir Fisheries, 1982(4): 52-59.
[19] Medlin L, Elwood H J, Stickel S, et al. The characterization of enzymatically amplified eukaryotic 16S-like rRNA-coding regions [J]. Gene, 1988, 71(2): 491-499. doi: 10.1016/0378-1119(88)90066-2
[20] Mentasti M, Fry N K, Afshar B, et al. Application of Legionella pneumophila-specific quantitative real-time PCR combined with direct amplification and sequence-based typing in the diagnosis and epidemiological investigation of Legionnaire’ disease [J]. European Journal of Clinical Microbiology & Infectious Diseases, 2012, 31(8): 2017-2028.
[21] Smet W H D, Gibson J A E. Rhinoglena kutikovaen sp. (Rotifera: Monogononta: Epiphanidae) from the Bunger Hills, East Antarctica: a probable relict species that survived Quaternary glaciations on the continent [J]. Polar Biology, 2008, 31(5): 595-603. doi: 10.1007/s00300-007-0393-9
[22] Nielsen D L, Shiel R J, Smith F J. Ecology versus taxonomy: is there a middle ground [J]. Hydrobiologia, 1998, (388): 451-457.
[23] 关申民, 高邦权. COI序列: 影响动物分类学与生态学的DNA barcode [J]. 生态学杂志, 2008, 27(8): 1406-1412. Guan S M, Gao B Q. COI sequence, the DNA barcode affecting animal taxonomy and ecology [J]. Chinese Journal of Ecology, 2008, 27(8): 1406-1412.
[24] 程方平. 我国近海浮游动物物种信息平台的构建及初步应用 [D]. 中国科学院海洋研究所, 2013: 1-16 Cheng F P. Chinese offshore zooplankton species information platform and primary application [D]. Institute of Oceanology, Chinese Academy of Sciences, 2013: 1-16
[25] 沈韫芬、陈受忠. 武昌东湖浮游动物数量季节变动的初步观察 [J]. 水生生物学集刊, 1965, 5(2): 133-144. Shen Y F, Chen S Z. A preliminary observation on the seasonal variation of zooplanktons in Lake Donghu of Wuchang [J]. Acta Hydrobiologica Sinica, 1965, 5(2): 133-144.
[26] 黄祥飞, 胡春英, 伍悼田. 武汉东湖的轮虫 [J]. 水生生物学报, 1985, 9(2): 129-143. Huang X F, Hu C Y, Wu Z T. Rotifers in Lake Donghu, Wuhan [J]. Acta Hydrobiologica Sinica, 1985, 9(2): 129-143.
[27] 王家楫, 伍焯田, 戈敏生. 武昌东湖轮虫种类与数量季节变动的初步观察 [J]. 水生生物学集刊, 1965, 5(2): 183-201. Wang J J, Wu C T, Ge M S. A preliminary observation on the seasonal variation of rotifers in Lake Donghu of Wuchang [J]. Acta Hydrobiologica Sinica, 1965, 5(2): 183-201.
[28] 蒋燮治. 武昌东湖枝角类种类组成与数量变动的观察 [J]. 水生生物学集刊, 1965, 5(2): 220-239. Jiang X Z. Observation on species composition and quantity variation of cladocerata in Lake Donghu of Wuchang [J]. Acta Hydrobiologica Sinica, 1965, 5(2): 220-239.
[29] 杨宇峰, 陈雪梅. 武汉东湖桡足类的生态学演变 [J]. 水生生物学报, 1994, 18(4): 334-340. doi: 10.3321/j.issn:1000-3207.1994.04.002 Yang Y F, Chen X M. Ecological changes of copepods in Lake Donghu, Wuhan [J]. Acta Hydrobiologica Sinica, 1994, 18(4): 334-340. doi: 10.3321/j.issn:1000-3207.1994.04.002
[30] 刘建康, 黄祥飞. 东湖生态学研究概况 [J]. 环境科学, 1997(1): 51-53. Liu J K, Huang X F. Summary of studies on the ecology of Lake Donghu [J]. Environmental Science, 1997(1): 51-53.
[31] 林婉莲, 刘鑫洲. 武汉东湖优势浮游动物元素含量分析 [J]. 水生生物学报, 1985, 9(3): 258-263. Lin W L, Liu X Z. Elementary composition of some dominant zooplankters in Lake Donghu, Wuhan [J]. Acta Hydrobiologica Sinica, 1985, 9(3): 258-263.
[32] 诸葛燕, 黄祥飞. 武汉东湖轮虫种类组成及其分类讨论 [J]. 水生生物学报, 1993, 17(4): 347-356. Zhu G Y, Huang X F. Species composition of rotifer with reference to some taxonomic aspects in Lake Donghu, Wuhan [J]. Acta Hydrobiologica Sinica, 1993, 17(4): 347-356.
[33] 况琪军, 夏宜琤, 李植生, 等. 武汉东湖不同营养型子湖的水生生物与水域功能 [J]. 湖泊科学, 1997, 9(3): 249-254. doi: 10.18307/1997.0309 Kuang Q J, Xia J Z, Li Z S, et al. Comprehensive study on aquatic organisms and functions of water bodies of 4 lakes areas with different trophic states in Lake Donghu, Wuhan [J]. Journal of Lake Sciences, 1997, 9(3): 249-254. doi: 10.18307/1997.0309
[34] 刘盼盼, 王龙, 王培, 等. 沙颍河流域浮游动物群落结构空间变化特征与水质评价 [J]. 水生生物学报, 2018, 42(2): 373-381. doi: 10.7541/2018.048 Liu P P, Wang L, Wang P, et al. The characteristics of zooplankton community and water quality in the Shaying River basin [J]. Acta Hydrobiologica Sinica, 2018, 42(2): 373-381. doi: 10.7541/2018.048
[35] Xiao F S, Bi Y H, Li X H, et al. The impact of anthropogenic disturbance on bacterioplankton communities during the construction of Donghu tunnel (Wuhan, China) [J]. Microbial Ecology, 2018, 77(2): 277-287.
[36] Vladimír S. Rotifers as indicators of water quality [J]. Hydrobiologia, 1983, 100(1): 169-201. doi: 10.1007/BF00027429
[37] Segers H. Global diversity of rotifers (Rotifera) in freshwater [J]. Hydrobiologia, 2008, 595(1): 49-59. doi: 10.1007/s10750-007-9003-7
[38] 王玉玲, 张霁. 商丘市南湖浮游动物种类与分布研究 [J]. 商丘师范学院学报, 2018, 34(6): 40-44. Wang Y L, Zhang Q. Species and distribution of zooplankton in Nanhu Lake, Shangqiu city [J]. Journal of Shangqiu Normal University, 2018, 34(6): 40-44.
[39] 许晴, 张放, 许中旗, 等. Simpson指数和Shannon-Wiener指数若干特征的分析及“稀释效应” [J]. 草业科学, 2011, 28(4): 527-531. doi: 10.3969/j.issn.1001-0629.2011.04.001 Xu Q, Zhang F, Xu Z Q, et al. Some characteristics of Simpson index and the Shannon-Wiener index and their dilution effect [J]. Prataculatural Science, 2011, 28(4): 527-531. doi: 10.3969/j.issn.1001-0629.2011.04.001
[40] 王珊, 于明, 刘全儒, 等. 东江干流浮游植物的物种组成及多样性分析 [J]. 资源科学, 2013, 35(3): 473-480. Wang S, Yu M, Liu Q R, et al. Phytoplankton species composition and biodiversity in Dongjiang River [J]. Resources Science, 2013, 35(3): 473-480.
[41] 张世羊, 周巧红, 成水平, 等. 复合养殖系统中浮游动物种类丰度及其影响因素 [J]. 中国环境科学, 2009, 29(7): 745-750. doi: 10.3321/j.issn:1000-6923.2009.07.014 Zhang S Y, Zhou Q H, Cheng S P, et al. Zooplankton species richness and impact factors in a compound aquaculture system [J]. China Environmental Science, 2009, 29(7): 745-750. doi: 10.3321/j.issn:1000-6923.2009.07.014
[42] 冯世敏, 吴明姝, 熊莲, 等. 太平湖浮游动物动态演替与环境因子的相关性研究 [J]. 水生生物学报, 2017, 41(3): 700-711. doi: 10.7541/2017.88 Feng S M, Wu M S, Xiong L, et al. The research of dynamic succession of zooplankton and its correlation with environmental factors in Taiping Lake [J]. Acta Hydrobiologica Sinica, 2017, 41(3): 700-711. doi: 10.7541/2017.88
[43] 杨东贞, 徐祥德, 刘晓端, 等. 密云水库区域大气-土-水污染过程复合相关源 [J]. 中国科学: 地球科学, 2005, 35(A01): 195-205. Yang D Z, Xu X D, Liu X R, et al. The atmospheric-soil-water pollution process in miyun reservoir area is a compound correlation source [J]. Science in China, 2005, 35(A01): 195-205.
[44] Record N R, Pershing A J, Jossi J W. Biodiversity as a dynamic variable in the gulf of maine continuous plankton recorder transect [J]. Journal of Plankton Research, 2010, 32(12): 1675-1684. doi: 10.1093/plankt/fbq050
[45] Gillooly J F. Effect of body size and temperature on generation time in zooplankton [J]. Journal of Plankton Research, 2000, 22(2): 241-251. doi: 10.1093/plankt/22.2.241
[46] 崔福义, 林涛, 马放, 等. 水源中水蚤类浮游动物的孳生与生态控制研究 [J]. 哈尔滨工业大学学报, 2002, 34(3): 399-403. doi: 10.3321/j.issn:0367-6234.2002.03.030 Cui F Y, Lin T, Ma F, et al. Excess propagation and ecological control of water flea of zoopalnkton in raw water [J]. Journal of Harbin Institute of technology, 2002, 34(3): 399-403. doi: 10.3321/j.issn:0367-6234.2002.03.030
[47] Herzig A. The analysis of planktonic rotifer populations: A plea for long-term investigations [J]. Hydrobiologia, 1987, 147(1): 163-180. doi: 10.1007/BF00025739
[48] Elliott J I. Seasonal changes in the abundance and distribution of planktonic rotifers in Grasmere (English Lake District) [J]. Freshwater Biology, 1977, 7(2): 147-166. doi: 10.1111/j.1365-2427.1977.tb01665.x
[49] Bruno B, Pejler B. Rotifer occurrence in relation to pH [J]. Hydrobiologia, 1987, 147(1): 107-116. doi: 10.1007/BF00025733
[50] 温新利, 席贻龙, 张雷, 等. 芜湖市镜湖轮虫群落结构分析及水质的生态学评价 [J]. 水生生物学报, 2006, 30(2): 152-158. doi: 10.3321/j.issn:1000-3207.2006.02.005 Wen X L, Xi Y L, Zhang L, et al. Analysis of community structure of rotifera and ecological assessment of water quality in Lake Jinghu, Wuhu city [J]. Acta Hydrobiologica Sinica, 2006, 30(2): 152-158. doi: 10.3321/j.issn:1000-3207.2006.02.005
-
期刊类型引用(4)
1. 夏心怡,彭瑞冰,张聪颖,蒋霞敏. 光质对新月菱形藻生长、总脂含量和脂肪酸组成的影响. 广东海洋大学学报. 2023(05): 53-59 .  百度学术
百度学术
2. 杨宇航,边雪强,孙翠竹,姜晓华,单欣,李锋民. 光照强度对丝状藻去除再生水中氮磷的影响. 环境科学研究. 2022(05): 1211-1220 .  百度学术
百度学术
3. 汤坤贤,宋晖,姜德刚,孙元敏,蔡鹭春,陈珊,涂武林. 遮光处理对微藻繁殖及其水质指标的影响. 环境科技. 2022(03): 25-31 .  百度学术
百度学术
4. 刘权迪,宁延昶,温斌,张峰,吴香莹,左然涛. 饲料中脂肪水平对海湾扇贝性腺发育、脂肪酸组成和组织结构的影响. 上海海洋大学学报. 2021(06): 981-991 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载: