THE EFFECT OF SP600125 ON THE EXPRESSION OF SKELETAL GENES OF CRUCIAN CARP (CARASSIUS AURATUS VAR)
-
摘要: 前期研究表明ATP竞争性小分子抑制剂SP600125在体外可以高效诱导鱼类细胞多倍化。研究首次尝试用SP600125直接孵育鲫受精卵以获得多倍体鱼的可能性。结果显示SP600125处理受精卵虽然能够引起部分胚胎倍性发生改变, 但也显著影响胚胎发育并导致胚胎高死亡率, 同时伴随着畸形鱼苗的发生, 其中主要表现为脊椎弯曲和尾缺失等骨骼发育异常。SP600125处理导致骨骼畸形在SP600125孵育鲫鱼苗试验中也同样获得验证。荧光定量PCR检测结果表明, 在体(受精卵和鱼苗)或离体(培养的尾鳍细胞)状态下, SP600125孵育会引起smad6、stat1、 lef1、bmp2和twist1等骨骼发育相关基因mRNA水平显著上调。相关结果为进一步调整SP600125诱导的鱼类倍性操作策略和方法提供了重要理论参考。Abstract: It has been shown that the ATP competitive small molecule inhibitor SP600125 can efficiently induce fish cell polyploidization in vitro. In this study, we used SP600125 to directly incubate the fertilized eggs of crucian carp to obtain the possibility of polyploid fish, and found that SP600125 caused partial embryo ploidy, significantly affected the embryonic development and led to high mortality of embryos. SP600125 also induced a large number of malformed fry after treating fertilized eggs, mainly skeletal dysplasia such as spinal curvature and tail loss. The skeletal malformation caused by SP600125 was further validated. Real-time PCR indicated that SP600125 significantly induced mRNA levels of skeletal development-related genes, such as smad6, stat1, lef1, bmp2 and twist1 in vivo (fertilized eggs and fry) or in vitro (cultured caudal fin cells). These results clearly help to develop a potential mode of fish polyploidy induced by SP600125.
-
Keywords:
- SP600125 /
- Polyploidization /
- Skeletal development /
- Crucian carp
-
SP600125(C14H8N2O)是一种蒽吡唑化合物, 作为c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)的高选择性小分子抑制剂, 其作用机制是通过与ATP相互竞争进而与JNK结合抑制c-Jun的磷酸化, 从而有效地抑制JNK的活性, 对细胞的增殖、分化和凋亡产生显著影响[1]。本实验室以培养的二倍体红鲫(Carassius auratus, red var)尾鳍细胞为材料, SP600125孵育后四倍体细胞数量显著增加。在此基础上, 通过进一步优化SP600125处理方式和流式分选体系, 成功获得了基于SP600125诱导的同源四倍体鲫细胞系(SP4N-fin, 保藏编号为CGMCCNo.9155), 该技术获国家发明专利(专利号ZL 201410317420.2)。以SP4N-fin细胞为核供体, 二倍体鲫未受精卵为受体, 通过体细胞核移植技术(the Somatic Cell Nuclear Transfer Technique, SCNT), 获得了SCNT四倍体胚胎和1尾尾部畸形的幼鱼[2]。虽未得到成鱼, 但充分显示了SP600125诱导的四倍体鲫细胞具有良好的发育潜能, 为开辟鱼类多倍体育种新途径做出了有益的探索。
多倍体是含有3套或3套以上完整染色体组的生物体, 多倍化现象在自然界, 尤其是植物中广泛存在, 多倍化事件产生大量新的遗传材料, 增加了基因组复杂性, 推动了物种的形成和进化[3]。多倍体鱼类对改善品质、加快生长速度、延长寿命、提高产量、控制过度繁殖、保持物种多样性和培育新品种等方面都具有重要意义, 应用于水产养殖可以带来巨大的经济效益[4, 5]。基于SP600125在体外可以诱导鱼类细胞多倍化, 本文继续探究了用SP600125直接孵育受精卵以获得多倍体鱼的可能性。Valesio等[6]发现用JNK抑制剂SP600125处理发育中的斑马鱼(Danio rerio)会导致一系列剂量依赖性缺陷, 如心包水肿、颌骨畸形、脊椎弯曲和发育迟缓等。本文的相关研究显示, SP600125处理鲫受精卵会引起胚胎倍性发生改变, 但同时发现SP600125也显著影响胚胎发育并导致胚胎高死亡率, 孵化出膜的处理组鱼苗中出现大量脊椎弯曲和尾缺失等畸形个体。在此基础上, 进一步分析了SP600125孵育对鱼类骨骼发育相关基因表达的影响, 结果表明, 在离体和在体状态下, SP600125孵育会显著影响骨形态发生蛋白2(Bone morphogenetic proteins 2, bmp2)、淋巴细胞增强结合因子1(Lymphoid-enhancer-binding factor 1, lef1)、酪氨酸蛋白激酶7(Protein tyrosine kinase 7, ptk7)和骨保护素(Osteoprotegerin, opg)等一些与骨骼发育相关基因的表达。
1. 材料与方法
1.1 SP600125孵育鲫受精卵
SP600125(Merck-Millipore, 美国)溶解于10% 二甲基亚砜(Dimethyl sulfoxide, DMSO)配制成1 mmol/L原溶液, 然后用超纯水进一步稀释至理想浓度。采用SP600125直接孵育鲫受精卵(单细胞期)的预实验中, 我们观察到低浓度(<10 μmol/L)SP600125对鲫胚胎发育影响较弱, 而高浓度(>1 mmol/L)下则胚胎死亡。基于SP600125处理鲫受精卵时长和浓度的预实验结果, 本实验选用100 μmol/L SP600125对鲫受精卵浸泡处理20min, 而后吸去SP600125溶液, 胚胎置于曝气水中室内静水孵化。分别设置1% DMSO对照组和曝气水空白对照组。
1.2 SP600125孵育鲫鱼苗
在预实验中, 使用不同浓度SP600125(0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8和2.0 μmol/L)对孵化出膜的红鲫鱼苗进行了测试。发现浓度低于0.6 μmol/L SP600125对鱼苗的发育没有显著的影响, 而高浓度(>1.8 μmol/L)则会导致鱼苗在药物孵育后的第1天就大量死亡。基于预实验, 选取1.4 μmol/L SP600125溶液浸泡处理出膜第1天鲫鱼苗, 间隔6h换液一次, 第7天统计存活率和畸形率。分别设置0.014% DMSO对照组和曝气水空白对照组。
1.3 SP600125孵育鲫尾鳍细胞
二倍体鲫尾鳍细胞系(2N)以及利用SP600125诱导建立的同源四倍体鲫细胞系(SP4N)来源于本实验室。细胞体外培养体系和方法参见我们之前的报道[2]。以鲫尾鳍细胞系为材料, 待细胞生长密度达到80%—90% 融合度时将细胞的培养液更换为含100 μmol/L SP600125的培养液培养48h, 0.25%胰酶消化后离心收集细胞。
1.4 流式细胞仪倍性检测
取孵化出膜第1天的鱼苗, 用尖头镊子挑去卵黄囊(每5尾一组, 实验组共随机取样30组); 3月龄处理组鱼剪取尾鳍。将样品分别置于加入了预先配好的ACD抗凝剂(0.48 g柠檬酸+1.32 g柠檬酸钠+1.47 g葡萄糖+100 mLH2O)剪碎制备成细胞悬液, 经DAPI染液避光染色约10 min, 样品经过20 μL尼龙过滤器过滤, 得到的液体进行上机(流式细胞仪)检测。
1.5 荧光定量PCR检测
荧光定量PCR(Quantitative Real-time PCR, Q-PCR)引物(表 1)由擎科生物公司合成。将收集的鱼苗和细胞材料分别用酚氯仿法提取总RNA, Nano-drop2000测定总RNA样品的纯度和浓度。利用逆转录试剂盒(RevertAidTM First Strand cDNA Synthesis Kit, Fermentas公司), 将RNA逆转录为cDNA。Q-PCR按照SYBR Premix Ex Taq试剂盒(Fermentas公司)说明书进行操作。以β-actin内参, 采用2-∆∆Ct计算各基因的mRNA相对表达量。
表 1 PCR引物序列Table 1. Sequences of PCR primer基因Gene 上游引物Upstream primer (5′—3′) 下游引物Downstream primer (5′—3′) stat1 CTGCGCTCTGATGGTTCTG GTTGCTGTTGTTCTGCTCCG Smad6 TGACAGTGACAGAGCGGTT AGTTGTGGAGTCTCAAGGCG lef1 CAATGTGGTGGCTGAATG CTGGCCTGTACCTGAAGC bmp2 ATCACCCGCTCGTATTCGTC GCTACCATGCCTTTTACTGCC twist1 ACGCACAAAAGGAGCA TCCTCTTGCATCGGCTCT ptk7 CAGTACGATTCGCTCAGCCT CTTCCAGTGTGTAGCGTC opg TGAGCGTCACACATCCC GCACTGAAACACACA stat3 CTCGACCTTGTGGCATG CTGGATGAGCTGGTAGGA β-actin CATCTACGAGGGTTACGCCC AATTTCCCTCTCGGCTGTGG 2. 结果
2.1 SP600125孵育受精卵对鲫发育的影响
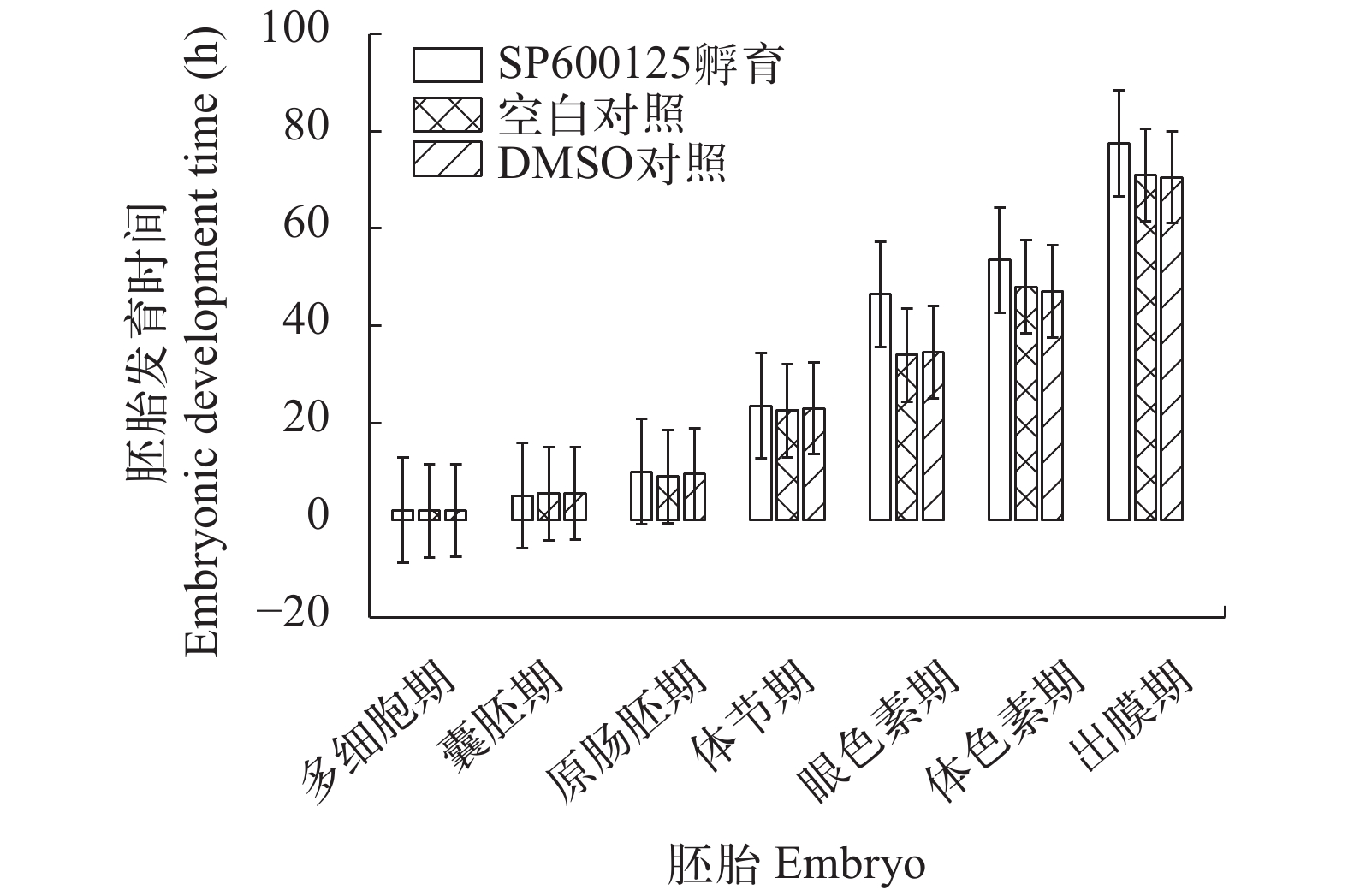
SP600125孵育受精卵20min后, 胚胎置于曝气水中常规培育。统计数据显示, SP600125处理导致胚胎发育滞后, 孵化时间较空白对照组推迟5—7h, 而DMSO对照组与空白对照组相比, 胚胎发育时间无明显差异(图 1)。观察显示, SP600125孵育受精卵不仅影响胚胎发育进程, 而且导致胚胎死亡, 处理组胚胎平均存活率仅3.4%, 死亡高峰出现在原肠胚期(76%)。DMSO对照组和空白对照组胚胎平均存活率分别为68.2%和90.2%。
SP600125孵育受精卵处理组孵化后的鱼苗出现大量的畸形个体, 与空白对照组相比(图2A), 主要表现为心包腔水肿、颌骨畸形、脊椎弯曲甚至于尾部缺失等(图 2B—2D)。流式细胞仪倍性分析发现, 与空白对照组相比较(图 2E), SP600125处理组检测到DNA含量的改变(图 2F、2G)。然而, 我们对SP600125孵育受精卵处理组存活的55尾3月龄红鲫的DNA含量进行了测定, 发现均为二倍体(图 2H)。
![]() 图 2 SP600125孵育对受精卵形态和倍性的影响A. SP60015处理组正常鱼苗; B—D. SP600125处理组畸形鱼苗; E. 空白对照组孵化出膜鱼苗DNA含量检测结果; F—G. SP600125处理组孵化出膜鱼苗DNA含量检测结果; H. SP600125处理组3月龄鱼DNA含量检测结果。a. 心包水肿; b. 脊椎弯曲; c. 尾巴弯曲; d. 尾缺失Figure 2. Effects of SP600125 on morphology and ploidy of fertilized eggA. Normal fry in SP600125-treated fertilized egg group; B—D. Deformed fry in SP600125-treated fertilized egg group; E. DNA content of fry in blank control group; F—G. DNA content of fry in SP600125-treated fertilized egg group; H. DNA content of 3-month fish in SP600125-treated fertilized egg group. a. shown pericardium edema; b. shown spinal curvature; c. shown bent tail vertebrae; d. shown tail loss
图 2 SP600125孵育对受精卵形态和倍性的影响A. SP60015处理组正常鱼苗; B—D. SP600125处理组畸形鱼苗; E. 空白对照组孵化出膜鱼苗DNA含量检测结果; F—G. SP600125处理组孵化出膜鱼苗DNA含量检测结果; H. SP600125处理组3月龄鱼DNA含量检测结果。a. 心包水肿; b. 脊椎弯曲; c. 尾巴弯曲; d. 尾缺失Figure 2. Effects of SP600125 on morphology and ploidy of fertilized eggA. Normal fry in SP600125-treated fertilized egg group; B—D. Deformed fry in SP600125-treated fertilized egg group; E. DNA content of fry in blank control group; F—G. DNA content of fry in SP600125-treated fertilized egg group; H. DNA content of 3-month fish in SP600125-treated fertilized egg group. a. shown pericardium edema; b. shown spinal curvature; c. shown bent tail vertebrae; d. shown tail loss2.2 SP600125浸泡鱼苗对鲫发育的影响
鲫鱼苗孵化出膜后即置于1.4 μmol/L SP600125溶液中持续浸泡处理7d, 统计显示处理组出现畸形鱼苗占比为11.7%, 而DMSO对照组和空白对照组鱼苗畸形率仅为3.0%和0.9%。观察显示, SP600125处理7d后的畸形红鲫主要表现为脊椎弯曲(图 3)。
2.3 SP600125孵育受精卵和鱼苗对鲫骨骼发育相关基因表达的影响
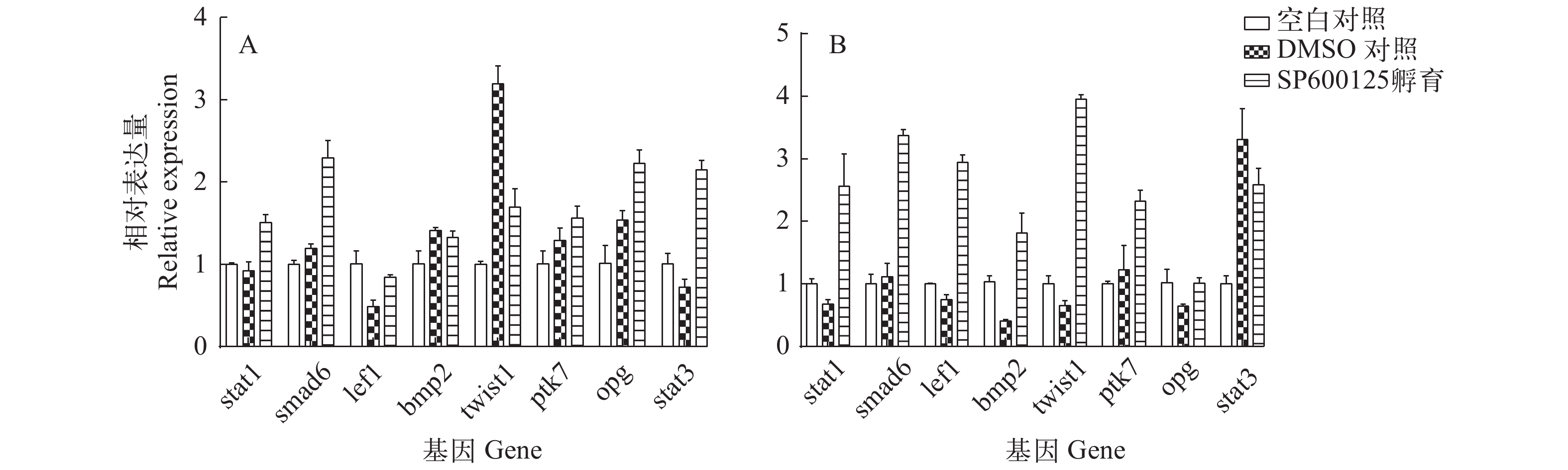
信号转导及转录激活因子1(Signal transducers and activators of transcription 1, stat1)、母抗Dpp小同源物6(Small mothers against decapentaplegic homolog 6, smad6)、碱性螺旋-环-螺旋转录因子(Basic helix-loop-helix transcription factor, twist1)、信号转导及转录激活因子3(Signal transducers and activators of transcription 3, stat3)、lef1、bmp2、ptk7和opg等是目前已报道的与脊椎动物骨骼发育密切关联的功能基因[7-13]。采用荧光定量PCR分别检测了上述8种基因在SP600125孵育受精卵后孵化的鱼苗以及SP600125直接处理鱼苗组的mRNA水平表达情况。如图 4A所示, 与DMSO对照组和空白对照组相比较, SP600125孵育受精卵组的鱼苗中stat1、smad6、ptk7、opg和stat3等5个基因mRNA表达量均有明显升高(P<0.05)。而在SP600125直接处理鱼苗组中, 除opg和stat3外, 其余6个基因(stat1、smad6、lef1、bmp2、twist1和ptk7)的mRNA表达量与对照组(DMSO组和空白组)相比均有显著差异(P<0.05, 图 4B)。
2.4 SP600125体外孵育鲫尾鳍细胞对骨骼发育基因表达的影响
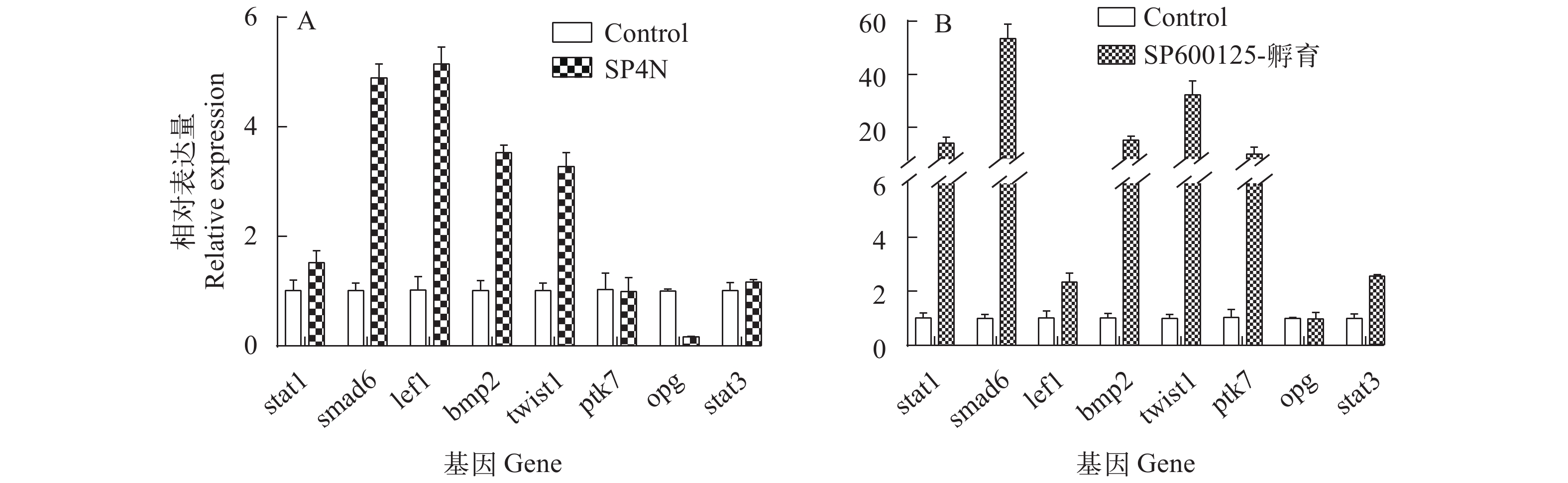
在此前的研究中, Zhou等[2]将SP600125体外诱导的同源四倍体鲫细胞核移植到鲫未受精卵中, 获得的SCNT幼鱼表现为尾部严重畸形。进一步利用荧光定量PCR技术, 分别检测了SP600125诱导的同源四倍体鲫细胞系(SP4N)和SP600125处理鲫尾鳍细胞中8种骨骼发育相关基因mRNA水平的表达情况。如图 5所示, stat1、smad6、lef1、bmp2和twist1基因在SP4N细胞中的mRNA表达量比鲫尾鳍细胞明显增高(P<0.05, 图 5A)。在SP600125孵育鲫尾鳍细胞组中, 除opg外, stat1、smad6、lef1、bmp2、twist1、ptk7和stat3等7个基因mRNA表达量与对照组细胞相比均显著上升(P<0.05), 特别是stat1、smad6、bmp2、twist1和ptk7等5个基因表达差异尤其显著(图 5B)
3. 讨论
SP600125被广泛应用于疾病发病机制研究[14, 15], 能促进癌细胞凋亡和抑制肿瘤的生长, 并在乳腺癌[16]、淋巴瘤[17]和结肠癌[18]等得到临床学应用。SP600125也用于治疗自身免疫性疾病和神经退行性疾病[19]。此外, 研究还发现, SP600125处理后能够阻滞G2/M期而影响小鼠胚胎干细胞的增殖[20], 并且对维持胚胎干细胞的干性、体外培养及胚胎干细胞的自我更新等方面都发挥显著作用[21], 在多能性干细胞诱导等方面也得到应用[22]。我们前期的研究表明, SP600125在体外具有诱导二倍体鲫细胞多倍化作用, 建立了SP600125体外高效诱导鱼类细胞四倍化体系, 并获得了稳定的四倍体鲫细胞系[2], 这为SP600125作为新型化学诱导剂来开展多倍体培育提供了可能性。在此基础上, 本研究首次尝试用SP600125直接孵育受精卵, 结果显示SP600125处理受精卵虽然能够引起红鲫倍性发生改变, 但也显著影响鲫胚胎发育并导致胚胎高死亡率, 同时伴随着大量畸形鱼苗的发生, 目前尚未在处理组成鱼中鉴定到多倍体。
SP600125孵育鲫受精卵处理组的胚胎及鱼苗中有大量的畸形个体发生, 其主要表现为脊椎弯曲和尾缺失等骨骼发育异常(图 2)。SP600125处理导致骨骼畸形在SP600125孵育鲫鱼苗试验中也得以进一步验证(图 3)。分子水平检测结果表明, SP600125孵育影响stat1、smad6、bmp2、lef1、twist1和ptk7等一些与骨骼发育相关基因的表达。骨形态发生蛋白(Bone morphogenetic proteins, BMPs)是从脊椎动物骨骼基质中分离到的一类蛋白质, 能诱导骨与软骨形成, 是促进骨形成和诱导成骨细胞分化最重要的细胞外信号分子之一[23]。蝾螈附肢再生研究中发现如果bmp2过量表达可以促进细胞凝聚和凋亡, 导致再生过程中趾部的缺失[24]。lef1是骨骼发育及骨稳态的重要调节因子[25], Tommy N等[26]发现lef1基因敲除雌性小鼠显示出成骨细胞活性降低, 导致骨量的减少, 而lef1过表达则会抑制晚期成骨细胞标志的表达和分化, 抑制成骨细胞的终末成骨[27]。twist1在脊椎动物不同发育时期的许多组织中都有表达并且参与调控细胞命运决定、分化和成形等过程[28], 研究发现twist1在成骨细胞分化及骨形成中起负性调节作用, 过表达twist1抑制成骨细胞的分化[29]。而ptk7则是典型Wnt/β-catenin和非典型Wnt/PCP信号活性的关键调控因子, 是脊椎动物胚胎模式形成和形态发生所必需的[30]。在斑马鱼研究中发现ptk7突变与脊柱侧凸发生相关, ptk7缺失会导致轴向形成缺陷, 包括躯干和尾巴内缺乏会聚性伸展[31]。opg基因参与调节破骨细胞的分化和活化, 维持骨形成与吸收的动态平衡[32], OPG/ RANKL是非常重要的骨代谢调控通路, 成骨细胞中OPG竞争性结合RANKL, 抑制破骨细胞分化和骨吸收, 在促进骨形成和维持骨量中起重要作用[33]。无论是在体(受精卵和鱼苗)还是在离体(培养的尾鳍细胞)状态下, SP600125孵育都会引起smad6和stat1基因mRNA水平显著上调(图 4和图 5)。smad6是SMADs中一种抑制性信号分子, smad6对BMPs信号传递起抑制作用, 从而负调控BMPs信号通路[34], 有研究发现, smad6信号干扰能促进bmp2诱导的骨向分化[35], 降低smad6的表达, 可以改善大鼠骨组织病变[36]。stat1不仅参与免疫调节, 还参与破骨细胞的形成和成骨细胞的分化, 研究表明stat1可以通过直接与成骨细胞分化必需的转录因子相互作用抑制骨形成, 是骨吸收和骨形成的关键负调控因子[37]。在小鼠骨骼间充质干细胞研究中发现过表达stat1显著抑制成骨分化[38], 而在成骨生成被抑制的小鼠中将stat1基因敲除中发现, 小鼠的骨量和成骨相关因子得到显著性恢复[37]。
综上所述, SP600125在体孵育鲫受精卵引发胚胎(或部分细胞)多倍化效应, 然而发生的骨骼发育相关基因表达改变也直接影响鲫胚胎及鱼苗正常生长与发育, 并导致高畸形率和高死亡率。进一步深入解析SP600125多倍化诱导分子调控机制, 结合对SP600125孵育受精卵的药物浓度和处理时长等参数的调整和优化, 在实现多倍化诱导的同时减少畸形胚胎发生。此外, 本研究探究的是用SP600125直接孵育受精卵(单细胞期)以获得多倍体鱼, 鉴于大多数鱼类前两次卵裂基本是同步的且形成合胞体, 也可以在减少嵌合体发生的前提下尝试低浓度SP600125孵育早期胚胎(二、四细胞期), 探索SP600125作为化学诱导剂开展鱼类倍性操作的策略和方法。
-
图 2 SP600125孵育对受精卵形态和倍性的影响
A. SP60015处理组正常鱼苗; B—D. SP600125处理组畸形鱼苗; E. 空白对照组孵化出膜鱼苗DNA含量检测结果; F—G. SP600125处理组孵化出膜鱼苗DNA含量检测结果; H. SP600125处理组3月龄鱼DNA含量检测结果。a. 心包水肿; b. 脊椎弯曲; c. 尾巴弯曲; d. 尾缺失
Figure 2. Effects of SP600125 on morphology and ploidy of fertilized egg
A. Normal fry in SP600125-treated fertilized egg group; B—D. Deformed fry in SP600125-treated fertilized egg group; E. DNA content of fry in blank control group; F—G. DNA content of fry in SP600125-treated fertilized egg group; H. DNA content of 3-month fish in SP600125-treated fertilized egg group. a. shown pericardium edema; b. shown spinal curvature; c. shown bent tail vertebrae; d. shown tail loss
表 1 PCR引物序列
Table 1 Sequences of PCR primer
基因Gene 上游引物Upstream primer (5′—3′) 下游引物Downstream primer (5′—3′) stat1 CTGCGCTCTGATGGTTCTG GTTGCTGTTGTTCTGCTCCG Smad6 TGACAGTGACAGAGCGGTT AGTTGTGGAGTCTCAAGGCG lef1 CAATGTGGTGGCTGAATG CTGGCCTGTACCTGAAGC bmp2 ATCACCCGCTCGTATTCGTC GCTACCATGCCTTTTACTGCC twist1 ACGCACAAAAGGAGCA TCCTCTTGCATCGGCTCT ptk7 CAGTACGATTCGCTCAGCCT CTTCCAGTGTGTAGCGTC opg TGAGCGTCACACATCCC GCACTGAAACACACA stat3 CTCGACCTTGTGGCATG CTGGATGAGCTGGTAGGA β-actin CATCTACGAGGGTTACGCCC AATTTCCCTCTCGGCTGTGG -
[1] Bennett B L, Sasaki D T, Murray B W, et al. SP600125, an anthrapyrazolone inhibitor of Jun N-terminal kinase [J]. Proceedings of the National Academy of Sciences of the United States of American, 2001, 98(24): 13681-13686. doi: 10.1073/pnas.251194298
[2] Zhou Y, Wang M, Jiang M, et al. Autotetraploid cell Line induced by SP600125 from crucian carp and its developmental potentiality [J]. Scientific Reports, 2016(6): 21814.
[3] Zhou L, Gui J F. Natural and artificial polyploids in aquaculture [J]. Aquaculture and Fisheries, 2017, 2(3): 103-111. doi: 10.1016/j.aaf.2017.04.003
[4] Xu K, Duan W, Xiao J, et al. Development and application of biological technologies in fish genetic breeding [J]. Science China-Life Sciences, 2015, 58(2): 187-201. doi: 10.1007/s11427-015-4798-3
[5] 王延晖. 鱼类人工多倍体育种及其在水产养殖中的应用 [J]. 河南水产, 2017(6): 3-5. Wang Y H. Artificial polyploidy breeding of fishes and its application in aquaculture [J]. Henan Fisheries, 2017(6): 3-5. [
[6] Valesio E, Zhang H H, Zhang C B. Exposure to the JNK inhibitor SP600125 (anthrapyrazolone) during early zebrafish development results in morphological defects [J]. Journal of Applied Toxicology, 2013, 33(1): 32-40. doi: 10.1002/jat.1708
[7] Tajima K, Takaishi H, Takito J, et al. Inhibition of STAT1 accelerates bone fracture healing [J]. Journal of Orthopaedic Research, 2010, 28(7): 937-941. doi: 10.1002/jor.21086
[8] 杨建, 佟广香, 郑先虎, 等. 肌间刺缺失对斑马鱼骨骼发育的影响 [J]. 水生生物学报, 2020, 44(3): 546-553. doi: 10.1074/jbc.M702100200x Yang J, Tong G X, Zheng X H, et al. Comparative analysis of skeletal development between wildtype zebrafish and intermuscular bone-deficient mutants [J]. Acta Hydrobiologica Sinica, 2020, 44(3): 546-553. [ doi: 10.1074/jbc.M702100200x
[9] Quarto N, Senarath-Yapa K, Renda A, et al. Twist1mm silencing enhances in vitro and in vivo osteogenic differentiation of human adipose-derived stem cells by triggering activation of BMP-ERK/FGF signaling and TAZ upregulation [J]. Stem Cells, 2015, 33(3): 833-847. doi: 10.1002/stem.1907
[10] Galindo M, Kahler R A, Teplyuk N M, et al. Cell cycle related modulations in Runx2 protein levels are independent of lymphocyte enhancer-binding factor 1 (Lef1) in proliferating osteoblasts [J]. Journal of Molecular Histology, 2007, 38(5): 501-506. doi: 10.1007/s10735-007-9143-0
[11] Reddi A H. BMPs: From bone morphogenetic proteins to body morphogenetic proteins [J]. Cytokine and Growth Factor Reviews, 2005, 16(3): 249-250.
[12] Hayes M, Naito M, Daulat A, et al. Ptk7 promotes non-canonical Wnt/PCP-mediated morphogenesis and inhibits Wnt/β-catenin-dependent cell fate decisions during vertebrate development [J]. Development, 2013, 140(8): 1807-1818. doi: 10.1242/dev.090183
[13] Qin S, Zhang Q, Zhang L. Effect of OPG gene mutation on protein expression and biological activity in osteoporosis [J]. Experimental and Therapeutic Medicine, 2017, 14(2): 1475-1480.
[14] Bubici C, Papa S. JNK signalling in cancer: in need of new, smarter therapeutic targets [J]. British Journal of Pharmacology, 2014, 171(1): 24-37. doi: 10.1111/bph.12432
[15] Chambers J W, Pachori A, Howard S, et al. Small molecule c-jun-N-terminal Kinase inhibitors protect dopaminergic neurons in a model of parkinson’s disease [J]. ACS Chemical Neuroscience, 2011, 2(4): 198-206. doi: 10.1021/cn100109k
[16] Mingo-Sion A M, Marietta P M, Koller E, et al. Inhibition of JNK reduces G2/M transit independent of p53, leading to endoreduplication, decreased proliferation, and apoptosis in breast cancer cells [J]. Oncogene, 2004, 23(2): 596-604. doi: 10.1038/sj.onc.1207147
[17] Jacobs-Helber S M, Sawyer S T. Jun N-terminal kinase promotes proliferation of immature erythroid cells and erythropoietin-dependent cell lines [J]. Blood, 2004, 104(3): 696-703. doi: 10.1182/blood-2003-05-1754
[18] 隋华, 周利红, 殷佩浩, 等. JNK信号通路介导MDR1/P-gp调控人结肠癌多药耐药 [J]. 世界华人消化杂志, 2011, 19(9): 892-898. Sui H, Zhou L H, Yin P H, et al. JNK signal transduction pathway regulates MDR1/P-glycoprotein-mediated multidrug resistance in colon carcinoma cells [J]. World Chinese Journal of Digestology, 2011, 19(9): 892-898. [
[19] 李佳殷, 林丽珠. JNK信号通路在恶性肿瘤中的研究进展 [J]. 实用中医内科杂志, 2012(18): 10-11. Li J Y, Lin L Z. Advances of JNK pathway in malignant tumors [J]. Journal of Practical Traditional Chinese Internal Medicine, 2012(18): 10-11. [
[20] Tiwari V K, Stadler M B, Wirbelauer C, et al. A chromatin-modifying function of JNK during stem cell differentiation [J]. Nature Genetics, 2012, 44(1): 94-100. doi: 10.1038/ng.1036
[21] Zhou Y, Jiang M, Wang M, et al. Effect of SP600125 on proliferation of embryonic stem cell [J]. American Journal of Molecular Biology, 2013, 3(2): 67-71. doi: 10.4236/ajmb.2013.32009
[22] Miyamoto-Yamasaki Y, Yamasaki M, Yamada K. Induction of endoreduplication by a JNK inhibitor SP600125 in human lung carcinom A 549 cells [J]. Cell Biology International, 2007, 31(12): 1501-1506. doi: 10.1016/j.cellbi.2007.07.002
[23] Vlacic-Zischke J, Hamlet S M, Friis T, et al. The influence of surface microroughness and hydrophilicity of titanium on the up-regulation of TGFβ/BMP signalling in osteoblasts [J]. Biomaterials, 2011, 32(3): 665-671. doi: 10.1016/j.biomaterials.2010.09.025
[24] Guimond J C, Mathieu Lévesque, Michaud P L, et al. BMP-2 functions independently of SHH signaling and triggers cell condensation and apoptosis in regenerating axolotl limbs [J]. BMC Developmental Biology, 2010, 10(1): 1-16. doi: 10.1186/1471-213X-10-1
[25] Paik S, Jung H S, Lee S, et al. Mir-449a regulates the chondrogenesis of human mesenchymal stem cells through direct targeting of lymphoid enhancer-binding factor-1 [J]. Stem Cells and Development, 2012, 21(18): 3298-3308. doi: 10.1089/scd.2011.0732
[26] Tommy N, Yankel G, Jon C, et al. Lef1 haploinsufficient mice display a low turnover and low bone mass phenotype in a gender- and age-specific manner [J]. PLoS One, 2009, 4(5): 5434-5438. doi: 10.1371/journal.pone.0005434
[27] Kahler R A, Galindo M, Lian J, et al. Lymphocyte enhancer-binding factor 1 (Lef1) inhibits terminal differentiation of osteoblasts [J]. Journal of Cellular Biochemistry, 2006, 97(5): 969-983. doi: 10.1002/jcb.20702
[28] Connerney J, Andreeva V, Leshem Y, et al. Twist1 homodimers enhance FGF responsiveness of the cranial sutures and promote suture closure [J]. Developmental Biology, 2008, 318(2): 323-334. doi: 10.1016/j.ydbio.2008.03.037
[29] Hayashi M, Nimura K, Kashiwagi K, et al. Comparative roles of Twist-1 and Id1 in transcriptional regulation by BMP signaling [J]. Journal of Cell Science, 2007, 120(8): 1350-1357. doi: 10.1242/jcs.000067
[30] Peradziryi H, Kaplan N A, Podleschny M, et al. Ptk7/Otk interacts with Wnts and inhibits canonical Wnt signalling [J]. Embo Journal, 2011, 30(18): 3729-3740. doi: 10.1038/emboj.2011.236
[31] Hayes M, Gao X, Yu L X, et al. Ptk7 mutant zebrafish models of congenital and idiopathic scoliosis implicate dysregulated Wnt signalling in disease [J]. Nature Communications, 2014, 5(6): 4777.
[32] 任洁, 卢建华. RANKL/RANK/OPG系统与绝经后骨质疏松模型的研究 [J]. 浙江中西医结合杂志, 2015, 25(9): 892-895. doi: 10.3969/j.issn.1005-4561.2015.09.035 Ren J, Lu J H. Study on RANKL / RANK / OPG System and postmenopausal osteoporosis model [J]. Zhejiang Journal of Integrated Traditional Chinese and Western Medicine, 2015, 25(9): 892-895. [ doi: 10.3969/j.issn.1005-4561.2015.09.035
[33] 吴佳莹, 李岳泽, 刘红, 等. “肾主骨”机理研究——左归丸对Hepcidin、Fpn1及OPG/RANKL mRNA表达的影响 [J]. 中国中医基础医学杂志, 2017, 23(11): 1548-1551. Wu J Y, Li Y Z, Liu H, et al. Study on the mechanism of “kidney governing bone”——The effect of Zuogui Wan on Hepcidin, Fpn1 and OPG/RANKL mRNA expression [J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2017, 23(11): 1548-1551. [
[34] Ishida W, Hamamoto T, Kusanagi K, et al. Smad6 is a Smad1/5-induced smad inhibitor-characterization of bone morphogenetic protein-responsive element in the mouse Smad6 promoter [J]. Journal of Biological Chemistry, 2000, 275(9): 6075-6079. doi: 10.1074/jbc.M702100200
[35] 刘猛, 董伟, 冯晓洁, 等. Smad6信号干扰对MSCs骨向分化中Smad5及Smurf1基因表达的影响 [J]. 河北医药, 2012, 34(10): 1445-1447. Liu M, Dong W, Feng X J, et al. The influence of Smad6 RNA interference on gene expression of Smad5 and Smurf1 during osteogenic differentiation of MSCs [J]. Hebei Medical Journal, 2012, 34(10): 1445-1447. [
[36] 邓洋洋, 郑洪新, 林庶茹, 等. 益肾填精中药对骨质疏松症模型大鼠的骨组织中Smad1/5的表达影响 [J]. 中国骨质疏松杂志, 2009, 15(8): 563-567. doi: 10.3969/j.issn.1006-7108.2009.08.003 Deng Y Y, Zheng H X, Lin S R, et al. Regulative effect of some Chinese herbal drugs on expression of signal transduction molecules Smad1/5 in the femur tissues of osteoporosis in rats after ovariectomy [J]. Chinese Journal of Osteoporosis, 2009, 15(8): 563-567. [ doi: 10.3969/j.issn.1006-7108.2009.08.003
[37] Fujie A, Funayama A, Miyauchi Y, et al. Bcl6 promotes osteoblastogenesis through Stat1 inhibition [J]. Biochemical and Biophysical Research Communications, 2015, 457(3): 451-456. doi: 10.1016/j.bbrc.2015.01.012
[38] Li J, He X, Wei W, et al. MicroRNA-194 promotes osteoblast differentiation via downregulating STAT1 [J]. Biochemical and Biophysical Research Communications, 2015, 460(2): 482-488. doi: 10.1016/j.bbrc.2015.03.059



 下载:
下载: