IDENTIFICATION OF A NEW CRUSTIN AND STUDY OF ITS ANTIBACTERIAL FUNCTION FROM PROCAMBARUS CLARKII
-
摘要: 抗菌肽是无脊椎动物非特异性免疫系统中重要的免疫因子,抗菌肽具有良好且广谱的抗菌活性,并且不易产生耐药性,有望替代传统抗生素药物发挥功能。甲壳素(Crustin)是目前甲壳类动物中研究比较广泛的一类抗菌肽家族。研究鉴定了来自克氏原螯虾( Procambarus clarkii )中的一种新型Crustin基因,命名为 Pc-CruL 。通过 Pc-CruL 抵抗病原性细菌的免疫防御反应的初步探究,发现 Pc-CruL 对克氏原螯虾的天然免疫系统至关重要,为深入研究克氏原螯虾奠定了一定的基础,在克氏原螯虾的人工养殖过程中的疾病的预防和治疗中具有一定的指导意义且提供了一定的理论基础。 Pc-CruL 包含330 bp,编码109个氨基酸,与已知的克氏原螯虾甲壳素同源性较低,为Ⅰ型甲壳素蛋白家族新成员。 Pc-CruL 在健康的克氏原螯虾的血淋巴、鳃、肠道、胃、心和肝胰腺中均存在,在血淋巴中的含量最高,而在肝胰腺中含量最低。同时进行了体外抑菌实验,结果表明Pc-CruL重组蛋白显著地抑制了几种常见的病原性细菌的生长,具有良好的广谱抑菌活性。体内实验表明,对健康的克氏原螯虾注射Pc-CruL重组蛋白可以保护克氏原螯虾,在副溶血弧菌感染后,提高存活率。 Pc-CruL 是克氏原螯虾中关键的免疫因子,在克氏原螯虾抵抗外界病原菌入侵和感染过程中起着重要的作用。Abstract: The crayfish (Procambarus clarkii) is one of the important economic shrimp species which is widely distributed in the southeastern and central regions of China. In recent years, with the continous rise of peoples’ demand and the continous development of aquaculture industry, various diseases in the aquaculture have frequently outbroken, including bacterial and viral diseases, causing huge economic losses to the crayfish culture industry. As an invertebrate Procambarus clarkii lacks an adaptive immune system, which mainly resists the invasion of pathogens through the innate immune system. Antimicrobial peptide (AMP), as an important effector in the invertebrate’s innate immune system, is one of the substitutes for traditional antibiotics due to its broad-spectrum antibacterial activity and resistance to drug resistance. Crustin is one of the most widely studied antibacterial peptide in Procambarus clarikii. This study amplified and identified a new type of Crustin from Procambarus clarikii, named Pc-CruL. In order to reveal the function of Pc-CruL in Procambarus clarikii, antibacterial activity was determined by means of recombinant expression in vitro. It was hoped to reveal its relationship with pathogens in the form of the prevention and control of the disease and the opening of medicines for Procambarus clarikii. Amplifying the Pc-CruL gene in Procambarus clarikii and ligating this gene to the PGEX-4T-1 vector to construct a prokaryotic expression plasmid. The recombinant plasmid was induced and purified in competent BL21 (DE3) for in vitro and in vivo antibacterial experiment. The CDS region of Pc-CruL contains 330 bp and encodes 109 amino acids. Pc-CruL is expressed in all tissues of normal Procambarus clarikii, with higher expression levels in hemocytes and relatively lower expression levels in hepatopancreas. The results of liquid antibacterial assay showed that Pc-CruL protein significantly restricted the growth of Vibrio parahaemolyticus, Staphylococcus aureus, Aeromonas hydrophila, and Aeromonas veronii, and had broad-spectrum antibacterial activity. The injection of exogenous recombinant Pc-CruL protein could improve the survival rate of infection with Vibrio parahaemolyticus. In general, Pc-CruL is an important immune molecule in Procambarus clarikii and plays a vital role in defending against bacterial infections.
-
Keywords:
- Procambarus clarkii /
- Antimicrobial peptides /
- Innate immunity /
- Crustin /
- Vibrio parahaemolyticus
-
与脊椎动物的机体免疫机制不同,无脊椎动物在进化过程中丧失了特异性免疫系统,取而代之的是它们拥有极为发达的非特异性免疫系统,以抵抗外界病原体的入侵和感染[1]。先天免疫系统主要有细胞免疫和体液免疫。细胞免疫包括血细胞对病原的吞噬,血细胞形成结节对病原体的固定及结节不断积累形成包囊[2-4]。体液免疫主要是抗菌肽、黑色素和其他免疫因子的合成、释放和发挥作用[5]。由于抗菌肽具有杀死或抑制微生物的能力, 因此它们在第一线发挥作用抵抗病原体的入侵[6]。
抗菌肽本质是一类具有生物活性的小分子多肽。目前在甲壳动物中发现的抗菌肽有抗脂多糖因子(ALFs)、甲壳素(Crustin)、溶菌酶(Lysozymes)和对虾素(Penaeidin)等[7-9]。最早从岸蟹(C. maenus)的血淋巴中分离得到,经研究鉴定为甲壳素家族成员[10], 随着不断的研究发现,更多的甲壳素成员在其他甲壳动物和昆虫中被鉴定出来[11]。
甲壳素(Crustin)富含半胱氨酸并带阳离子,一般包含N-端的信号肽、多域区(Multi-domain region)和C-端的WAP结构域[12]。多域区即富含多种不同氨基酸,包括半胱氨酸、脯氨酸或甘氨酸等。C-端的WAP结构域由约50个氨基酸构成,含有一个“4DSC”结构域,即由8个半胱氨酸残基两两之间通过二硫键联系形成的4对二硫键的结构[13]。据相关文献报道,具有“4DSC”结构域的分子一般都有抑菌活性或蛋白酶抑制剂活性[14]。在结构分类上,根据WAP结构域的数量和多域区结构的不同,将甲壳素分为5种亚型[11], 除了Ⅳ型有2个WAP结构域之外[16], 其他4种亚型的甲壳素成员均只具有1个WAP功能结构域,它们的区别在于多域区的不同:Ⅰ型甲壳素的多域区富含半胱氨酸,这一类甲壳素通常存在于龙虾和蟹类中[16, 18]; Ⅱ型甲壳素的多域区富含半胱氨酸和甘氨酸,Ⅲ型甲壳素的多域区富含脯氨酸-精氨酸[18], Ⅱ型和Ⅲ型甲壳素通常存在于对虾中[20, 20]; V型甲壳素的多域区富含半胱氨酸和芳香族氨基酸[11], 这一类甲壳素在蚁类中首次发现[22]。
在甲壳类动物中已经鉴定了许多Crustin成员,多数可抑制革兰氏阳性菌,小部分对革兰氏阴性菌也具有抑菌效果[22-24]。最新的研究结果表明,甲壳素还具有一定的抗病毒功能[26, 26]。此外,一些甲壳素分子具有蛋白酶抑制活性[28], 这些结果表明了甲壳素在甲壳类动物先天免疫系统中的重要作用。在本研究中, 课题组扩增鉴定了来自克氏原螯虾(Procambarus clarkii)中的一种新型Crustin基因, 命名为Pc-CruL。进行了氨基酸序列比对和系统进化分析; 同时检测其在健康克氏原螯虾中的组织分布情况及在不同细菌刺激下的表达变化, 并使用重组蛋白进行液体抑菌试验测试了其抗菌活性; 另外, 还测定了外源重组蛋白对克氏原螯虾感染副溶血弧菌的保护作用。结果表明, Pc-CruL是防御克氏原螯虾细菌感染的重要免疫分子。
1. 材料与方法
1.1 实验材料
实验动物 克氏原螯虾购自武汉市白沙洲水产批发市场, 重15—20 g。
质粒及菌株 质粒pGEX-4T-1、副溶血弧菌(Vibrio parahaemolyticus)、嗜水气单胞菌(Aeromonas hydrophila)、维氏气单胞菌(Aeromonas veronii)和金黄色葡萄球菌(Staphylococcus aureus)为笔者所在实验室所有;Trans5α感受态细胞、BL21(DE3)感受态细胞购于北京全式金;TRIzol、PCRmix、BamH Ⅰ和EcoR Ⅰ限制性内切酶购自TaKaRa公司; T4 DNA连接酶购自赛默飞世尔科技公司; DNA纯化回收试剂盒购自OMEGA公司。
引物序列 根据GenBank中Procambarus clarkii crustin 1基因序列(GQ301201.1), 设计扩增crustin 1基因CDS区全长的特异性引物, 上游加入酶切位点EcoR Ⅰ, 下游加入酶切位点BamH Ⅰ。引物序列见表 1。
表 1 引物序列Table 1. Primers sequences引物名称Primer 引物序列Primer sequence (5′—3′) Pc-CruL-F CGGGATCCATGGTGGTGATGGCGATT Pc-CruL-R GGGAATTCTCAGACCTCAGAGCTACGACAAATG qPCR-Pc-CruL-F ATATTCCTCGCTGCACAAAC qPCR-Pc-CruL-R TCACATAGCACCTCCCTCTC 18S-F AGTAGC CGCCCTGGTTGTAGAC 18S-R TTC TCCATGTCG TCCCAGT 注: “F”代表正向引物, “R”代表反向引物Note: “F” stands for forward primer and “R” stands for reverse primer 1.2 试验方法
总RNA提取 随机取5只健康的克氏原螯虾,分别提取不同组织器官的总RNA。使用预先装有0.5 mL抗凝剂的2 mL无菌注射器,从克氏原螯虾的腹部抽取血淋巴于无菌的1.5 mL EP管中,800×g 4℃离心5min,弃上清,加入1 mL TRIzol,吹打混匀,冰浴5min。取鳃、胃、肠、心脏和肝胰腺各0.1 g于无菌的1.5 mL EP管中,加入1 mL TRIzol,充分匀浆,将匀浆液收集于新的EP管中,冰浴5min。加入200 μL三氯甲烷,震荡混匀,冰浴5min,12000×g 4℃离心15min。离心后,各液相分层仅取上层水相至于无酶EP管中,加入等量异丙醇,混匀,冰浴10min,12000×g 4℃ 离心10min,弃上清,加入1 mL 75%乙醇,洗涤沉淀,12000×g 4℃离心5min,弃上清,重复洗涤1次。室温干燥3—5min 待液体部分全部蒸发,加入30 μL DEPC水溶解,即得RNA。
RNA反转录 使用TaKaRa反转录试剂盒将RNA反转录成cDNA。反转录条件如下:(1) gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL和RNA 1 μg,加H2O至10 μL,42℃条件下2min;(2) 5×Prime Spript Buffer 4 μL、Primerscript RT Engle Mix 1 μL和RT Primer Mix 1 μL,加RNase free H2O至10 μL,PCR仪中37℃反应15min,85℃反应5s,将cDNA于–20℃保存。
组织分布 随机取5只健康的克氏原螯虾,分别提取肝胰腺、心脏、胃、肠、鳃和血淋巴的总RNA,进行反转录合成cDNA。并以cDNA产物为模板,进行qRT-PCR反应探究Pc-CruL基因在健康克氏原螯虾的各个组织器官中的相对表达量。引物为qPCR-Pc-CruL-F/R(表 1), 内参为18S rRNA, 引物18S-F/R(表 1)。体系为:cDNA 2 μL,qPCR-Pc-CruL-F/R各0.8 μL, SYBR®Premix Ex Taq TM Ⅱ 10 μL。程序为:95℃ 1min;95℃ 15s;58℃ 20s;72℃ 20s,45个循环。qRT-PCR反应重复3次,数据采用2–∆∆Ct 法分析。
表达模式 将体重大小基本相同的健康克氏原螯虾随机分为5组,每组包含30只,并使用无菌的微量注射器,向克氏原螯虾体内注射不同的病原细菌。分别注射25 μL的浓度为1×107 CFU/mL的金黄色葡萄球菌、嗜水气单胞菌、维氏气单胞菌和副溶血弧菌,对照组克氏原螯虾注射25 μL 无菌的PBS。在注射后0h、3h、6h、12h及24h分别取鳃、血淋巴和胃并使用TRIzol法提取总RNA,将RNA反转录为cDNA。通过qRT-PCR反应探究 Pc-CruL 基因在克氏原螯虾感染病原细菌后,血淋巴、鳃和胃在感染后不同时间点的表达变化。qRT-PCR反应重复3次,结果数据用2–∆∆Ct 法分析。
重组质粒的构建 (1) PCR扩增目的基因。参考Pc-CruL基因CDS区序列设计扩增引物Pc-CruL-F/R(表 1)。使用反转录的血淋巴组织的cDNA作为模板进行PCR扩增,PCR产物经1.5%琼脂糖凝胶电泳检测并回收。(2) 将PCR回收产物和pGEX-4T-1质粒用限制性内切酶 EcoR Ⅰ和 BamH Ⅰ于37℃培养箱中酶切4h,连接并转化到感受态细胞Trans5α中。具体步骤为:冰上静置30min;42℃水浴锅中热激90s后迅速插入冰上再次静置2min;向感受态细胞加入500 μL的LB培养基,于37℃摇床培养45min;取200 μL菌液涂布到含氨苄抗生素的LB琼脂平板,置于37℃过夜培养。
重组质粒的提取及阳性克隆鉴定 挑选单克隆菌落,接种到4 mL含0.1%氨苄抗生素的LB液体培养基中,于37℃摇床培养8—12h,并提取重组质粒。以Pc-CruL-F和Pc-CruL-R为引物进行PCR,跑胶鉴定,将阳性质粒送往武汉擎科进行测序。测序结果与 Procambarus clarkii crustin 1 基因序列(GQ301201.1)进行比对。
重组蛋白原核表达 将质粒转化至感受态细胞BL21(DE3)之后接种至LB液体培养基,在1 mmol/L IPTG 16℃诱导12h后,离心,将菌液重悬进行高压破碎,离心收取上清与沉淀,制备蛋白样品,通过SDS-PAGE分析表达情况。
重组蛋白纯化 步骤如下:将5 mL pEGX-4T-1-Pc-CruL表达菌株转接到500 mL含0.1%氨苄抗生素的LB培养基中,37℃摇床培养4h左右,在1 mmol/L IPTG 16℃诱导12h后,4℃ 12000 r/min离心收集细菌,PBS重悬,高压破碎,4℃条件下12000 r/min离心30min,收取上清。采用GST-Sefinose柱子进行亲和柱纯化,加入100 mL的PBS充分洗涤柱子,将过滤后的上清液缓慢加到柱子中,使重组蛋白与GST填料充分结合;加50 mL的Binding/WashBuffer清洗柱子,除去杂蛋白,最后用20 mL的Elution Buffer进行洗脱并将洗脱液收集于1.5 mL的EP管中。
抑菌实验 使用几种常见的病原性细菌进行抑菌试验。步骤如下:将细菌在37℃摇床培养过夜,10000 r/min离心15min,用PBS洗3次,用PB培养基(Poor broth media:1%胰蛋白胨,0.5%氯化钠,pH 7.5)重悬,分别取20 μL浓度为2.5×109CFU/mL的副溶血弧菌、金黄色葡萄球菌、维氏气单胞菌和嗜水气单胞菌于新的1.5 mL EP管中,再向其中加入20 μL浓度为1 μg/μL的Gst-Pc-CruL重组蛋白,阴性对照组使用GST-Tag蛋白及Elution Buffer,最后再加入160 μL的PB培养基混匀,于37℃摇床孵育16h,使用血球计数板在显微镜下计数。实验重复3次。
克氏原螯虾存活率检测 将体重大小基本相同的健康克氏原螯虾随机分为4组,每组30只。首先向克氏原螯虾注射25 μL浓度为1 μg/μL的重组蛋白Gst-Pc-CruL和GST-Tag,1h后注射25 μL浓度为5×107 CFU/mL的副溶血弧菌,将仅注射PBS的克氏原螯虾作为阴性对照组,仅注射副溶血弧菌的克氏原螯虾作为阳性对照组。感染后每隔6h统计克氏原螯虾的死亡情况,计算存活率。实验在一个月内重复3次。
2. 结果
2.1 Pc-CruL序列比对分析
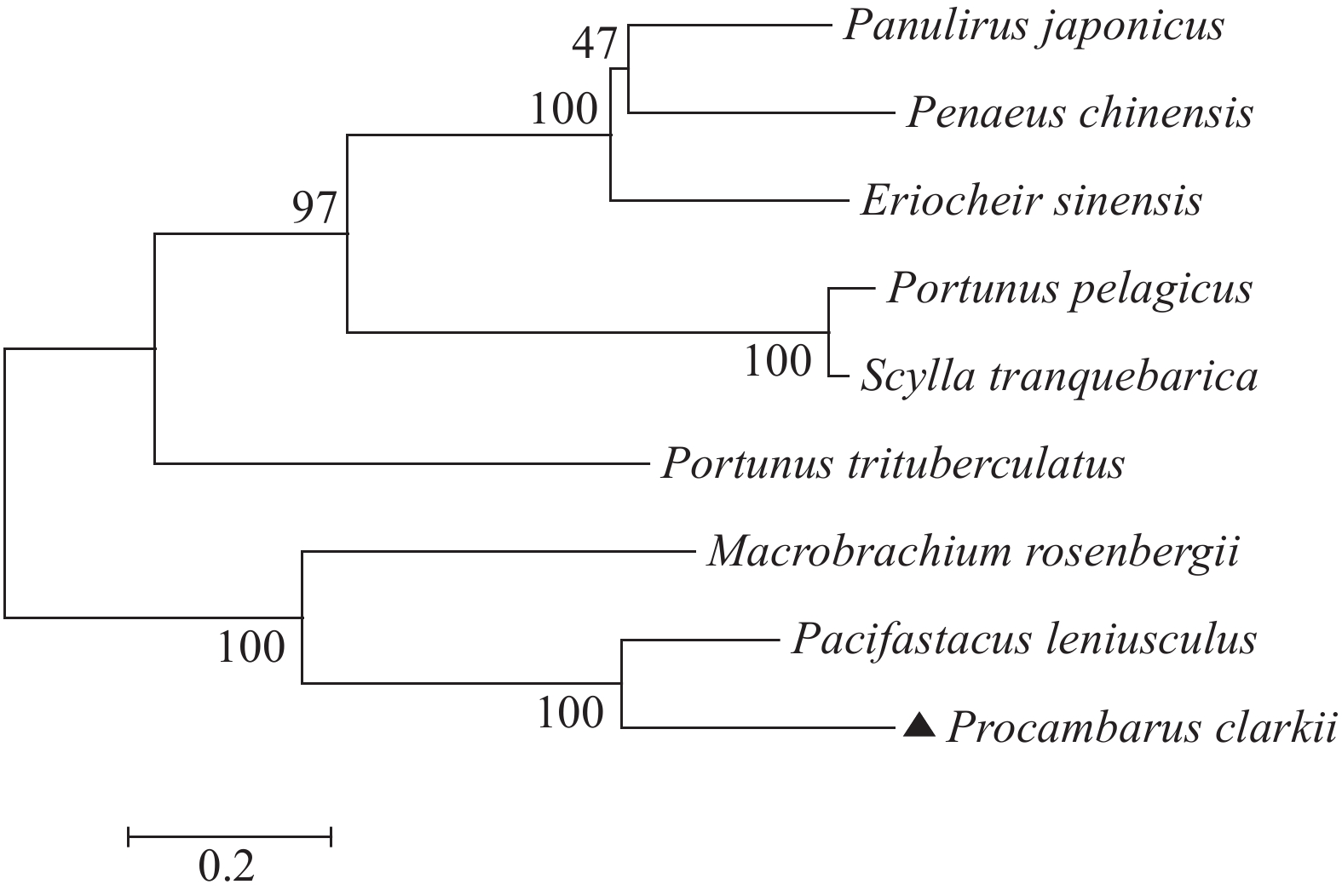
从健康克氏原螯虾的血淋巴组织中扩增出 Pc-CruL 编码区的全长序列,结果表明 Pc-CruL 的编码区全长330 bp,编码109个氨基酸,C-端含有一个wap结构域。将克氏原螯虾和其他的甲壳类动物的 crustin 序列blast分析,发现克氏原螯虾与淡水螯虾 crustin 的同源性高达64%,与青蟹 crustin 的同源性较低,仅有23%。生物信息学分析显示克氏原螯虾 Pc-CruL 主要与淡水螯虾和罗氏沼虾的 crustin 亲缘关系较近,与中国对虾 crustin 、 日本龙虾 crustin 及中华绒螯蟹 crustin 的序列同源性较低,进化上亲缘关系较远(图 1)。综上分析, Pc-CruL 在甲壳素家族的结构分类上属于Ⅰ型甲壳素分子。
2.2 Pc-CruL在克氏原螯虾中的组织分布
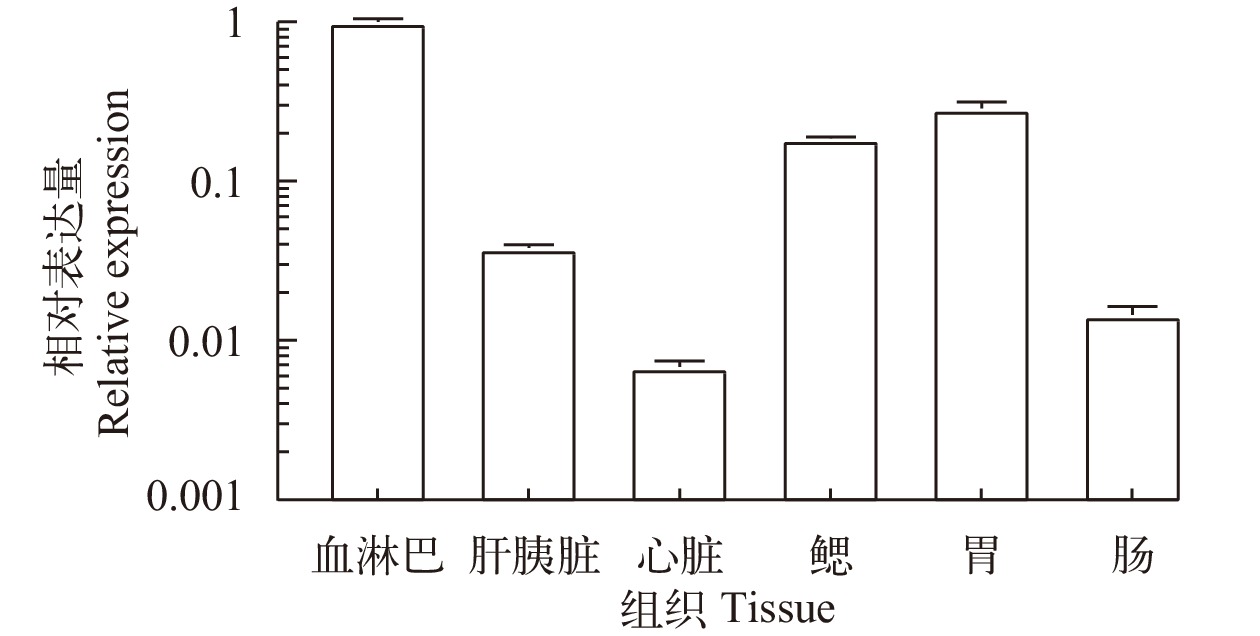
通过qRT-PCR检测 Pc-CruL 基因在健康克氏原螯虾的各个组织中的相对表达量情况,qRT-PCR结果表明 Pc-CruL 在健康克氏原螯虾的血淋巴、心、鳃、胃、肠道和肝胰腺中均有表达,其中 Pc-CruL 在血淋巴中的表达量最高,在肝胰腺中的表达量最低(图 2)。
2.3 Pc-CruL表达模式
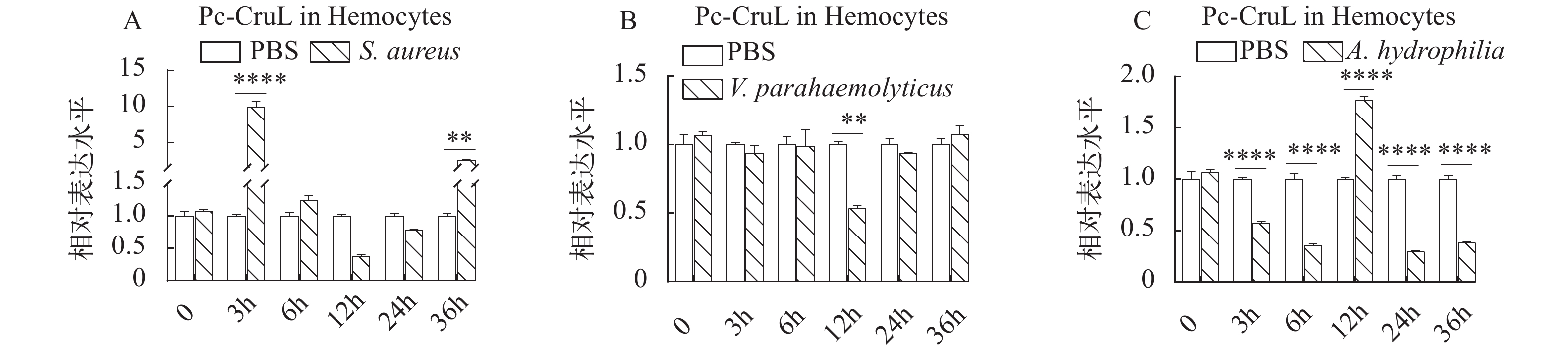
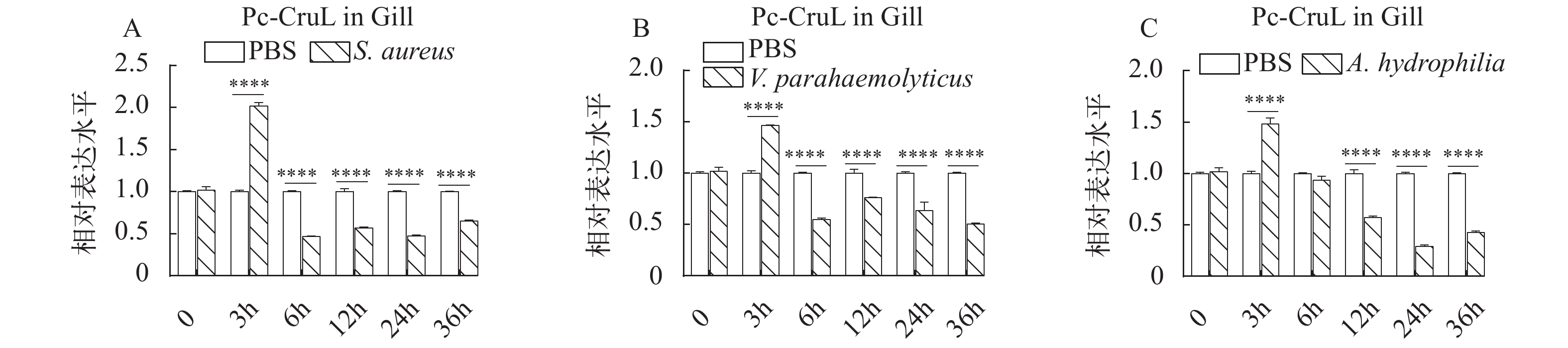
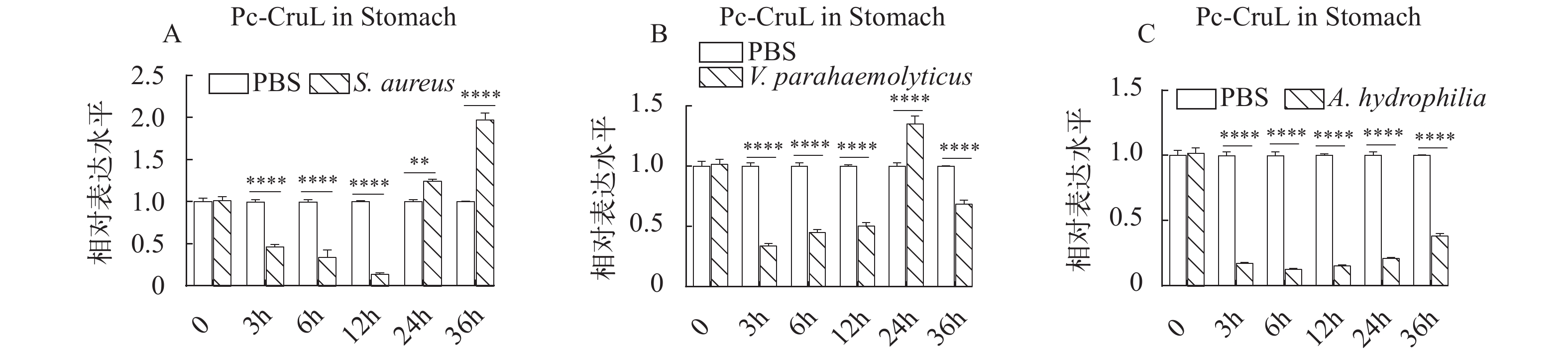
Pc-CruL 在健康克氏原螯虾的血淋巴、心、鳃、胃、肠道和肝胰腺中均有表达,为了进一步探究Pc-CruL 基因在克氏原螯虾抵抗外来病原菌入侵和感染的过程中是否发挥了作用,在鳃、胃和血淋巴中进一步检测,探究健康克氏原螯虾在受到病原细菌感染之后,Pc-CruL基因在鳃、胃和血淋巴的相对表达量的变化情况。克氏原螯虾在外源注射几种不同的病原细菌后,Pc-CruL基因在血淋巴中的表达模式并不相同。在注射金黄色葡萄球菌后,血淋巴组织中的Pc-CruL基因的mRNA水平在3h时便显著上调(图 3A), 嗜水气单胞菌刺激后, 下调表达, 直到12h后上调后又开始下调(图 3C), 然而 Pc-CruL 基因的表达水平并不依赖于副溶血弧菌刺激(图 3B)。与血淋巴不同,Pc-CruL基因在鳃中的表达模式相对一致,在金黄色葡萄球菌、嗜水气单胞菌和副溶血弧菌刺激后,Pc-CruL 基因在3h时表达量最好后下调并保持较低的水平(图 4)。胃组织中的Pc-CruL基因在金黄色葡萄球菌和副溶血弧菌刺激后,表达水平一直较低,直到24h后才有明显上调(图 5A和5B), 而在嗜水气单胞菌感染后一直处于较低的表达水平(图 5C)。总而言之,与注射了PBS的阴性对照组相比,当克氏原螯虾感染不同的病原菌时,Pc-CruL 基因的表达量在鳃、胃和血淋巴均有明显差异,表明了Pc-CruL 基因与克氏原螯虾抵抗外来病原菌入侵的免疫反应相关。 ![]() 图 3 血淋巴中Pc-CruL表达模式金黄色葡萄球菌(A)、副溶血弧菌(B)和嗜水气单胞菌(C)刺激后, 血淋巴中Pc-CruL表达模式。误差均用标准方差表示, *P<0.05; **P<0.01; ***P<0.001; ****P<0.0001; 下同Figure 3. The expression profiles of Pc-CruL in hemocytesThe expression profiles of Pc-CruL in hemocytes challenged by S. aureus (A), V. parahaemolyticus (B), A. hydrophila (C). Error bars are the SDs in triplicate. *P<0.05; **P<0.01; ***P<0.001; ****P<0.0001. The same applies below
图 3 血淋巴中Pc-CruL表达模式金黄色葡萄球菌(A)、副溶血弧菌(B)和嗜水气单胞菌(C)刺激后, 血淋巴中Pc-CruL表达模式。误差均用标准方差表示, *P<0.05; **P<0.01; ***P<0.001; ****P<0.0001; 下同Figure 3. The expression profiles of Pc-CruL in hemocytesThe expression profiles of Pc-CruL in hemocytes challenged by S. aureus (A), V. parahaemolyticus (B), A. hydrophila (C). Error bars are the SDs in triplicate. *P<0.05; **P<0.01; ***P<0.001; ****P<0.0001. The same applies below2.4 Pc-CruL的重组表达和蛋白纯化
Pc-CruL基因目的片段长度为330 bp,编码109个氨基酸,为了探究Pc-CruL蛋白在体内和体外的生物学功能,构建重组质粒PEGX-4T-1-Pc-CruL,重组Pc-CruL蛋白大小约为37 kD,其中包含了25 kD GST-Tag标签,使用GST-Tag亲和柱纯化并获重组取蛋白。 2.5 Pc-CruL体外抑菌试验
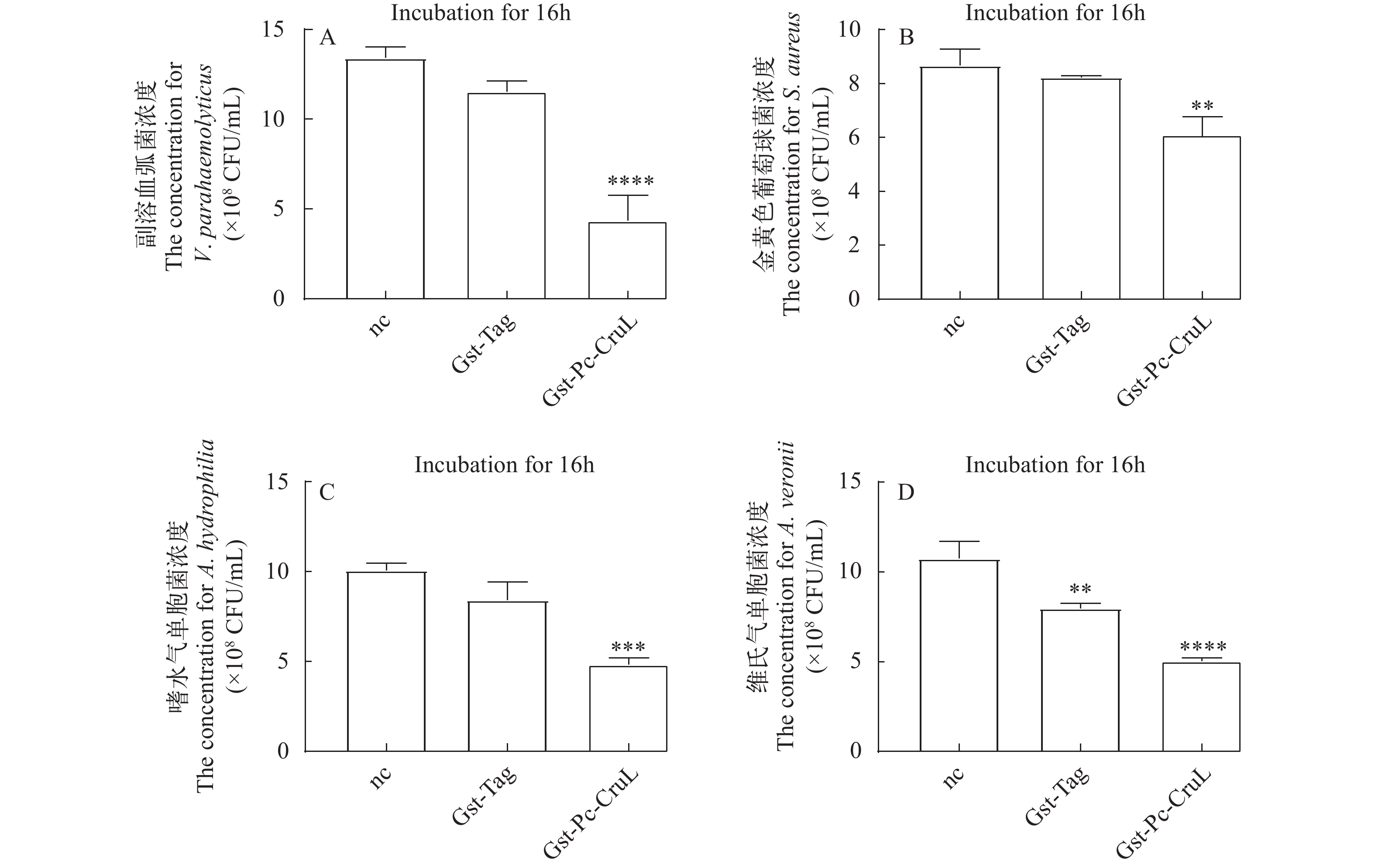
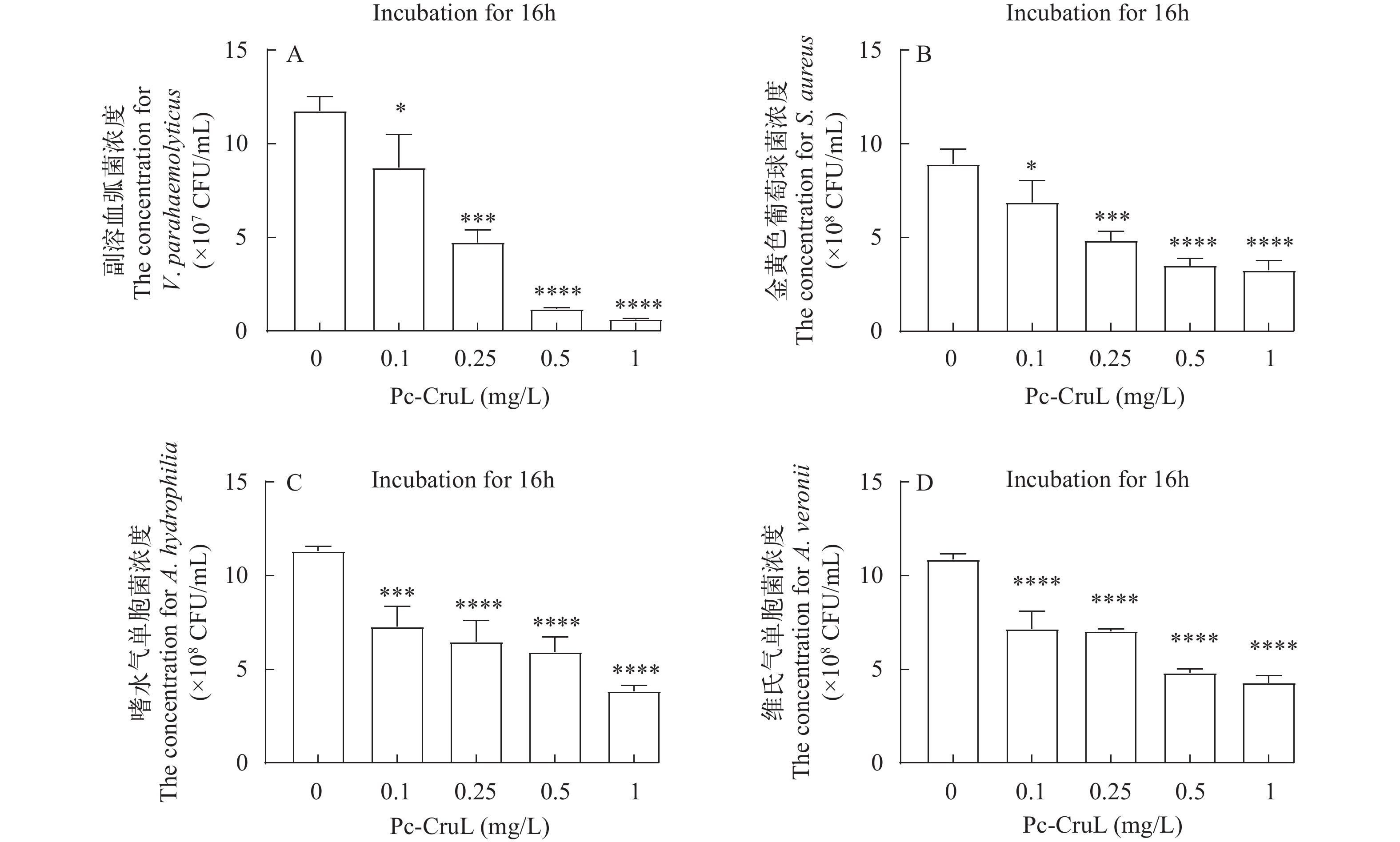
为了检测Pc-CruL是否影响病原细菌的生长,进行抑菌实验测定。将Pc-CruL重组蛋白与几种病原菌在37 ℃下孵育12h后,使用血球计数板在显微镜下进行计数。计数结果表明,与重组Pc-CruL蛋白共孵育的病原细菌数量相比于阴性对照组及GST-Tag组明显较低,重组Pc-CruL蛋白对几种病原菌均有一定的抑制作用(图 6), 且抑菌效果呈现浓度依赖型(图 7)。重组Pc-CruL蛋白对副溶血弧菌的 MIC50为1 μmol/L,对金黄色葡萄球菌的 MIC50为1.3 μmol/L,对嗜水气单胞菌的 MIC50为2.7 μmol/L,对维氏气单胞菌的 MIC50为2.5 μmol/L,重组Pc-CruL蛋白对副溶血弧菌的抑菌效果最明显。
2.6 Pc-CruL对克氏原螯虾感染副溶血弧菌后存活率的影响
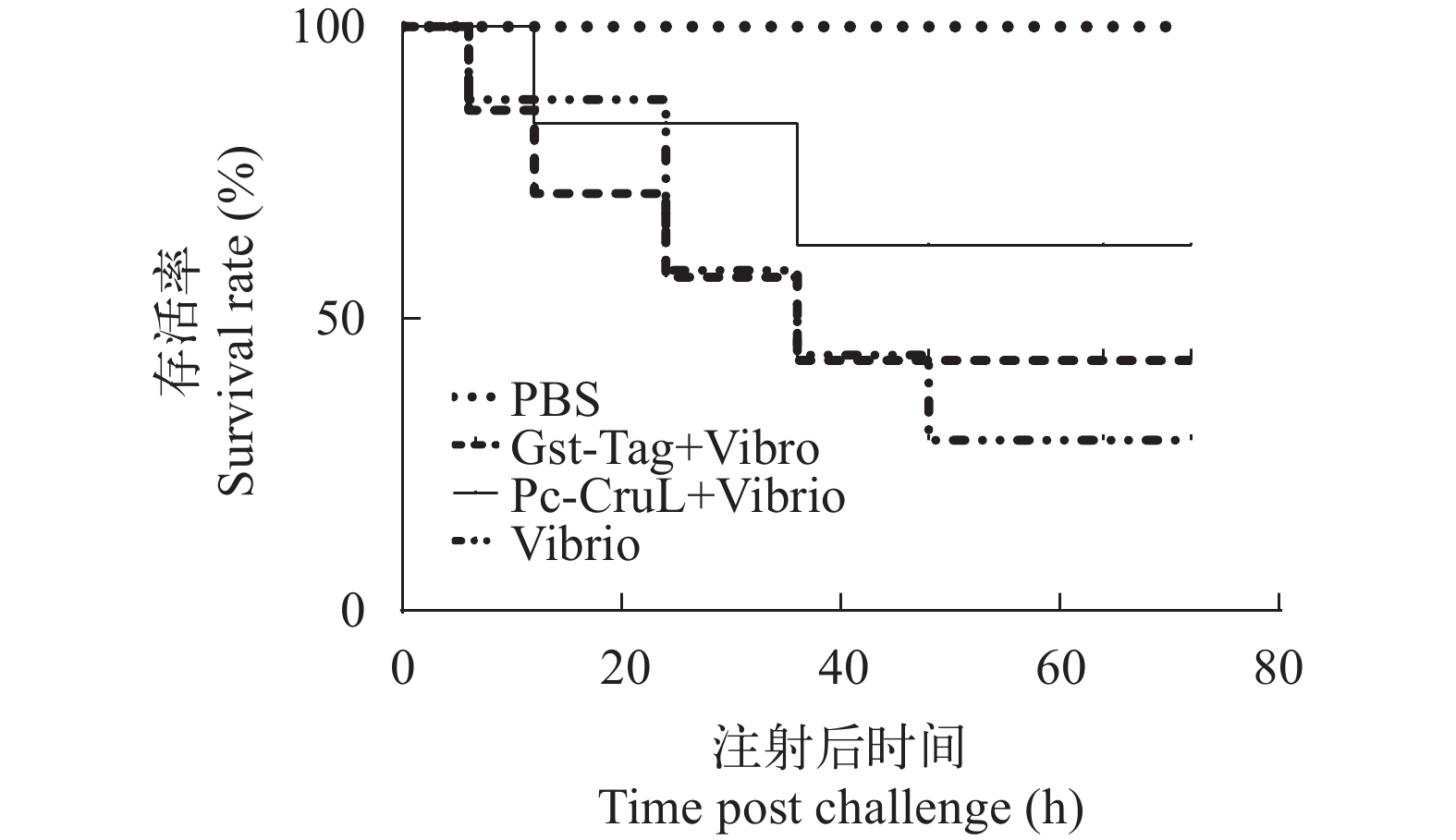
上述实验发现了Pc-CruL蛋白在体外对几种病原菌具有一定的抑菌效果,为了进一步明确Pc-CruL蛋白的功能,探究Pc-CruL蛋白在克氏原螯虾体内发挥的作用,向克氏原螯虾体内注射Pc-CruL蛋白后,体内注射副溶血弧菌,每隔6h统计死亡数量并计算存活率。注射副溶血弧菌(Vibrio)组,Gst-Tag+Vibrio组的克氏原螯虾在60h后,存活率仅为30%—40%,而注射了Pc-CruL+Vibrio的克氏原螯虾存活率大约为65%(图 8)。Pc-CruL重组蛋白能够在一定程度上保护副溶血弧菌对克氏原螯虾的感染,提高存活率,对克氏原螯虾具有一定的保护效果。
3. 讨论
1999年在岸蟹中发现了甲壳素家族中的首位成员,是一种可以抑制革兰氏阳性菌生长的抗菌肽[10]。甲壳素作为甲壳类动物体内重要的免疫因子,已经在不同种类的甲壳类动物中鉴定和报道[11]。本研究从健康克氏原螯虾的血淋巴中扩增和鉴定了一种新型Crustin基因,并将其命名为Pc-CruL。Pc-CruL的序列全长为933 bp,其中包含330 bp编码109个氨基酸的编码区,遗传进化生物信息学分析显示与先前研究鉴定的type-Ⅰcrustin序列同源性为36.87%[6], 与Pc-crustin4序列同源性为62.33%[28], 是一种新的甲壳素成员。从蛋白结构上分析,Pc-CruL的N-端具有一个低复杂性区域,C-端为WAP结构域。在低复杂性区域和WAP结构域之间存在1个精氨酸残基、5个脯氨酸残基和5个半胱氨酸残基。参考Pc-CruL的序列鉴定和分析,将Pc-CruL分类为Ⅰ型甲壳素分子[16]。
为了探究Pc-CruL在克氏原螯虾体内是否发挥功能,研究了Pc-CruL在健康克氏原螯虾中的各个组织器官的相对表达水平和克氏原螯虾在几种病原细菌刺激后的实时表达水平的变化情况。组织分布结果表明Pc-CruL在健康克氏原螯虾的血淋巴中的含量最高,在肝胰腺中的含量最低(图 2)。可能是因为机体产生抗菌肽和免疫因子一般发生在血淋巴细胞中,血淋巴细胞也在机体发生免疫反应时发挥了重要作用[29, 31], 而在其他器官中表达较低的原因可能是血淋巴细胞的浸润和黏附所致[6]。用几种不同的病原菌注射感染健康的克氏原螯虾后,Pc-CruL在鳃、血淋巴和胃中的表达水平和PBS对照组相比有不同程度的上调(图 3—5)。综上,Pc-CruL参与了健康克氏原螯虾感染病原细菌的免疫防御过程,Pc-CruL是克氏原螯虾体内重要的先天免疫防御因子。
甲壳素通常抑制革兰氏阳性菌,但一些也可以抑制革兰氏阴性菌[31, 32]。甲壳素带阳离子,其抑菌机制被认为是甲壳素与微生物的细胞膜发生静电作用后,甲壳素结合在细胞膜表面并行成跨膜通道,破坏膜的结构改变其通透性,导致菌体内容物外流,使细菌死亡[33]。有研究表明,从日本对虾和斑节对虾中分离鉴定到的甲壳素,其抑菌机制主要是通过破坏细菌的细胞壁[34, 35]; 而克氏原螯虾中已报道的甲壳素蛋白在抑菌方面的机制尚未报道[6, 28], 作为新的甲壳素蛋白,Pc-CruL的抑菌机制不清楚,是否通过裂解破坏细菌的细胞壁达到抑菌效果,值得后续的研究。本研究中,通过体外液体抑菌试验发现Pc-CruL对几种常见的病原菌具有较好的抑菌功能(图 5); 注射重组Pc-CruL蛋白,可以显著提高克氏原螯虾感染副溶血弧菌的存活率(图 6), 表明 Pc-CruL 在克氏原螯虾抵抗外界病原细菌入侵中发挥着关键的作用。总而言之, Pc-CruL 作为Ⅰ型甲壳素蛋白家族新成员,是克氏原螯虾的重要免疫防御分子,在抵抗病原入侵和感染中起着重要的作用。
-
图 3 血淋巴中Pc-CruL表达模式
金黄色葡萄球菌(A)、副溶血弧菌(B)和嗜水气单胞菌(C)刺激后, 血淋巴中Pc-CruL表达模式。误差均用标准方差表示, *P<0.05; **P<0.01; ***P<0.001; ****P<0.0001; 下同
Figure 3. The expression profiles of Pc-CruL in hemocytes
The expression profiles of Pc-CruL in hemocytes challenged by S. aureus (A), V. parahaemolyticus (B), A. hydrophila (C). Error bars are the SDs in triplicate. *P<0.05; **P<0.01; ***P<0.001; ****P<0.0001. The same applies below
表 1 引物序列
Table 1 Primers sequences
引物名称Primer 引物序列Primer sequence (5′—3′) Pc-CruL-F CGGGATCCATGGTGGTGATGGCGATT Pc-CruL-R GGGAATTCTCAGACCTCAGAGCTACGACAAATG qPCR-Pc-CruL-F ATATTCCTCGCTGCACAAAC qPCR-Pc-CruL-R TCACATAGCACCTCCCTCTC 18S-F AGTAGC CGCCCTGGTTGTAGAC 18S-R TTC TCCATGTCG TCCCAGT 注: “F”代表正向引物, “R”代表反向引物Note: “F” stands for forward primer and “R” stands for reverse primer -
[1] Marmaras V J, Lampropoulou M. Regulators and signalling in insect haemocyte immunity [J]. Cellular Signalling, 2009, 21(2): 186-195. doi: 10.1016/j.cellsig.2008.08.014
[2] Jiravanichpaisal P, Lee B L, Söderhäll K. Cell-mediated immunity in arthropods: Hematopoiesis, coagulation, melanization and opsonization [J]. Immunobiology, 2006, 21(4): 213-236.
[3] Vazquez L, Alpuche J, Maldonado G, et al. Review: Immunity mechanisms in crustaceans [J]. Innate Immunity, 2009, 15(3): 179-188. doi: 10.1177/1753425909102876
[4] Honti V, Csordás G, Kurucz É, et al. The cell-mediated immunity of Drosophila melanogaster: Hemocyte lineages, immune compartments, microanatomy and regulation [J]. Developmental & Comparative Immunology, 2014, 42(1): 47-56.
[5] Lemaitre B, Hoffmann J. The host defense of Drosophila melanogaster [J]. Annual Review of Immunology, 2007, 25(1): 697-743. doi: 10.1146/annurev.immunol.25.022106.141615
[6] Liu N, Zhang R R, Fan Z X, et al. Characterization of a type-I crustin with broad-spectrum antimicrobial activity from red swamp crayfish Procambarus clarkii [J]. Developmental & Comparative Immunology, 2016(61): 145-153.
[7] Zhu J J, Ye Z Z, Li C S, et al. Identification and molecular characterization of a novel anti-lipopolysaccharide factor (ALF) from red swamp crayfish, Procambarus clarkii [J]. International Journal of Biological Macromolecules, 2019(132): 43-50.
[8] Liao T J, Gao J, Wang J X, et al. Chicken-type lysozyme functions in the antibacterial immunity in red swamp crayfish, Procambarus clarkii [J]. Developmental & Comparative Immunology, 2018(85): 134-141.
[9] Destoumieux D, Bulet P, Loew D, et al. Penaeidins, a new family of antimicrobial peptides isolated from the Shrimp Penaeus vannamei (Decapoda) [J]. Journal of Biological Chemistry, 1997, 272(45): 28398-28406. doi: 10.1074/jbc.272.45.28398
[10] Relf J M, Chisholm J R S, Kemp G D, et al. Purification and characterization of a cysteine-rich 11.5-kDa antibacterial protein from the granular haemocytes of the shore crab, Carcinus maenas [J]. European Journal of Biochemistry, 1999, 264(2): 350. doi: 10.1046/j.1432-1327.1999.00607.x
[11] Tassanakajon A, Somboonwiwat K, Amparyup P. Sequence diversity and evolution of antimicrobial peptides in invertebrates [J]. Developmental & Comparative Immunology, 2015, 48(2): 324-341.
[12] Tandel G M, Kondo H, Hirono I. Gills specific type 2 crustin isoforms: Its molecular cloning and characterization from kuruma shrimp, Marsupenaeus japonicus [J]. Developmental & Comparative Immunology, 2018(85): 25-30.
[13] 杜志强. 先天免疫系统中抗菌肽的研究进展 [J]. 广东农业科学, 2012, 39(10): 231-233. doi: 10.3969/j.issn.1004-874X.2012.10.069 Du Z Q. Research progress in antimicrobial peptides of innate immune system [J]. Guangdong Agricultural Sciences, 2012, 39(10): 231-233. doi: 10.3969/j.issn.1004-874X.2012.10.069
[14] Smith V J, Chisholm J R S. Antimicrobial proteins in crustaceans [J]. Advances in Experimental Medicine & Biology, 2001(484): 95-112.
[15] Du Z Q, Ren Q, Zhao X F, et al. A double WAP domain (DWD)containing protein with proteinase inhibitory activity in Chinese white shrimp, Fenneropenaeus chinensis [J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2009, 154(2): 203-210.
[16] Jiravanichpaisal P, Lee S Y, Kim Y A, et al. Antibacterial peptides in hemocytes and hematopoietic tissue from freshwater crayfish Pacifastacus leniusculus: characterization and expression pattern [J]. Developmental & Comparative Immunology, 2007, 31(5): 0-455.
[17] Cui Z, Song C, Liu Y, et al. Crustins from eyestalk cDNA library of swimming crab Portunus trituberculatus: Molecular characterization, genomic organization and expression analysis [J]. Fish & Shellfish Immunology, 2012, 33(4): 937-945.
[18] Smith V J, Fernandes J M O, Kemp G D, et al. Crustins: Enigmatic WAP domaincontaining antibacterial proteins from crustaceans [J]. Developmental & Comparative Immunology, 2008, 32(7): 758-772.
[19] Christie A E, Rus S, Goiney C C, et al. Identification and characterization of a cDNA encoding a crustin-like, putative antibacterial protein from the American lobster Homarus americanus [J]. Molecular Immunology, 2007, 44(13): 3333-3337. doi: 10.1016/j.molimm.2007.02.028
[20] Jia Y P, Sun Y D, Wang Z H, et al. A single whey acidic protein domain (SWD) containing peptide from fleshy prawn with antimicrobial and proteinase inhibitory activities [J]. Aquaculture, 2008, 284(1-4): 246-259. doi: 10.1016/j.aquaculture.2008.07.046
[21] Zhang Z, Zhu S. Comparative genomics analysis of five families of antimicrobial peptide-like genes in seven ant species [J]. Developmental & Comparative Immunology, 2012, 38(2): 262-274.
[22] Pisuttharachai D, Fagutao F F, Yasuike M, et al. Characterization of crustin anti-microbial proteins from Japanese spiny lobster Panulirus japonicus [J]. Developmental & Comparative Immunology, 2009, 33(10): 1049-1054.
[23] Amparyup P, Kondo H, Hirono I, et al. Molecular cloning, genomic organization and recombinant expression of a crustin-like antimicrobial peptide from black tiger shrimp Penaeus monodon [J]. Molecular Immunology, 2008, 45(4): 1085-1093. doi: 10.1016/j.molimm.2007.07.031
[24] Donpudsa S, Visetnan S, Supungul P, et al. Type I and type II crustins from Penaeus monodon, genetic variation and antimicrobial activity of the most abundant crustinPm4 [J]. Developmental & Comparative Immunology, 2014, 47(1): 95-103.
[25] Du Z Q, Wang Y, Ma H Y, et al. A new crustin homologue (SpCrus6) involved in the antimicrobial and antiviral innate immunity in mud crab, Scylla paramamosain [J]. Fish & Shellfish Immunology, 2019(84): 733-743.
[26] Havanapan P O, Taengchaiyaphum S, Ketterman A J, et al. Yellow head virus infection in black tiger shrimp reveals specific interaction with granule-containing hemocytes and crustinPm1 as a responsive protein [J]. Developmental & Comparative Immunology, 2016, 54(1): 126-136.
[27] Du Z Q, Li X C, Wang Z H, et al. A single WAP domain (SWD)-containing protein with antipathogenic relevance in red swamp crayfish, Procambarus clarkii [J]. Fish & Shellfish Immunology, 2010, 28(1): 134-142.
[28] Du Z Q, Li B, Shen X L, et al. A new antimicrobial peptide isoform, Pc-crustin 4 involved in antibacterial innate immune response in fresh water crayfish, Procambarus clarkii [J]. Fish & Shellfish Immunology, 2019(94): 861-870.
[29] Amparyup P, Donpudsa S, Tassanakajon A. Shrimp single WAP domain (SWD)-containing protein exhibits proteinase inhibitory and antimicrobial activities [J]. Developmental & Comparative Immunology, 2008, 32(12): 1479-1509.
[30] Hipolito S G, Shitara A, Kondo H, et al. Role of Marsupenaeus japonicus crustin-like peptide against Vibrio penaeicida and white spot syndrome virus infection [J]. Developmental & Comparative Immunology, 2014, 46(2): 461-469.
[31] Mu C, Zheng P, Zhao J, et al. Molecular characterization and expression of a crustin-like gene from Chinese mitten crab, Eriocheir sinensis [J]. Developmental & Comparative Immunology, 2010, 34(7): 734-740.
[32] Supungul P, Tang S, Maneeruttanarungroj C, et al. Cloning, expression and antimicrobial activity of crustinPm1, a major isoform of crustin, from the black tiger shrimp Penaeus monodon [J]. Developmental & Comparative Immunology, 2008, 32(1): 61-70.
[33] Fjell C D, Hiss J A, Hancock R E W, et al. Designing antimicrobial peptides: form follows function [J]. Nature Reviews Drug Discovery, 2012, 11(1): 37-51. doi: 10.1038/nrd3591
[34] Liu N, Lan J F, Sun J J, et al. A novel crustin from Marsupenaeus japonicus promotes hemocyte phagocytosis [J]. Developmental & Comparative Immunology, 2015, 49(2): 313-322.
[35] Krusong K, Poolpipat P, Supungul P, et al. A comparative study of antimicrobial properties of crustinPm1 and crustinPm7 from the black tiger shrimp Penaeus monodon [J]. Developmental & Comparative Immunology, 2012, 36(1): 208-215.
-
期刊类型引用(3)
1. 沙文彬,刘闯,孙云飞,成永旭. 低温胁迫对克氏原螯虾抗氧化与非特异性免疫能力的影响. 上海海洋大学学报. 2025(01): 123-134 .  百度学术
百度学术
2. 雷雨洁,程菁菁,汤成,孟燕. 蝉蜕中甲壳素的提取工艺优化及其抗氧化活性和止血效果评价. 天然产物研究与开发. 2024(02): 268-278 .  百度学术
百度学术
3. 王思如,矣林圆,杨慧君,许乾,袁勇超. 大豆球蛋白对克氏原螯虾肠道菌群和抗菌相关基因的影响. 水生生物学报. 2024(08): 1300-1314 .  本站查看
本站查看
其他类型引用(3)



 下载:
下载: