TRANSCRIPTOME ANALYSIS OF TWO DIFFERENT MORPHOLOGICAL POPULATIONS OF SCYLLA PARAMAMOSAIN UNDER COLD STRESS
-
摘要: 为研究拟穴青蟹(Scylla paramamosain)不同形态群体对温度变化的适应差异, 以Sp1群体(腕节外缘中部都不具有发达的刺)和Sp2群体(至少一只螯足腕节外缘中部具有发达的刺)为研究对象, 选用低温胁迫组(8℃)和对照组(20℃)拟穴青蟹肝胰腺为实验材料, 进行转录组测序。结果显示, 测序共获得81853个Unigene, 平均长度为420 bp, N50为1460 bp, 其中22.33%为已知基因。差异表达基因筛选发现Sp1群体在低温胁迫下共有15773个Unigene显著差异表达, 其中15628个Unigene表达下调, 145个Unigene表达上调, 这些Unigene显著富集于细胞质基质等生物学过程和RNA结合、核糖体结构组分等分子功能, 并进一步富集在核糖体、剪接体和内质网蛋白质加工等信号通路。Sp2群体在低温胁迫下共有323个Unigene显著差异表达, 其中上调114个, 下调209个。这些Unigene显著富集于DNA整合等生物学过程和甾体羟化酶活性、碳酸氢盐跨膜转运体活性等分子功能, 并进一步富集在赖氨酸降解、甘氨酸、丝氨酸和苏氨酸的代谢、精氨酸和脯氨酸的代谢等代谢通路。以上结果表明, 水温从20℃骤降至8℃, Sp1群体大量基因表达下调, 生理活动大幅度降低, 这可能与寒冷的冬季青蟹停止摄食、穴居不动等行为相对应; 而Sp2群体仅调整了物质代谢, 表明Sp2群体可能对温度骤降的响应较为迟缓。利用RT-qPCR验证了转录组数据, 结果证明基于转录组分析比较两种形态群体拟穴青蟹对低温胁迫的响应是可行的, 研究结果将应用于拟穴青蟹耐寒优质品种的选育。Abstract: Scylla paramamosain is an economically important crab species mainly distribute in the southern reaches of the Yangtze River. Based on many years of breeding experience, it is speculated that different morphological populations of Scylla paramamosain have acquired different adaptations to temperature changes. In this study, Sp1 populations, with “one spine on the outer margin of the carpus of cheliped ” and Sp2 populations, with “two spines” were designated research objects, and 8℃ low temperature stress and 20℃ control groups were established. The hepatopancreas was used as a transcriptome source, and an Illumina Hiseq4000 platform was used for sequencing. A total of 81853 Unigenes were obtained by sequencing, with an average length of 420 bp, and an N50 of 1460 bp. Among these, 22.33% were known genes. Screening for differentially expressed genes identified 15773 Unigenes displaying significant differential expression in the Sp1 population under low temperature stress. Of these, 15628 Unigenes were down-regulated, and 145 Unigenes were up-regulated. Functional enrichment analysis revealed that the differentially expressed genes encode abundant cytosolic, RNA binding, and ribosome structural constituent proteins, and were further enriched in signal pathway components including ribosome, spliceosome, and protein processing components in the endoplasmic reticulum. 323 Unigenes were significantly differentially expressed in the Sp2 population under low temperature stress, of which, 209 Unigenes were down-regulated, and 114 Unigenes were up-regulated. Functional enrichment analysis revealed that the differentially expressed genes include abundant contributors to steroid hydroxylase activity, DNA integration, and bicarbonate transmembrane transporter activity, and were also enriched in signal pathways including lysine degradation, glycine, serine, and threonine metabolism, and arginine and proline metabolism. The above results indicated that as water temperature droped from 20℃ to 8℃, expression of a large number of genes was down-regulated in the Sp1 population, and physiological activities were drastically reduced. This may correspond to winter behaviors of Scylla paramamosain, including fasting and dwelling in burrows. By contrast, the Sp2 population mainly adjusted its material metabolism, indicating that the Sp2 population was relatively slow to respond to sudden temperature drops. Transcriptome data has been verified by RT-qPCR, supporting the feasibility of comparing responses of two morphological populations to low temperature stress based on transcriptome analysis. This study will inform selection of cold-tolerant and high-quality varieties for breeding of Scylla paramamosain.
-
Keywords:
- Cold challenge /
- Population /
- Transcriptome analysis /
- Scylla paramamosain
-
重金属污染是全球各种水环境面临的普遍问题, 往往受到人们的广泛关注。1980—2016年间, 我国开展了大量河湖水体重金属污染研究, 提示目前我国河湖水体重金属污染形势依然严峻[1]。重金属可通过饮用水途径直接进入人体, 进而对人体健康造成危害[2]。研究表明, 饮用水污染与许多疾病如癌症、神经系统疾病等的发病率之间存在一定的相关性[3]。对饮用水源地水体中重金属的人体健康风险进行评估已成为饮用水水质安全评价亟须解决的问题。
水体重金属污染不仅通过饮水等途径威胁人体健康, 还可直接对水生态系统健康造成危害。生态风险评价是用于评估一种或多种环境压力下可能形成或正在形成某种不利生态效应的可能性的评估方法, 可用来预测污染物对生态系统的有害影响[4]。物种敏感性分布(Species sensitivity distributions, SSD)最初是美国国家环境保护局(USEPA) 1978年提出的用于制定水质基准的方法[5], 是一种置信度较高的高级统计学外推方法, 在给出特定效应或结果的情况下可预测其发生的概率[6]。因具有简明、生态意义明确等优点, SSD法已被广泛应用于淡水、海水和土壤等环境的生态风险评价领域[7-9]。
南水北调中线工程是南水北调工程的重要组成部分, 是缓解我国华北地区水资源严重短缺、优化水资源配置的重大战略性工程, 对于促进该地区经济和社会的可持续发展具有重要战略意义[10, 11]。南水北调中线总干渠于2014年完工, 全长1277 km, 从汉江流域的丹江口水库引水, 输送至河南、河北、北京、天津等多个省、市, 是我国华北地区重要的饮用水水源[11]。南水北调中线总干渠采取开放或封闭的管道单向输水, 沿线分布着密集的交叉建筑物和控制建筑物, 其水质状况受周边复杂因素影响, 水污染防控面临严峻挑战[12, 13]。目前, 较少有人关注南水北调中线总干渠水中重金属的污染状况。Nong等[14, 15]于2015年—2018年对南水北调中线总干渠水中As、Hg、Cd、Cr、Se、Pb、Cu和Zn等重金属含量的时空变化情况进行了研究, 发现8种重金属的含量均未超出《地表水环境质量标准》(GB 3838—2002)I类水标准, 且As、Pb和Cd的含量分布表现出空间差异。此外, 作为我国华北地区的重要饮用水源, 目前关于南水北调中线总干渠水中重金属对当地居民的潜在健康风险尚未可知。南水北调中线总干渠作为人工修建的渠道工程, 其水生态系统本身比较脆弱, 总干渠水中重金属残留是否会对自身水生态系统造成潜在威胁亦不得而知。因此, 有必要全面了解南水北调中线总干渠水中重金属的污染状况, 评估其对人体的潜在健康风险及对水生生物的生态风险。
本研究于2018年5月—2020年6月对南水北调中线总干渠11个采样断面表层水中18种重金属含量进行了监测, 并利用USEPA水环境健康风险评价模型对重金属通过饮水途径对成人和儿童的潜在健康风险进行评估, 利用SSD法评估重金属对本土水生物种的生态风险水平, 以期为南水北调中线总干渠水中重金属的污染监测、生态风险评估及沿线居民的健康风险控制提供参考。
1. 材料与方法
1.1 样品采集及分析方法
在南水北调中线总干渠沿线选择陶岔渠首、程沟、沙河渡槽进口、鲁山坡落地槽、穿黄工程南、穿黄工程北、卫辉侯小屯西、漳河北、古运河暗渠、西黑山进口闸和惠南庄泵站等地设置11个采样点(图 1)。采样时间为2018年5月、2019年2月、2019年5月, 2019年8月、2019年12月和2020年6月, 共采样6次。每个采样点用棕色采样瓶采集2.5 L水样, 运回实验室后进行前处理及上机分析。
![]() 图 1 南水北调中线总干渠采样点位置分布图1. 陶岔渠首; 2. 程沟; 3. 沙河渡槽进口; 4. 鲁山坡落地槽; 5. 穿黄工程南; 6. 穿黄工程北; 7. 卫辉侯小屯西; 8. 漳河北; 9. 古运河暗渠; 10. 西黑山进口闸; 11. 惠南庄泵站Figure 1. Location of the sampling sites in the Main Canal of Middle Route of the South-to-North Water Diversion Project1. Taochaqushou; 2. Chenggou; 3. Shaheducaojinkou; 4. Lushanpodicao; 5. Chuanhuanggongchengnan; 6. Chuanhuanggongchengbei; 7. Weihuihouxiaotunxi; 8. Zhanghebei; 9. Guyunheanqu; 10. Xiheishanjinkouzha; 11. Huinanzhuangbengzhan
图 1 南水北调中线总干渠采样点位置分布图1. 陶岔渠首; 2. 程沟; 3. 沙河渡槽进口; 4. 鲁山坡落地槽; 5. 穿黄工程南; 6. 穿黄工程北; 7. 卫辉侯小屯西; 8. 漳河北; 9. 古运河暗渠; 10. 西黑山进口闸; 11. 惠南庄泵站Figure 1. Location of the sampling sites in the Main Canal of Middle Route of the South-to-North Water Diversion Project1. Taochaqushou; 2. Chenggou; 3. Shaheducaojinkou; 4. Lushanpodicao; 5. Chuanhuanggongchengnan; 6. Chuanhuanggongchengbei; 7. Weihuihouxiaotunxi; 8. Zhanghebei; 9. Guyunheanqu; 10. Xiheishanjinkouzha; 11. Huinanzhuangbengzhan水样用0.45 μm Whatman滤膜过滤, 并加入2 mL硝酸(1﹕1)酸化至pH<2, 用于稳定金属元素。样品前处理和分析方法参考我们之前建立的方法[16]。采用电感耦合等离子体质谱仪(ICP-MS, NexION300X, PerkinElmer, MA)测定采集水样中Ti、Cr、Mn、Fe、Co、Ni、Cu、Zn、As、Se、Sr、Cd、Ba、Pb、V、Bi 、U和Rb等18种重金属的浓度, 并以115In和103Rh为双内标校正系统。为保证实验结果的准确性, 实验过程采取全程序空白、平行样和加标回收对分析过程进行质量控制。各种重金属的加标回收率(96.4%—103%)和检出限详见表 1。以上实验所用硝酸和盐酸均为优级纯, 超纯水电阻率≥18.0 MΩ·cm。目标重金属元素标样购自国家有色金属及电子材料分析测试中心。
表 1 本研究中18种重金属元素的检出限及加标回收率Table 1. Limits of detection and recovery rates of 18 heavy metals in the present study重金属
Heavy metal检出限
Limit of detection (ng/L)加标回收率
Recovery rate (%)Ti 1.4 98.1±2.9 Cr 60 96.4±3.7 Mn 4.6 102±2.5 Fe 5460 104±3.2 Co 1.3 100±3.1 Ni 60 99.0±2.7 Cu 3.8 103±3.5 Zn 50 102±2.6 As 10 100±2.8 Se 100 100±3.2 Sr 3.7 89.9±3.9 Cd 2.6 98.1±5.8 Ba 7.4 100±1.2 Pb 7.5 101±3.3 V 6.1 94.2±4.0 Bi 11 97.2±4.2 U 2.5 99.5±3.7 Rb 12 98.2±2.9 1.2 健康风险评价方法
地表水中重金属可通过饮水途径、呼吸途径和接触途径对当地人群造成健康风险, 但呼吸途径与接触途径和饮水途径健康风险往往存在2—3个数量级的差距, 可忽略不计[17]。因此, 本研究只评价南水北调中线总干渠水中重金属通过饮水途径对当地人群造成的健康风险。根据世界卫生组织(WHO)和国际癌症研究机构(IARC)所检测的化学物质致癌性可靠度全面分析项目, 不同类型水体中金属元素潜在的健康风险可分为化学致癌和非化学致癌两类。本研究根据USEPA推荐的水体有害物质健康风险评价模型, 对南水北调中线总干渠水中致癌重金属元素(Cr、Cd和As)和非致癌重金属元素(Cu、Pb、Zn、Ni和Mn)通过饮用水途径对成人和儿童造成的健康风险进行评价, 具体评价模型[18]:
$ {R^c} = \sum\limits_{i = 1}^k {\mathop R\nolimits_i^c } = \sum\limits_{i = 1}^k {\frac{{1 - {{\exp }^{( - {D_i}{Q_i})}}}}{Y}} $


(1) $ {R^n} = \sum\limits_{i = 1}^m {R_i^n} = \sum\limits_{i = 1}^m {\frac{{{D_i} \times {{10}^{ - 6}}}}{{Y \times Rf{D_i}}}} \quad\;\;\;$


(2) $ {D_i} = \frac{{IR \times {C_i}}}{{BW}} \qquad\qquad\qquad\qquad\;\;\;$


(3) This page contains the following errors:
error on line 1 at column 1: Start tag expected, '<' not foundBelow is a rendering of the page up to the first error.
表 2 重金属毒理学特性参数(饮水途径)Table 2. Toxicological parameters of heavy metals (drinking water route)化学
致癌物
Chemical
carcinogen致癌强度系数
Carcinogenic potency
factor [Qi; mg/(kg·d)]非化学
致癌物
Non carcinogenic
chemical参考剂量
Reference
dose [RfDi;
mg/(kg·d)]Cr 41.0 Cu 5.0×10–3 Cd 6.1 Pb 1.4×10–3 As 15.0 Zn 3.0×10–1 Ni 2.0×10–2 Mn 4.6×10–2 假设各重金属有毒物质对人体健康水平的危害程度呈累积相加效应, 则南水北调中线总干渠水中重金属健康总风险可表示为:
$ R = {R^c} + {R^n} $


(4) 1.3 水生生态风险评价方法
SSD的基本假设是某生物对某种化学物质的敏感性可用毒性数据代表, 该(组)生物对该化学物质的敏感性(LC50或EC50等毒理数据)可被一个带有参数的累计概率分布来描述。可用的生态毒理学数据可视为生态系统敏感性分布的一个样本, 用于估算该分布的参数[5, 8]。以不同生物毒性数据的对数浓度值(µg/L)为横坐标, 以累计概率为纵坐标作图, 并选用一个分布进行参数拟合即可得到SSD曲线。其中累积概率是将各物种的毒性数据按由小到大的顺序依次排列, 最小值序号为1, 最大值序号为N, 那么序号为R的毒性数据的累积概率(P)的计算公式: P=R/(N+1)[25]。SSD的应用包括正、反向两种, 正向用法从污染物环境浓度出发, 通过SSD曲线得到可能受影响的物种比例(Potentially affected fraction, PAF), 用以表征生态系统或不同类群生物的生态风险; 反向用法用来确定可以保护生态系统中大部分物种(95%的物种)的污染物浓度, 用HC5 (Hazardous concentrations for 5% of species, 对5%的研究物种产生危害的污染物浓度)表示[7]。
本研究利用USEPA ECTOX数据库中8种常见重金属元素(As、Cd、Cr、Cu、Ni、Pb、Zn和Se)对本土淡水生物的急性毒理数据, 构建重金属对淡水生物的SSD曲线。本文选取未分组的(即全部物种) 的急性毒性(LC50或EC50)数据进行拟合[26]。对于同一个物种拥有多个毒理数据的情况, 采用浓度的几何均值作为该物种的数据点[27]。基于SSD曲线, 计算8种重金属对本土淡水生物的HC5值及重金属实测浓度(平均值)对淡水生物的PAF值, 进而评估南水北调中线总干渠水中8种常见重金属的急性生态风险。
1.4 数据分析处理
本文研究利用SPSS22和EXCEL2017对数据进行处理和描述性统计。采样点分布图用ArcGis绘制, 重金属浓度时空分布图用Graphpad prism8.4绘制,SSD曲线用Origin 8.0绘制。
2. 结果
2.1 南水北调中线总干渠水中重金属含量及时空分布规律
调查期间, 南水北调中线总干渠水中18种重金属的浓度见表 3。Cr、Mn、Fe、Co、Ni、Cu、Zn、As、Se、Sr、Cd、Ba、V、U和Rb的检出率均为100%, Ti、Pb和Bi的检出率分别为67.74%、85.48%和43.55%。18种重金属浓度分别为Ti (0—102.79 μg/L)、Cr (0.40—3.47 μg/L)、Mn (0.11—27.25 μg/L)、Fe (67.51—588.90 μg/L)、Co (0.06—0.37 μg/L)、Ni (1.58—21.58 μg/L)、Cu (0.35—6.02 μg/L)、Zn (1.13—64.24 μg/L)、As (0.94—2.33 μg/L)、Se (0.05—0.83 μg/L)、Sr (145.42—269.80 μg/L)、Cd (0—0.12 μg/L)、Ba (54.56—105.90 μg/L)、Pb (0—7.36 μg/L)、V (1.52—2.60 μg/L)、Bi (0—13.56 μg/L)、U (0.94—1.22 μg/L)和Rb (0.55—1.46 μg/L)。18种重金属的平均浓度大小依次为Fe (199.27 μg/L) > Sr (164.98 μg/L) > Ba (69.36 μg/L) > Zn (19.81 μg/L) > Ti (6.71 μg/L) > Ni (4.04 μg/L) > Mn (3.18 μg/L) > Cu (2.12 μg/L) > V (2.06 μg/L) > Cr (1.87 μg/L) > As (1.63 μg/L) > U (1.09 μg/L) > Rb (0.81 μg/L) > Se (0.52 μg/L) > Pb (0.46 μg/L) > Bi (0.36 μg/L) > Co (0.12 μg/L) > Cd (0.03 μg/L), 均未超出《地表水环境质量标准》(GB 3838—2002)Ⅰ类水标准[28]和《生活饮用水卫生标准》(GB 5749—2006)[29]限值。从各采样位点和时间点看, 除2018年5月份各采样点Fe的浓度超出《生活饮用水卫生标准》(GB 5749—2006)[29]限值外, 其他采样点和时间点18种金属的浓度均未超出《地表水环境质量标准》(GB 3838—2002) Ⅰ类水标准[28]和《生活饮用水卫生标准》(GB 5749—2006)[29]限值。从变异系数看, Ti、Mn、Pb和Bi等4种重金属浓度的变异系数均超过200%, 特别是Bi(变异系数505.41%), 说明南水北调中线总干渠水中这4种重金属浓度在空间或时间上分布相对很分散; Fe、Co、Ni、Cu、Zn和Cd等6种重金属浓度的变异系数在55%—85%, 表明这些重金属元素浓度在空间或时间上分布相对分散; 其余重金属元素的变异系数均较小, 表明其浓度在空间或时间上分布相对均匀。
表 3 南水北调中线总干渠水中18种重金属的浓度Table 3. Concentrations of 18 heavy metals in water from the Main Canal of Middle Route of the South-to-North Water Diversion Project (μg/L)重金属
Heavy metal浓度
Concentration平均值
Mean标准差
SD变异系数
Coefficient of
Variation (%)检出率
Detection
frequency (%)地表水质标准
Environmental quality
standards for surface water (Ⅰ)生活饮用水卫生标准
Standards for drinking
water qualityTi 0—102.79 6.71 18.04 269.02 67.74 — — Cr 0.40—3.47 1.87 0.77 41.31 100 ≤10 <50 Mn 0.11—27.25 3.18 5.59 175.66 100 — <100 Fe 67.51—588.90 199.27 136.91 68.70 100 — <300 Co 0.06—0.37 0.12 0.07 57.21 100 — — Ni 1.58—21.58 4.04 2.76 68.51 100 — <200 Cu 0.35—6.02 2.12 1.27 59.85 100 ≤10 <1000 Zn 1.13—64.24 19.81 14.12 71.28 100 ≤50 <1000 As 0.94—2.33 1.63 0.31 19.25 100 ≤50 <10 Se 0.05—0.83 0.52 0.11 21.36 100 ≤10 <10 Sr 145.42—269.80 164.98 16.03 9.72 100 — — Cd 0—0.12 0.03 0.02 84.00 100 ≤1 5 Ba 54.56—105.90 69.36 9.13 13.16 100 — <700 Pb 0—7.36 0.46 0.99 216.09 85.48 ≤10 <10 V 1.52—2.60 2.06 0.23 11.21 100 — — Bi 0—13.56 0.36 1.81 505.41 43.55 — — U 0.94—1.22 1.09 0.08 7.17 100 — — Rb 0.55—1.46 0.81 0.16 20.06 100 — — 我们进一步分析了南水北调中线总干渠水中重金属含量的时空变化规律(图 2和图 3)。由图 2可以看出, Se、Rb、U、Sr和Ba等6种重金属元素的浓度在不同采样时间点基本保持稳定。Co、Cd、Pb、Mn、Ni和Fe的浓度随时间推移整体呈现下降趋势。V、As、Cr、Cu和Zn的浓度随着时间的推移呈现相似的、波浪式上下波动的变化趋势, 其中Zn的变化幅度最大。Bi和Ti的浓度峰值分别出现在2018年5月和2019年2月, 在其他采样时间点则为零或趋于零。
由图 3可以看出, Co、Cr、As、U、V、Bi、Rb、Sr和Ba等9种重金属的浓度在不同采样点基本维持稳定。Pb、Cd、Mn、Zn、Ti和Fe的浓度在不同采样点间呈现上下波动的变化趋势, 其中, Pb和Cd的浓度在相邻采样点间呈现幅度相当、波浪式上下的变化趋势; Mn浓度的峰值出现在采样点S6; Zn浓度的峰值出现在S10, 其次为S11, 其他位点间浓度变化幅度较小; Ti浓度的峰值出现在采样点S1, 采样点S2、S6、S8和S9的Ti浓度则为零或趋于零, 其余样点Ti浓度在6.79—11.07 μg/L小幅度变化; Fe浓度的最大值出现在采样点S11, 其他位点间浓度变化幅度较小。Cu浓度在采样点S3(3.08 μg/L)明显高于其他位点(在2 μg/L左右轻微波动)。Bi浓度在采样点S4最高, 其次为采样点S3和S5, 而在其他采样点则为零或趋于零。Ni浓度的最大值出现在采样点S1, 其他采样点Ni浓度水平相当。
2.2 南水北调中线总干渠水中重金属的人体健康风险评价
根据健康风险评价模型, 评价了南水北调中线总干渠水中重金属Cr、Cd、As、Cu、Pb、Zn、Ni和Mn通过饮水途径对不同人群(成人和儿童)的健康风险(表 4)。由表 4可知, 南水北调中线总干渠水中Cr、Cd、As对成人和儿童的个人致癌风险年均值分别为43.03×10–9、0.09×10–9、13.69×10–9 /年和49.77×10–9、0.10×10–9、15.84×10–9/年, 可以看出这3种重金属的致癌健康风险大小顺序为Cr>As>Cd, 且其对儿童的致癌风险稍高于成人。其中, Cr、As对成人和儿童的个人致癌风险年均值和Cd对成人和儿童的致癌风险年均值相差2—3个数量级, 说明水中重金属污染物的致癌健康风险主要由Cr和As产生。3种重金属对成人和儿童的总致癌风险年均值分别为56.81×10–9和65.71×10–9/年。南水北调中线总干渠水中Cu、Pb、Zn、Ni、Mn对成人和儿童的非致癌风险年均值分别为23.73×10–11、18.32×10–11、3.71×10–11、11.32×10–11、3.88×10–11/年和27.46×10–11、21.20×10–11、4.29×10–11、13.10×10–11、4.49×10–11/年, 可以看出这5种重金属的非致癌风险大小排序为Cu>Pb>Ni>Mn>Zn, 且不同重金属的非致癌风险之间相差不大, 对儿童的非致癌风险稍高于成人。同样地, 南水北调中线总干渠水中重金属对儿童的总健康风险值(6.64×10–8/年)稍高于对成人的总健康风险值(5.75×10–8/年)。
表 4 调查期间南水北调中线总干渠水中重金属平均健康风险值Table 4. Average health risks of heavy metals in water from the Main Canal of Middle Route of the South-to-North Water Diversion Project during investigation period人群
Population数据分布
Data distribution致癌健康风险值
Carcinogen
risk$ \mathop R\nolimits_i^c $ (×10–9/年)
非致癌健康风险值
Non-carcinogen
risk$ \mathop R\nolimits_i^n $ (×10–11/年)
总风险值
Total risk
$ {{\displaystyle R}}_{总} $ (×10–8/年)
Cr Cd As 合计 Cu Pb Zn Ni Mn 合计 成人
Adult平均值Mean 43.03 0.09 13.69 56.81 23.73 18.32 3.71 11.32 3.88 60.96 5.75 最小值Min 9.15 0.01 7.87 17.03 3.90 0 0.21 4.44 0.13 8.68 1.71 最大值Max 79.66 0.41 19.62 99.69 67.54 294.85 12.02 60.55 33.25 468.21 10.44 标准差SD 17.76 0.07 2.63 14.21 39.59 2.64 7.76 6.82 儿童
Children平均值Mean 49.77 0.10 15.84 65.71 27.46 21.20 4.29 13.10 4.49 70.54 6.64 最小值Min 10.59 0.01 9.10 19.70 4.52 0 0.25 5.14 0.15 10.06 1.98 最大值Max 92.13 0.47 22.69 115.29 78.14 341.15 13.90 70.06 38.47 541.72 12.07 标准差SD 20.54 0.08 3.05 14.44 45.80 3.06 8.97 7.89 2.3 南水北调中线总干渠水中重金属对淡水生物的生态风险评价
使用Slogistic1分布拟合8种重金属对所有本土淡水生物的SSD曲线(图 4)。通过SSD曲线计算得到8种重金属的HC5值(表 5), 可以看出, 不同重金属对全部本土淡水生物物种的HC5值从大到小排序依次为As>Ni>Pb>Cr>Zn>Se>Cd>Cu, 说明这8种重金属对本土淡水生物的生态风险依次升高。As对全部本土淡水物种的HC5值为777.20, 对本土淡水生态系统的影响相对较小。Se、Cd和Cu的HC5值均小于5 μg/L, 可见这3种重金属对本土淡水生态系统的影响较大。基于SSD曲线, 我们利用南水北调中线总干渠水中这8种重金属的平均实测浓度计算了PAF值, 结果8种重金属的PAF值均小于5, 说明这8种重金属对南水北调中线总干渠水中全部水生物种的影响比例均不到5%。因此, 以保护95%的生物物种为标准, 这8种重金属不会对南水北调中线总干渠全体水生物种造成潜在影响。
表 5 八种重金属对所有本土淡水物种的HC5值和PAF值Table 5. HC5 and PAF values of 8 heavy metals to all the native freshwater species重金属
Heavy metal决定系数
Coefficient of
determination R2残差平方和
Sum of squares
for error (SSE)HC5 PAF (%) As 0.93 0.05 777.20 0 Cd 0.99 0.10 3.96 0.50 Cr 0.99 0.03 59.79 0.66 Cu 0.99 0.04 2.79 3.38 Ni 0.96 0.11 93.98 0.80 Pb 0.98 0.04 89.52 0.05 Zn 0.99 0.03 25.43 4.39 Se 0.96 0.04 4.29 2.79 注: PAF为可能受影响的物种比例, 根据本研究平均实测环境浓度代入SSD拟合方程计算得出; HC5为对5%的研究物种产生危害的污染物浓度, 是SSD曲线图中纵坐标为0.05时对应的对数浓度换算成的质量浓度(μg/L); 下同Note: PAF, potentially affected fraction, is caculated by substituting measured mean environmental concentration into fitted SSD equation. HC5, hazardous concentrations for 5% of species, is the caculated mass concentration (μg/L) when the value is 0.05 in the Y-axis of SSD curve. The same applies below 为了进一步探究不同水生物种类别对重金属的敏感性差异, 我们选取了其中藻类和甲壳类的毒性数据, 构建了SSD曲线(部分重金属数据缺失, 未能成功拟合曲线; 图 5)。通过SSD曲线计算得到重金属对藻类和甲壳类的HC5值(表 6), 可以看出, 藻类对不同重金属的敏感性从大到小依次排序为Cu>Zn>Cd>Pb>Cr, 甲壳类对不同重金属的敏感性从大到小依次排序为Cr>Pb>Cd>Cu>Zn, 藻类对Cu、Cd和Zn较甲壳类敏感, 但甲壳类对Cr和Pb比藻类敏感。我们进一步利用南水北调中线总干渠水中目标重金属的平均实测浓度值计算了PAF值, 结果Cu和Zn对藻类的PAF值分别为8.54%和16.77%, Cr对甲壳类的PAF值为6.44%, 其余重金属对藻类和甲壳类的PAF值均小于2%。结果表明, 以保护95%的生物物种为标准, 南水北调中线总干渠水中Cu和Zn可能对藻类种群具有一定的影响, Cr对甲壳类种群具有一定的影响, 但其他重金属不会对藻类和甲壳类种群造成潜在影响。
表 6 不同重金属对本土淡水藻类和甲壳类的HC5值和PAF值Table 6. HC5 and PAF values of different heavy metals to native freshwater algae and crustaceans物种
类别
Species重金属
Heavy metal决定系数
Coefficient of determination R2残差平方和
Sum of squares for error (SSE)HC5 PAF (%) 藻类Algae Cd 0.97 0.03 4.24 0.09 Cr 0.94 0.02 84.82 0.01 Cu 0.91 0.03 1.38 8.54 Pb 0.94 0.02 67.98 0.05 Zn 0.97 0.01 1.56 16.77 甲壳类Crustaceas Cd 0.97 0.05 9.10 0 Cr 0.96 0.03 0.72 6.44 Cu 0.99 0.02 4.14 1.35 Pb 0.96 0.01 31.23 0.19 Zn 0.97 0.04 54.84 1.89 3. 讨论
3.1 南水北调中线总干渠水中重金属含量及时空分布规律
在本研究监测周期内,各采样点水样中除Ti、Pb和Bi的检出率分别为67.74%、85.48%和43.55%外, 其余15种重金属的检出率均为100%, 说明这些重金属在南水北调中线总干渠水中普遍存在。除2018年5月份Fe的浓度超出《生活饮用水卫生标准》(GB 5749—2006)[29]限值外(超出率为20.91%—96.30%), 监测周期内各采样点水中18金属的浓度均未超出《地表水环境质量标准》(GB 3838—2002) Ⅰ类水标准[28]和《生活饮用水卫生标准》(GB 5749—2006)[29]限值, 表明南水北调中线总干渠水中重金属含量不高。Nong等[14, 15]于2015—2018年对南水北调中线总干渠水样中常见几种重金属的含量进行监测, 发现其含量也未超出《地表水环境质量标准》(GB 3838—2002) Ⅰ类水标准[28]。对比Nong等[14, 15]和本文的结果, 发现南水北调中线总干渠水中As、Se和Zn等重金属的含量在2016—2019年间呈逐年上升趋势, Cu在2016—2018年也呈逐年上升趋势, 但在2019年出现下降(表 7)。可见, 随着时间的推移, 南水北调中线总干渠水中某些重金属污染可能有加重的趋势, 值得进一步关注。作为南水北调中线工程的引水水源, 丹江口水库中2016—2017年水中重金属的含量稍低于本研究结果(表 7)[30], 说明南水北调中线总干渠沿线可能有重金属污染输入。
表 7 南水北调中线总干渠及丹江口水库水中重金属含量比较Table 7. Comparison of heavy metals concentrations in water from the Main Canal of Middle Route of the South-to-North Water Diversion Project and Danjiangkou Reservoir (μg/L)水体名称
Water body采样时间
Sampling time重金属
Heavy metalPb As Cd Se Cr Cu Zn Fe Co Ni Mn Sr V 南水北调中线总干渠[14] 2015—2016年 0.43 0.86 0.03 0.3 4.01 1.54 1.69 — — — — — — 南水北调中线总干渠[15] 2016年 — 0.93 — 0.33 — 1.68 2.06 — — — — — — 南水北调中线总干渠[15] 2017年 — 0.93 — 0.32 — 2.09 2.09 — — — — — — 南水北调中线总干渠[15] 2018年 — 0.90 — 0.38 — 2.17 2.12 — — — — — — 南水北调中线总干渠[本研究] 2019年 0.26 1.62 0.02 0.54 1.85 1.98 19.44 162.84 0.11 3.85 1.37 167.47 2.06 丹江口水库[30] 2016—2017年 0.06 1.7 0 — 0.91 0.72 5.33 105 0.11 2.12 0.45 106 1.54 注: “—”表示没有相应数据Note: “—” means no exsisting data 在本研究中, 除了U、Rb、Sr和Ba等重金属外, 南水北调中线总干渠水中多数重金属的浓度均表现出时间或空间分布差异。近年来南水北调中线总干渠水中CODMn、氨氮、总氮和总磷等污染物的空间变化幅度较小[13]; 南水北调总干渠本身采取了隔离防护、截流沟和防渗土工膜等多种防污措施[13], 故基本可以排除点源污染和地表径流污染向总干渠的输入。由于近年来华北地区大气污染问题严峻, 总干渠的干沉降通量较大[11]。降雨降尘和桥面径流等可能是南水北调工程总干渠长距离输水过程中影响水质的重要因素[11]。我们认为这也是影响总干渠水中重金属含量时空分布差异的两种主要污染途径。在时间分布上, Co、Cd、Pb、Mn、Ni和Fe的浓度随时间推移整体呈现下降趋势, 而V、As、Cr、Cu、Zn、Bi和Ti的浓度则随时间变化存在波动。在空间分布上, 南水北调中线总干渠水中Pb、Cd、Mn、Zn、Ti、Fe、Cu、Bi和Ni等重金属的浓度呈现一定差异。Nong等[14—15]于2015—2018年对南水北调中线总干渠表层水样中As、Hg、Cd、Cr、Se、Pb、Cu和Zn等重金属的浓度进行监测, 发现Pb、As和Cd等的浓度也表现出一定的空间分布差异。Fe和Mn是地球化学循环的主要元素[1], 其中Mn主要来源于自然风化作用, 而Fe还可来源于工业排放[1, 30], 本研究中Fe和Mn随时间或空间的变化趋势基本一致, 说明二者污染很可能主要为自然来源。Cu、Zn、Cd和Pb污染可来源于农业排放、工业排放和生活排放[1, 30]。本研究中Cu和Zn浓度的时间变化趋势大体一致, 且丰水期浓度相对较高, 由于丰水期往往为农业生产期[30], 因此认为Cu和Zn污染主要来源于农业排放。Cu在采样点S3(沙河渡槽进口)的浓度(3.08 μg/L)明显高于其他采样位点(2 μg/L左右), 可能与沙河渡槽地区农业活动量大导致Cu通过大气干湿沉降进入干渠有关, 因为沙河渡槽段是从地面架高的明渠且沿线密布农田。个别样点(S10、S11, 分别位于天津、北京)水样中Zn的浓度高于其他样点, 还可能与这两个地区人口密集、工业和生活排放较高有关。本研究中Cd和Pb的浓度随时间变化呈现逐渐下降的趋势, 且在不同样点之间均维持小幅度、上下轻微波动的变化, 表明二者最主要可能来源于工业排放, 二者的时间变化趋势说明近年来南水北调中线总干渠沿线地区人类活动导致的重金属污染排放得到了一定控制。
3.2 健康风险评价
在本研究中, 南水北调中线总干渠水中3种化学致癌物Cr、Cd和As通过饮水途径对成人和儿童的致癌风险年均值大小排序为Cr>As>Cd, 这与广州市主要饮用水源[31]、柳江流域饮用水源[20]和贵州荔波喀斯特洞穴水[24]等的研究结果一致。这3种化学致癌物通过饮水途径所致的成人和儿童的个人平均年健康风险值均未超过美国环境保护署推荐的最大可接受风险水平(1×10–4/年)和英国皇家协会、瑞典环境保护局及荷兰建设和环境部的推荐水平(1×10–6/年)[24], 表明南水北调中线总干渠水中Cr、As和Cd对成人和儿童不会造成潜在健康风险。南水北调中线总干渠水中5种非化学致癌物Cu、Pb、Zn、Ni和Mn通过饮水途径对成人和儿童所致的非致癌风险值大小排序为Cu>Pb>Ni>Mn>Zn, 其年平均健康风险值的总和均远远低于荷兰建设和生态环境部(1×10–8/年)及英国皇家协会(1×10–7/年)的可忽略水平[24], 表明南水北调中线总干渠水中这5种非致癌物质导致的健康风险甚微。
健康总风险为致癌重金属和非致癌重金属所产生的健康风险之和。南水北调中线总干渠水中重金属对儿童和成人的健康总风险值分别为6.62×10–8/年和5.74×10–8/年, 远低于美国环境保护署推荐的最大可接受风险水平(1×10–4/年)和英国皇家协会、瑞典环境保护局及荷兰建设和环境部的推荐水平(1×10–6/年)[24], 表明南水北调中线总干渠水中重金属污染不会对沿线居民的健康造成潜在风险。其中, 对儿童的健康总风险稍高于成人, 这与陆浑水库饮用水源[32]、柳江流域饮用水源[20]、宁波市地表水[33]和贵州荔波喀斯特洞穴水[24]等研究结果一致, 说明儿童对重金属的敏感度高于成人, 更容易受到重金属的危害。8种重金属元素中, Cr对总健康风险的贡献率最大, 对成人和儿童的平均贡献率分别为75.76%和75.75%; 其次为As, 对成人和儿童的平均贡献率分别为24.10%和24.11%。徐承香等[24]发现贵州荔波喀斯特洞穴水中Cr和As对成人和儿童总健康风险的平均贡献率均达99.60%, 与本研究结果高度相似。其他多项研究[17, 23, 34, 35]也显示, 我国水体中As是对人体总健康风险起主要贡献的重金属元素。这些研究均提示,应对水体重金属As污染开展优先防控。
3.3 生态风险评价
本研究利用SSD法评估了南水北调中线总干渠水中常见重金属对本土淡水物种的生态风险。基于HC5值比较了淡水生物对不同重金属的敏感性, 结果8种目标重金属对全部本土淡水生物物种的HC5值从大到小排序依次为As>Ni>Pb>Cr>Zn>Se>Cd>Cu, 相应的生态风险依次升高, 说明淡水生物对重金属Cu最敏感。孔祥臻等[8]也曾利用SSD法评估了几种重金属对淡水生物的生态风险, 得到不同重金属对全部淡水物种的HC5值大小排序为Mn>Pb>Zn>Hg>Cd>Cu。利用同样的方法, 刘昔等[36]的研究结果显示, 不同重金属对全部淡水生物的 HC5 值大小排序依次为Zn>Pb>Cd>Hg>Cr>Cu, 淡水生物对重金属Cu的敏感性最高, 对重金属Zn的敏感性最低。三项研究均提示, Cu对淡水生态系统的影响相对最高, 其次为Cd、Cr和Zn等, 这在一定程度上也说明了本研究评价结果的可信度。我们进一步通过计算藻类和甲壳类的HC5值以比较其对不同重金属的敏感性, 结果藻类对Cu的敏感性最高, 甲壳类对Cr的敏感性最高, 藻类对Cu、Cd和Zn较甲壳类敏感, 但甲壳类对Cr和Pb比藻类敏感。
基于SSD曲线, 我们利用南水北调中线总干渠水中重金属的平均实测浓度值计算了PAF值, 用以评估在实际暴露环境中南水北调中线总干渠中本土淡水生物所面临的生态风险。基于全部淡水生物物种的SSD曲线的计算结果显示, 8种重金属的PAF值均小于5, 即这8种重金属对南水北调中线总干渠水中全部淡水生物的影响比例均不到5%。孔祥臻等[8]的研究显示, 杭州西湖和长江铜陵段分别有7.42%和4.75%的水生生物种群受到重金属影响, 而黄河口则有39.17%的水生生物种群受到重金属影响, 这与长江铜陵段和杭州西湖受到轻微重金属污染而黄河口重金属污染状况十分严重的监测结果基本一致。本研究中8种重金属对全部淡水生物种群的影响比例均小于杭州西湖、长江铜陵段和黄河口, 这与其相应浓度低于在杭州西湖、长江铜陵段和黄河口监测的浓度相一致。这些研究提示, 水体重金属污染越严重, 水体中水生生物受到重金属影响的比例越高。因此, PAF值也反过来说明, 南水北调中线总干渠水中重金属污染水平整体不高。研究表明, 藻类和甲壳类是对水环境变化比较敏感的水生生物类群[37, 38]。重金属可通过破坏藻细胞的生长代谢过程、光合作用等影响藻类种群动态[39]; 可通过持续的生物富集, 对甲壳类的生长发育、繁殖和生理代谢等造成毒性危害[38]。因此, 我们还研究了实际暴露浓度(平均浓度)下, 南水北调中线总干渠水中重金属对藻类和甲壳类的生态风险。结果显示, Cu和Zn对藻类的PAF值分别为8.54%和16.77%, Cr对甲壳类的PAF值为6.44%, 其余重金属对藻类和甲壳类的PAF值均小于2%。大量研究表明, 藻类对Cu比Zn敏感[39], 但南水北调中线总干渠中Zn的浓度比Cu高, 这可能是导致Zn对藻类种群的影响比例高于Cu的原因。本研究结果提示, 以保护95%的生物物种为标准, 南水北调中线总干渠水中Cu和Zn对藻类种群具有一定影响, Cr对甲壳类种群具有一定影响, 而其他重金属则对这两类水生生物种群没有影响。
4. 结论
(1) 南水北调中线总干渠水中18种重金属的检出率较高, 但其当前含量水平不高, 部分重金属表现出一定的时空分布差异。(2) 南水北调中线总干渠水中8种常见重金属(Cr、Cd、As、Cu、Pb、Zn、Ni和Mn)不会对人体造成潜在健康风险。(3) 以保护95%的生物物种为标准, 南水北调中线总干渠水中8种常见重金属(As、Ni、Pb、Cr、Zn、Se、Cd和Cu)不会对全部淡水生物种群造成潜在影响, 但某些重金属(Cu、Zn和Cr)对较为敏感的水生类群(藻类、甲壳类)可能具有一定的潜在生态风险, 值得后续进一步关注。
-
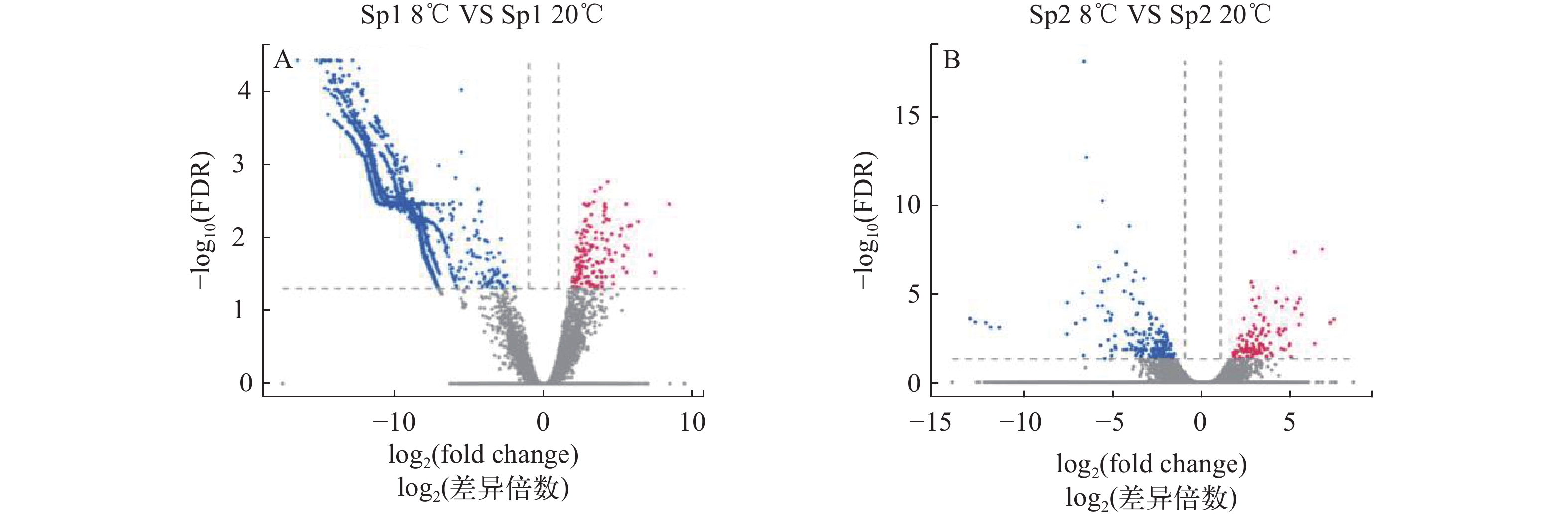
图 1 低温胁迫下不同形态群体拟穴青蟹肝胰腺基因表达差异火山图
A. 低温胁迫下Sp1群体基因表达差异火山图; B. 低温胁迫下Sp2群体基因表达差异火山图。横轴为样本的log2(差异倍数)均值, 纵轴为-lg (FDR)。图中每个点代表一个基因, 其中红色表示上调基因, 蓝色表示下调基因, 灰色表示非差异基因
Figure 1. The ‘volcano plot’ picture of differentially expressed genes of Scylla paramamosain with different morphological populations under cold challenge
A. The ‘volcano plot’ picture of differentially expressed genes of Sp1 population under cold challenge; B. The ‘volcano plot’ picture of differentially expressed genes of Sp2 population under cold challenge. The horizontal axis is the average log2 (fold change) of the sample, and the vertical axis is -lg (FDR). The red dot indicates the up-regulated gene, the blue dot indicates the down-regulated gene, and the gray dot indicates the non-differentially expressed gene
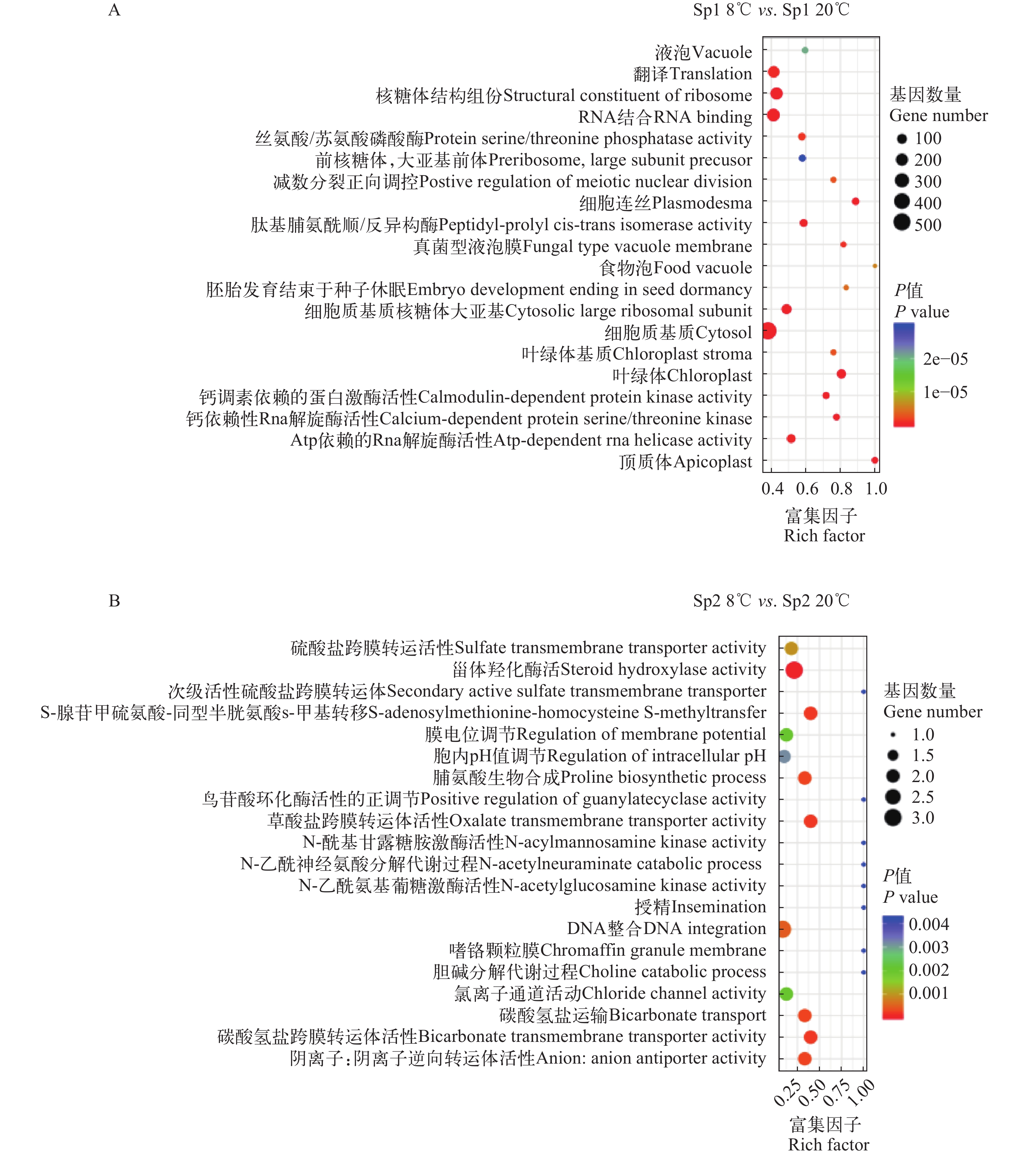
图 2 差异表达基因的GO富集分布散点图
A. 低温胁迫下Sp1群体差异表达基因的GO富集分布散点图; B. 低温胁迫下Sp2群体差异表达基因的GO富集分布散点图
Figure 2. GO enrichment results of differentially expressed genes
A. GO enrichment results of differentially expressed genes of Sp1 population under cold challenge; B. GO enrichment results of differentially expressed genes of Sp2 population under cold challenge
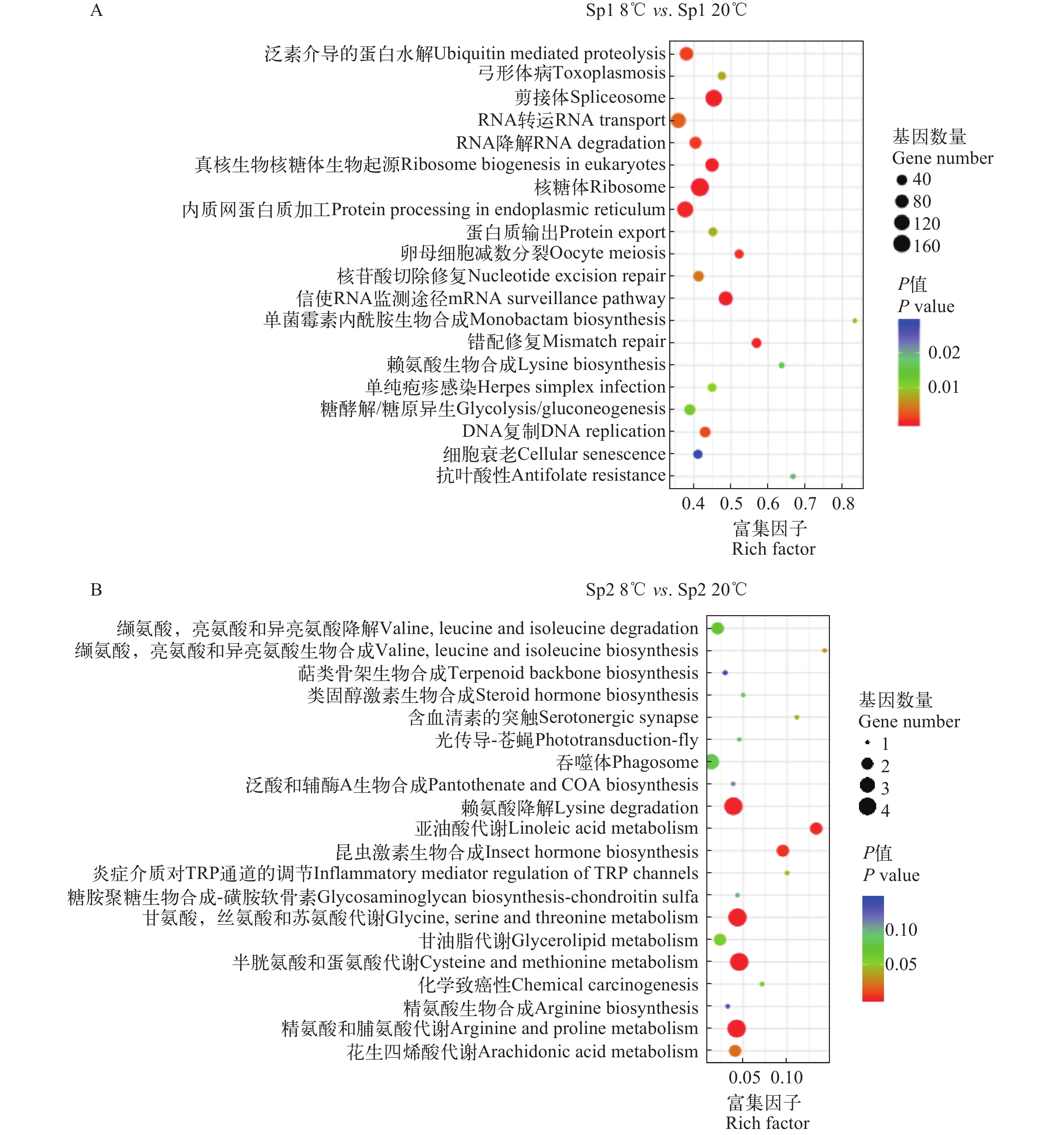
图 3 差异表达基因的KEEG富集分布散点图
A. 低温胁迫下Sp1群体差异表达基因的KEEG富集分布散点图; B. 低温胁迫下Sp2群体差异表达基因的KEEG富集分布散点图
Figure 3. KEGG enrichment results of differentially expressed genes
A. KEGG enrichment results of differentially expressed genes of Sp1 population under cold challenge; B. KEGG enrichment results of differentially expressed genes of Sp2 population under cold challenge
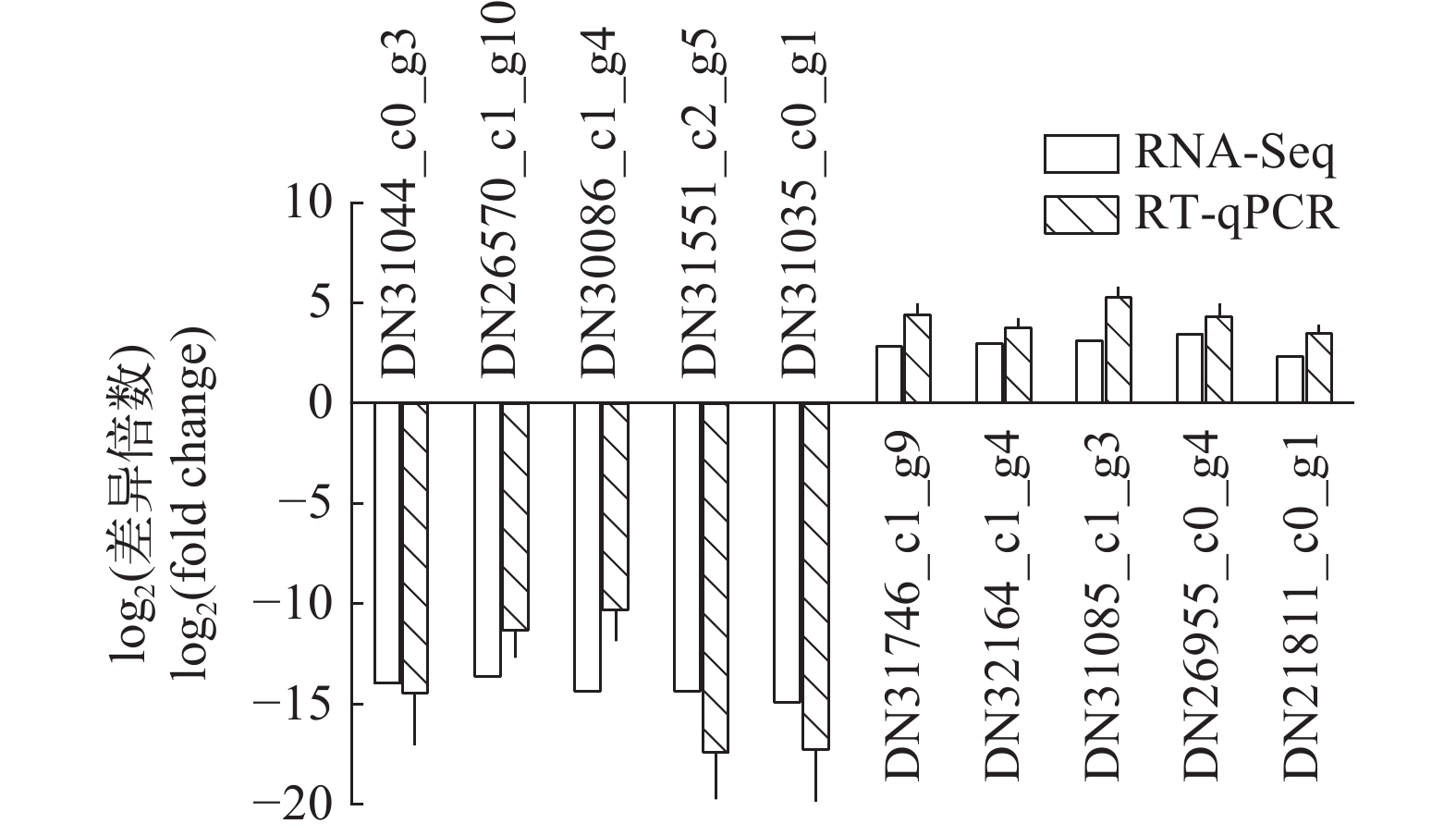
表 1 引物序列
Table 1 Primers used in this study
基因ID
Gene ID序列
Sequence (5′—3′)扩增子
Amplicon (bp)描述
DescriptionDN31044_c0_g3 TGATCTACGACAT
GGGAGGC158 下调表达基因 TTTGCGCTTGAA
GTCTTGCTDN26570_c1_g10 CGAAAAGAAAGA
GGGCGAGG175 下调表达基因 TTCGTCACTTCCT
CTGCCTTDN30086_c1_g4 TTCCCTCTCGAAA
CATGCCT195 下调表达基因 TGCGGCCATGGTA
GAAATTGDN31551_c2_g5 CCTCCTCATCAA
GTGCCTCA227 下调表达基因 CTTCCTCTTGCAA
CTCACGGDN31035_c0_g1 CTGCACGTGGAAA
TCTGCTT189 下调表达基因 CGCGACCTCTTCA
TCCAAAGDN31746_c1_g9 CCTGATTCAAGAT
GCGGGTG234 上调表达基因 CACTGCTCCACAA
TAGACGCDN32164_c1_g4 CCTCCATGACAA
GCTGCATC182 上调表达基因 TGTTGGTGGGGA
TAATGCCTDN31085_c1_g3 TGAAAAGGAACC
AAGCACCG153 上调表达基因 GTTGGACGGAGCT
ATGCATGDN26955_c0_g4 ATAAAGAGGTGGT
GGAGGGC245 上调表达基因 CTCCGTCTTGACC
AGTCTGTDN21811_c0_g1 GGCTTTGCTGTC
CTTTTCCA191 上调表达基因 CATGGTCTCTGG
AAGGTCGT18S rRNA TGATTACGTCCCT
GCCCTTT162 内参基因 ACATCTTTCCGT
CAGCTCGA表 2 不同形态群体拟穴青蟹肝胰腺转录组数据
Table 2 Hepatopancreatic transcriptome data of Scylla paramamosain with different morphological populations
样品
Sample有效数据
Valid data
(Gb)有效读长数
Number of
valid reads匹配读长数
Mapped ReadsQ20
(%)GC
(%)Sp1 20℃-a 5.73 40997180 36712207 98.24 48.89 Sp1 20℃-b 5.22 37302044 33850351 98.29 50.02 Sp1 20℃-c 5.89 42149974 37375442 98.28 50.01 Sp1 8℃-a 4.71 33665342 30041579 98.37 51.30 Sp1 8℃-b 5.15 36857374 33248660 98.29 50.46 Sp1 8℃-c 5.80 41444206 36790048 98.35 51.62 Sp2 20℃-a 5.61 40138790 35549897 98.25 49.82 Sp2 20℃-b 6.33 45264650 40529976 98.32 50.54 Sp2 20℃-c 5.83 41729606 37554633 98.24 48.93 Sp2 8℃-a 4.66 33335922 30397607 98.22 50.09 Sp2 8℃-b 5.96 42601794 37791107 98.28 50.41 Sp2 8℃-c 5.11 36564424 32509406 98.28 50.12 表 3 DIAMOND注释结果
Table 3 DIAMOND annotation results
数据库
Database数量
Number注释率
Annotation rate (%)swissprot 12556 15.34 KEGG 12848 15.70 GO 13951 17.04 Pfam 14119 17.25 eggNOG 16646 20.34 NR 18278 22.33 表 4 低温胁迫下两种不同形态群体拟穴青蟹差异表达最显著的前10个基因
Table 4 The top 10 differentially expressed genes of Scylla paramamosain with different morphological populations under cold challenge
Sp1 8℃ vs. Sp1 20℃ 基因ID Gene ID Nr注释 NR annotation log2(差异倍数) log2(fold change) DN26767_c0_g2 肌动蛋白3 X2异构体
Actin-3-like isoform X2–14.31 DN31044_c0_g3 热休克蛋白70 X6异构体
Heat shock 70 kDa protein-like isoform X6–13.89 DN29152_c1_g1 热休克蛋白82
Heat shock protein HSP82-like–14.74 DN26570_c1_g10 热休克蛋白90
Heat shock protein 90-like–13.69 DN30086_c1_g4 60S核糖体蛋白L21
60S ribosomal protein L21–14.41 DN31551_c2_g5 60S核糖体蛋白L12
60S ribosomal protein L12–14.31 DN31035_c0_g1 延伸因子2
Elongation factor 2-like–14.97 DN31846_c0_g1 40S核糖体蛋白
S13-2 40S ribosomal protein S13-2-like–13.63 DN24607_c0_g13 60S核糖体蛋白L5
PREDICTED: 60S ribosomal protein L5-like–12.38 DN25988_c0_g1 60S核糖体蛋白L2-A
60S ribosomal protein L2-A-like–14.13 Sp2 8℃ vs. Sp2 20℃ 基因ID Gene ID Nr注释 NR annotation log2(差异倍数) log2(fold change) DN28300_c0_g2 甜菜碱同型半胱氨酸甲基转移酶
Betaine homocysteine methyl transferase-like protein–6.51 DN31746_c1_g9 吡咯啉-5-羧酸合成酶
Pyrroline-5-carboxylate synthetase2.78 DN25548_c0_g1 甘氨酸-N-甲基转移酶异构体X1
Glycine N-methyltransferase-like isoform X1–3.54 DN28628_c0_g6 蛋白质二硫化物异构酶2
Protein disulfide-isomerase 2-like–5.63 DN32164_c1_g4 自水解酶结构域3蛋白
Abhydrolase domain-containing protein 32.95 DN31085_c1_g3 ATP依赖性解旋酶PF08_0048
Probable ATP-dependent helicase PF08_00483.19 DN26955_c0_g4 乙醛脱氢酶家族3成员A1
Aldehyde dehydrogenase, dimeric NADP-preferring-like3.45 DN24644_c1_g1 脱氢酶/还原酶(SDR家族)蛋白11
Dehydrogenase/reductase SDR family member 11-like–2.59 DN29326_c0_g2 碱性氨基酸转运载体2
Cationic amino acid transporter 2–2.96 DN21811_c0_g1 Kruppel样因子
Kruppel-like factor2.32 -
[1] 马凌波, 张凤英, 乔振国, 等. 中国东南沿海青蟹线粒体COI基因部分序列分析 [J]. 水产学报, 2006, 30(4): 463-468. Ma L B, Zhang F Y, Qiao Z G, et al. Sequence analysis of mitochondrial COI gene of Scylla spp. along coast of southeastern China [J]. Journal of Fisheries of China, 2006, 30(4): 463-468.
[2] 高天翔, 王玉江, 刘进贤, 等. 基于线粒体12S rRNA序列探讨4种青蟹系统发育关系及中国沿海青蟹的分类地位 [J]. 中国海洋大学学报(自然科学版), 2007, 37(1): 57-60. Gao T X, Wang Y J, Liu J X, et al. Study on phylogenetic relationships of four Scylla species and taxonomic status of mud crab in China based on mitochondrial 12S rRNA sequences [J]. Periodical of Ocean University of China, 2007, 37(1): 57-60.
[3] 林琪, 李少菁, 黎中宝, 等. 中国东南沿海青蟹属不同种类的mtDNA COI基因序列分析及其系统发育 [J]. 厦门大学学报(自然科学版), 2008, 47(2): 268-273. Lin Q, Li S J, Li Z B, et al. Sequence analysis of mtDNA COI gene and molecular phylogeny of four spcies in Scylla from the coast of southeast China [J]. Journal of Xiamen University (
Natural Science ) , 2008, 47(2): 268-273. [4] Liu Z M, Zhu X L, Lu J, et al. Effect of high temperature stress on heat shock protein expression and antioxidant enzyme activity of two morphs of the mud crab Scylla paramamosain [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2018(223): 10-17.
[5] Liu Z M, Wang G Z, Wu L S, et al. Seasonal change in mitochondrial function and metabolic enzyme activity of different populations of the mud crab, Scylla paramamosain, from China [J]. Aquaculture, 2013(376-379): 68-75. doi: 10.1016/j.aquaculture.2012.11.007
[6] Kong X, Wang G, Li S. Seasonal variations of ATPase activity and antioxidant defenses in gills of the mud crab Scylla serrata (Crustacea, Decapoda) [J]. Marine Biology, 2008, 154(2): 269-276. doi: 10.1007/s00227-008-0920-4
[7] Kong X, Wang G, Li S. Effects of low temperature acclimation on antioxidant defenses and ATPase activities in the muscle of mud crab (Scylla paramamosain) [J]. Aquaculture, 2012(370-371): 144-149. doi: 10.1016/j.aquaculture.2012.10.012
[8] Saranyan P V, Ross N W, Benfey T J. Erythrocyte heat shock protein responses to chronic (in vivo) and acute (in vitro) temperature challenge in diploid and triploid salmonids [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2017(206): 95-104.
[9] Zheng J, Li L, Dong H, et al. Molecular cloning of heat shock protein 60 from Marsupenaeus japonicus and its expression profiles at early developmental stages and response to heat stress [J]. Aquaculture Research, 2018, 49(1): 301-312. doi: 10.1111/are.13461
[10] Houde A L S, Akbarzadeh A, Günther O P, et al. Salmonid gene expression biomarkers indicative of physiological responses to changes in salinity and temperature, but not dissolved oxygen [J]. The Journal of Experimental Biology, 2019, 222(Pt 13): jeb198036.
[11] Huang A M, Geng Y, Wang K Y, et al. Molecular cloning and expression analysis of heat shock protein 90 (Hsp90) of the mud crab, Scylla paramamosain [J]. Journal of Agricultural Science, 2013, 5(7): 1-11.
[12] Yang Y N, Ye H, Huang H, et al. Expression of Hsp70 in the mud crab, Scylla paramamosain in response to bacterial, osmotic, and thermal stress [J]. Cell Stress & Chaperones, 2013, 18(4): 475-482.
[13] Yang Y N, Ye H, Huang H, et al. Characterization and expression of SpHsp60 in hemocytes after challenge to bacterial, osmotic and thermal stress from the mud crab Scylla paramamosain [J]. Fish & Shellfish Immunology, 2013, 35(4): 1185-1191.
[14] Ding J, Chen F Y, Ren S Y, et al. Molecular characterization and promoter analysis of crustacean heat shock protein 10 in Scylla paramemosain [J]. Genome, 2013, 56(5): 273-281. doi: 10.1139/gen-2013-0002
[15] Grabherr M G, Haas B J, Yassour M, et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome [J]. Nature Biotechnology, 2011, 29(7): 644-652. doi: 10.1038/nbt.1883
[16] Mortazavi A, Williams B A, McCue K, et al. Mapping and quantifying mammalian transcriptomes by RNA-seq [J]. Nature Methods, 2008, 5(7): 621-628. doi: 10.1038/nmeth.1226
[17] Robinson M D, McCarthy D J, Smyth G K. edgeR: a Bioconductor package for differential expression analysis of digital gene expression data [J]. Bioinformatics (Oxford, England)
, 2010, 26(1): 139-140. doi: 10.1093/bioinformatics/btp616 [18] Young M D, Wakefield M J, Smyth G K, et al. Gene ontology analysis for RNA-seq: accounting for selection bias [J]. Genome Biology, 2010, 11(2): R14. doi: 10.1186/gb-2010-11-2-r14
[19] Kanehisa M, Araki M, Goto S, et al. KEGG for linking genomes to life and the environment [J]. Nucleic Acids Research, 2008(36): D480-D484.
[20] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔ CT method [J]. Methods, 2001, 25(4): 402-408. doi: 10.1006/meth.2001.1262
[21] Hsieh S L, Chiu Y C, Kuo C M. Molecular cloning and tissue distribution of ferritin in Pacific white shrimp (Litopenaeus vannamei) [J]. Fish & Shellfish Immunology, 2006, 21(3): 279-283.
[22] Xu Z, Liu A, Li S, et al. Hepatopancreas immune response during molt cycle in the mud crab, Scylla paramamosain [J]. Scientific Reports, 2020(10): 13102. doi: 10.1038/s41598-020-70139-2
[23] 孔祥会, 王桂忠, 王克坚, 等. 低温驯化下锯缘青蟹肝胰腺蛋白质表达及脂肪酸组成的变化 [J]. 水生生物学报, 2005, 29(5): 524-532. doi: 10.3321/j.issn:1000-3207.2005.05.009 Kong X H, Wang G Z, Wang K J, et al. Changes of protein expression and fatty acid composition in hepatopancreas of Scylla serrata under low temperature acclimation [J]. Acta Hydrobiologica Sinica, 2005, 29(5): 524-532. doi: 10.3321/j.issn:1000-3207.2005.05.009
[24] 刘子明, 王桂忠, 李少菁, 等. 低温季节不同种群拟穴青蟹线粒体呼吸速率和酶活性的差异 [J]. 厦门大学学报(自然科学版), 2018, 57(3): 354-362. Liu Z M, Wang G Z, Li S J, et al. Mitochondrial respiration rate and enzyme activity of two populations of Scylla paramamosain during low temperature seasons [J]. Journal of Xiamen University (
Natural Science ) , 2018, 57(3): 354-362. [25] Guderley H, St-Pierre J. Going with the flow or life in the fast lane: contrasting mitochondrial responses to thermal change [J]. The Journal of Experimental Biology, 2002, 205(Pt 15): 2237-2249.
[26] Yan Y, Xie X. Liver mitochondrial and whole-animal level metabolic compensation in a catfish during seasonal acclimatization [J]. Current Zoology, 2011, 57(1): 109-115. doi: 10.1093/czoolo/57.1.109
[27] Berner N J, Bessay E P. Correlation of seasonal acclimatization in metabolic enzyme activity with preferred body temperature in the Eastern red spotted newt (Notophthalmus viridescens viridescens) [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2006, 144(4): 429-436.
[28] 董丽君, 孟宪红, 孔杰, 等. 基于转录组分析筛选凡纳滨对虾低温胁迫下的差异表达基因 [J]. 中国水产科学, 2019, 26(1): 161-171. doi: 10.3724/SP.J.1118.2019.18061 Dong L J, Meng X H, Kong J, et al. Screening of differentially expressed genes related to the cold tolerance in Litopenaeus vannamei based on high-throughput transcriptome sequencing [J]. Journal of Fishery Sciences of China, 2019, 26(1): 161-171. doi: 10.3724/SP.J.1118.2019.18061
[29] Shi M, Zhang Q, Li Y, et al. Global gene expression profile under low-temperature conditions in the brain of the grass carp (Ctenopharyngodon idellus) [J]. PLoS One, 2020, 15(9): e0239730. doi: 10.1371/journal.pone.0239730
[30] Liu L, Zhang R, Wang X, et al. Transcriptome analysis reveals molecular mechanisms responsive to acute cold stress in the tropical stenothermal fish tiger barb (Puntius tetrazona) [J]. BMC Genomics, 2020, 21(1): 737. doi: 10.1186/s12864-020-07139-z
-
期刊类型引用(4)
1. 仇越,柳长顺,蒋晓辉,张希健. 国家水网工程可持续运行风险研究进展. 人民黄河. 2024(03): 148-155 .  百度学术
百度学术
2. 郭芳,刘信勇,张鋆,肖新宗,张屹哲,王超. 基于层次聚类和水质指数法的南水北调中线总干渠典型年份水质变化特征分析. 环境工程学报. 2024(03): 644-652 .  百度学术
百度学术
3. 于婉婷,王卓,布多,崔小梅. 水体中重金属处理技术、风险评价及来源解析研究进展. 云南化工. 2024(10): 1-6 .  百度学术
百度学术
4. 钟敖,张涵,赵钊,李健. 南水北调中线工程水源地淡水鱼虾吸虫囊蚴感染情况调查. 中国病原生物学杂志. 2023(06): 695-699+704 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: