TAXONOMY OF MICROCOLEACEAE IN BIOLOGICAL SOIL CRUSTS IN THE GURBANTUNGGUT DESERT
-
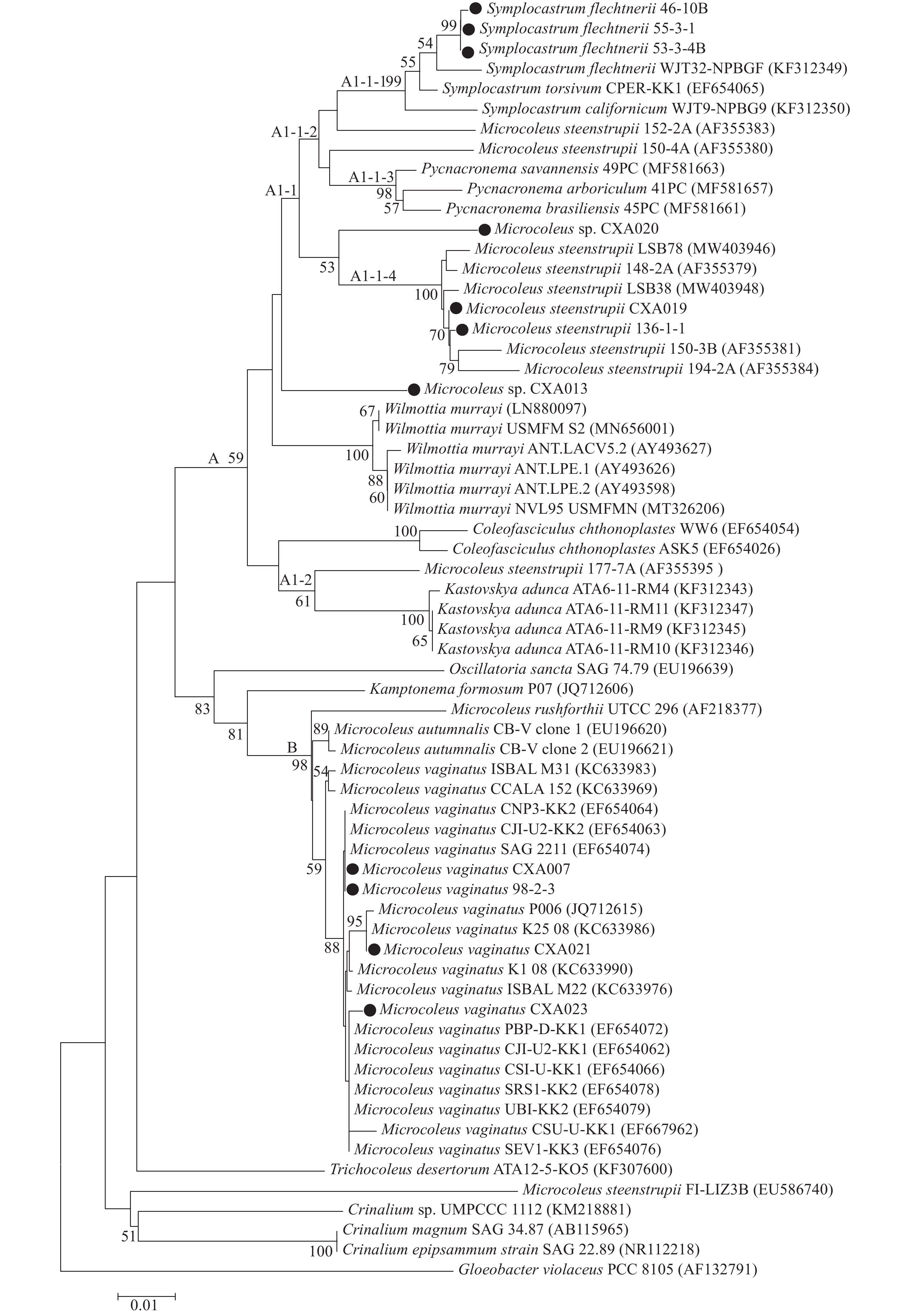
摘要: 实验研究了从古尔班通古特沙漠生物土壤结皮中分离纯化培养出的11株与微鞘藻(Microcoleus)形态接近的丝状蓝藻, 通过形态特征、16S rRNA和ITS二级结构相结合的多相分析方法对其进行分类学研究。研究结果表明, 实验藻株隶属于微鞘藻科(Microcoleaceae)的微鞘藻属(Microcoleus)和束脉藻属(Symplocastrum), 其中包括2个中国新记录种: 斯坦微鞘藻(Microcoleus steenstrupii)和细长束脉藻(Symplocastrum flechtnerii), 另外还有具鞘微鞘藻(Microcoleus vaginatus)和类似斯坦微鞘藻的存疑物种。藻丝多少与排列方式、细胞大小与末端细胞形状, 以及16S rRNA系统发育位置是确定微鞘藻(Microcoleus)与束脉藻(Symplocastrum)属于不同物种的关键依据, ITS二级结构是区分属内不同物种的重要参考。Abstract: Biological soil crusts (BSCs) play critical ecological functions in desert ecosystem. Microcoleus sp. are key filamentous cyanobacteria and play vital roles in BSCs. More and more strains of Microcoleaceae were found in desert areas, however, it is difficult to distinguish them in species level due to similar morphological characteristic. In this manuscript, 11 filamentous cyanobacterial strains with similar morphology to Microcoleus were isolated and purified from BSCs in Gurbantonggute Desert. The experimental cyanobacterial strains were examined morphologically as well as phylogenetically using 16S rRNA gene and the 16S—23S internal transcribed spacer (ITS) rigion. The results show that the experimental cyanobacterial strains belong to the genera Microcoleus and Symplocastrum, including two newly recorded species in China: M. steenstrupii and S. flechtnerii, as well as M. vaginatus and a suspect species similar to M. steenstrupii. The number and alignment of cyanobacterial filaments, cell size and the shape of apical cells, and phylogenetic relationship based on 16S rRNA are key evidence to identity different species of Microcoleaceae. Secondary structure of ITS are also vital reference to distinguish to different species in same genus.
-
Keywords:
- Biological soil crusts /
- Microcoleus /
- Morphological character /
- 16S rRNA /
- ITS
-
鳗鲡(Anguilla), 俗称河鳗, 又称白鳝、青鳝等, 属鳗鱼目、鳗鲡科鱼类, 广泛分布于热带、亚热带和温带地区; 其肉质鲜美, 营养丰富, 具有一定药膳价值, 是公认的水产珍品, 一直享有“水中人参”的美誉[1]。自20世纪90年代中期以来, 鳗鲡已经成为我国重要的水产养殖种类, 连续多年在单一出口创汇水产品品种中排名第一。当前我国鳗鲡的养殖主要分布在南方地区, 养殖品种以日本鳗鲡和美洲鳗鲡为主。其中, 日本鳗鲡多在广东省主要采用土池模式养殖, 美洲鳗鲡主要在福建省及其他省份采用水泥池精养模式, 一般在投喂前将粉状配合饲料制作成面团状饲料的过程中添加鱼油。
鱼油是鱼粉加工过程中产出的副产品, 富含二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)酸等n-3高不饱和脂肪酸(HUFA)。研究表明, 鱼类饲料中添加适量鱼油, 可以满足生长所需的能量和必需脂肪酸, 提高饲料利用率, 其在维持细胞膜的流动性、增强免疫、提高抗氧化能力及调节脂类代谢等方面发挥着重要的作用[2-5]。因此, 富含HUFA的鱼油一直被作为水产动物饲料优质脂肪源, 尤其是鳗鲡养殖中使用的最主要脂肪来源。由于鱼油中HUFA含量高, 极易氧化变质, 往往在鳗鲡养殖场将粉状配合饲料加水制作成面团状饲料时直接添加。目前, 已有日本鳗鲡(Anguilla japonica)[6]、欧洲鳗鲡(Anguilla anguilla)[7]、澳洲鳗鲡(Auguilla australis)[8]及花鳗鲡(Anguilla marmorata)[9]饲料中适宜脂肪水平的报道。但美洲鳗鲡(Anguilla rostrata)饲料中适宜的鱼油添加水平还未确定, 也未见饲料中适宜脂肪水平的报道。因此, 本试验以我国主要的鳗鲡养殖品种-美洲鳗鲡幼鱼为试验对象, 通过研究饲料中添加不同水平鱼油对其生长性能、体成分及肝脏脂肪代谢酶的影响, 确定适宜的鱼油添加水平, 为鱼油在美洲鳗鲡养殖中的科学应用提供参考。
1. 材料与方法
1.1 试验动物与试验设计
试验用鱼为美洲鳗鲡幼鱼。挑选800尾规格一致、体格健壮, 平均体重为(8.34±0.12) g的试验鱼, 随机分为5个处理组, 分别投喂基础饲料中添加0(对照组)、3%(FO3组)、6%(FO6组)、9%(FO9组)和12%(FO12组)鱼油的试验饲料, 每组4个重复, 每个重复40尾鱼。试验期56d。
1.2 试验饲料与饲养管理
基础饲料为福建正源饲料有限公司生产的黑仔鳗商品饲料, 主要营养成分为粗蛋白47.60%、粗脂肪5.60%、粗灰分12.90%和粗纤维0.40%。鱼油购于福州开发区高龙实业有限公司。试验在福建正源饲料有限公司养殖实验室进行, 1200尾试验鱼随机分到20个PVC养殖缸(注水量为250 L, 每缸60尾)中暂养2周后, 选择出规格接近的800尾用于养殖试验, 每缸放鱼40尾。期间将基础饲料按料水重量比1﹕1.2混合制作成团状饲料投喂。正式试验每次投喂时, 先将粉状商品饲料称重, 再分别与饲料重量0%、3%、6%、9%和12%的鱼油, 及饲料重量1.2倍左右的水一起混合均匀制成团状饲料投喂。每天饱食投喂2次(5: 00和18: 00), 根据鱼体重、摄食情况及时调整投喂量。投喂30min 后, 将残饵吸出, 收集并记录残饵重。在试验期间, 每日检测水质、水温和记录试验鱼的摄食情况等, 保持水温26—28℃, 溶解氧浓度>7.6 mg/L, pH为7.8—8.2, 氨氮浓度<0.25 mg/L。
1.3 样品采集与组织匀浆液的制备
在试验结束后, 美洲鳗鲡幼鱼禁食24h, 将每缸鱼捞出称总重并记录尾数, 用丁香酚和无水乙醇按比例1﹕4配置成50 mg/L的混合液麻醉5min左右, 每缸随机取6尾鱼, 用纱布擦拭鱼体表面水分。在冰浴上用无菌剪刀解剖分别取出肠道和肝脏, 用生理盐水漂洗装入灭菌的冻存管中, 液氮速冻, 保存于‒80℃冰箱。用于测定肠道消化酶和肝脏脂肪代谢酶指标分析。将保存于–80℃冰箱中美洲鳗鲡幼鱼肠道和肝脏取出, 在冰上解冻。按组织重(g)与0.86%生理盐水(mL)体积比1﹕9放入10 mL离心管中, 用组织研磨仪(Tissuelyser-24, 上海净信实业发展有限公司, 中国)在冰浴条件下匀浆(匀浆时间30s/次, 间隙20s, 连续3—5次), 将制备好的组织匀浆用4℃离心机离心(3000 r/min, 10min), 取上清液分装到离心管中备用。每缸另随机取5尾鱼(去除内脏)装入标记分组自封袋中, 置于‒20℃保存, 用于体成分的测定。
1.4 测定指标及方法
生长性能指标 生长性能指标计算公式如下:
增重率 (Weight gain rate, WGR, %)=100%×(Wt–W0)/W0
投饵率 (Feeding rate, FR, %)=100%×FC/[W0+Wt/2]/t
饲料效率 (Feed efficiency, FE, %)=100%×(Wt–W0)/FC
成活率 (Survival rate, SR, %)=100%×Nf/Ni
式中, W0 (g)为平均每尾鱼初始体重; Wt (g)为平均每尾鱼末体重; FC (g)为平均每尾鱼摄食饲料总量(风干样重); t (d)为饲喂天数; Ni为初始鱼尾数; Nf为试验终末鱼尾数。
肠道消化酶活性 肠道蛋白酶、淀粉酶和脂肪酶的活性均使用南京建成生物工程研究所生产的试剂盒进行测定, 操作步骤均按说明书进行。
全鱼体成分 试验鱼全鱼营养成分含量采用AOAC[10]的方法测定, 主要如下: 水分含量测定采用105℃烘干恒重法, 粗蛋白质含量的测定采用全自动定氮仪(Kjeltec8400, FOSS公司), 粗脂肪含量测定采用索氏提取法, 粗灰分含量测定采用550℃马弗炉灼烧法。
肝脏脂肪代谢酶水平或活性 脂肪酸合成酶(Fatty acid synthase, FAS)和乙酰辅酶A羧化酶(Acetyl CoA carboxylase, ACC)采用上海江莱生物科技有限公司生产的试剂盒测定; 脂蛋白酯酶(Lipoprotein lipase, LPL)和肝脏肝脂酶(Hepatic lipase, HL)活性采用南京建成生物工程研究所生产的试剂盒进行测定, 操作步骤均按说明书进行。
1.5 数据统计与分析
试验数据均以平均值±标准差(Mean±SD)表示, 用SPSS 22.0分析软件进行单因素方差分析(One-way ANOVA, LSD), 若存在显著差异, 则采用Duncan法进行多重比较, P<0.05表示差异显著。WGR、FE与饲料鱼油添加水平间的关系采用Linear Regression模块进行二次回归分析, 显著水平为P<0.05。
2. 结果
2.1 饲料中添加不同水平鱼油对美洲鳗鲡幼鱼生长性能的影响
由表 1可知, 饲料中添加鱼油显著影响美洲鳗鲡幼鱼WGR、FR和FE(P<0.05)。随着鱼油添加水平的增加, WGR、FR和FE均呈先上升后下降的趋势, FO6组上述指标数值均为最高。将WGR、FE与饲料中鱼油添加水平进行二次回归分析, 得出最佳WGR、FE时饲料中添加鱼油水平分别为6.78%和6.43%(图 1和图 2), 此时鳗鲡配合饲料中脂肪水平分别为11.59%和11.30%。试验期间, 每组鳗鲡的成活率为100%。
表 1 不同处理组美洲鳗鲡幼鱼生长性能Table 1. Growth performance of juvenile American eels in different treatment groups (mean±SD, n=4)项目Item 组别Group 对照组 FO3组 FO6组 FO9组 FO12组 初始体重IBW (g) 6.97±
0.656.67±
0.326.93±
0.157.03±
0.216.77±
0.40终末体重FBW (g) 10.36±
1.45a10.43±
0.76a15.43±
1.14c12.78±
1.11b11.18±
1.41ab增重率WGR (%) 48.36±
8.22a56.46±
10.14a122.36±
11.48c81.58±
12.35b64.78±
11.60ab投饵率FR (%) 0.77±
0.02a0.83±
0.06ab1.02±
0.11c0.94±
0.06bc0.94±
0.05bc饲料效率FE (%) 50.37±
5.86a53.04±
7.65a74.72±
5.16b61.36±
2.65a52.20±
9.36a成活率SR (%) 100 100 100 100 100 注: 同行数据肩标相同小写字母或无字母表示差异不显著(P>0.05), 不同小写字母表示差异显著(P<0.05)。下同Note: In the same row, vales with the same superscripts or no superscripts mean no significant difference (P>0.05), while vales with different superscripts mean significant difference (P<0.05). The same applies below 2.2 饲料中添加不同鱼油水平对美洲鳗鲡幼鱼肠道消化酶活性的影响
由表 2可知, 饲料中鱼油添加水平对美洲鳗鲡幼鱼肠道蛋白酶、脂肪酶和淀粉酶活性均有显著影响(P<0.05)。饲料中添加鱼油, 可显著降低肠道蛋白酶和淀粉酶活性(P<0.05), 不同鱼油添加组间两种酶活性无显著差异(P>0.05); 可显著提高肠道脂肪酶活性(P<0.05), FO6组、FO9组和FO12组间脂肪酶活性接近(P>0.05)。
表 2 不同处理组美洲鳗鲡幼鱼的肠道消化酶活性Table 2. Intestinal digestive enzyme activities of juvenile American eels in different treatment groups (mean±SD, n=4; U/mg prot)项目Item 组别Group 对照组 FO3组 FO6组 FO9组 FO12组 蛋白酶
Protease72.50±
9.42b48.28±
4.36a46.99±
3.77a41.55±
6.24a40.45±
5.60a脂肪酶
Lipase25.57±
3.80a35.70±
2.30b40.34±
3.21c41.61±
1.37c43.02±
2.33c淀粉酶
Amylase0.82±
0.07b0.56±
0.09a0.55±
0.19a0.40±
0.12a0.38±
0.08a2.3 饲料中添加鱼油水平对美洲鳗鲡幼鱼体成分的影响
由表 3可知, 饲料中添加鱼油显著影响美洲鳗鲡幼鱼全鱼粗蛋白质和粗脂肪含量(P<0.05)。随着饲料中鱼油添加水平的增加, 美洲鳗鲡全鱼粗蛋白质的含量呈逐渐下降趋势, FO12组数值上最低; 全鱼粗脂肪含量呈逐渐上升趋势, FO12组数值上最高。饲料中添加鱼油对全鱼水分和粗灰分的影响不显著(P>0.05)。
表 3 不同处理组美洲鳗鲡幼鱼的体成分Table 3. Body composition of juvenile American eels in different treatment groups (mean±SD, n=4; %)项目
Item组别 Group 对照组 FO3组 FO6组 FO9组 FO12组 水分Moisture 71.42±
0.1971.89±
0.3871.48±
0.3371.25±
0.2971.56±
0.37粗蛋白质Crude protein 17.63±
0.89b17.76±
0.26b16.59±
0.89ab16.53±
0.30ab15.86±
0.66a粗脂肪Crude lipid 6.61±
0.56a6.62±
0.32a8.42±
0.07b8.43±
0.18b8.52±
0.43b灰分Ash 2.78±
0.092.67±
0.102.57±
0.052.56±
0.042.65±
0.042.4 饲料中鱼油添加水平对美洲鳗鲡幼鱼肝脏脂肪代谢酶活性的影响
由表 4可知, 饲料中添加鱼油显著影响美洲鳗鲡幼鱼肝脏FAS、LPL和HL活性(P<0.05)。随着饲料中鱼油添加水平的增加美洲鳗鲡幼鱼肝脏FAS活性呈降低趋势, FO9组和FO12组FAS活性显著降低(P<0.05); LPL和HL活性呈升高趋势, 仅FO12组两种酶活性显著降低(P<0.05)。饲料中添加鱼油对ACC活性无显著影响(P>0.05)。
表 4 不同处理组美洲鳗鲡幼鱼的肝脏脂肪代谢酶水平或活性Table 4. Levels or activities of enzymes related to lipid metabolism in liver of juvenile American eels in different treatment groups (mean±SD, n=4)项目 Item 组别 Group 对照组 FO3组 FO6组 FO9组 FO12组 脂肪酸合成酶
FAS (ng/mg prot)39.42±
0.61b38.80±
0.78b39.77±
0.73b32.42±
0.22a32.26±
0.64a乙酰辅酶A羧化酶
ACC (ng/mg prot)0.27±
0.050.28±
0.020.29±
0.010.28±
0.010.26±
0.03脂蛋白酯酶
LPL (U/mg prot)0.67±
0.11a0.76±
0.10ab0.88±
0.19ab0.91±
0.15ab0.93±
0.18b肝脂酶
HL (U/mg prot)0.72±
0.15a0.74±
0.12a0.89±
0.08ab0.89±
0.09ab1.14±
0.29b3. 讨论
3.1 饲料中鱼油添加水平对美洲鳗鲡幼鱼生长性能的影响
目前还鲜见不同鱼油添加水平对鳗鲡生长性能影响的报道。在本试验中, 适量添加鱼油显著提高美洲鳗鲡幼鱼WGR、FR和FE, 且随饲料中鱼油添加水平增加, WGR、FR和FE呈先升高后下降的趋势。这种适量添加鱼油促进生长, 过量添加鱼油抑制生长的现象在斑石鲷(Oplegnathus punctatus)[11]、黄鳝(Monopterus albus)[12]、半滑舌鳎(Cynoglossus semilaevis)[13]、芙蓉鲤鲫(Furong crucian carp)[14]、斜带石斑鱼(Epinephelus coioides)[15]、异育银鲫(Carassius auratus gibelio)[16]、尼罗罗非鱼(Oreochromis niloticus)[17]和褐菖鲉(Sebastiscus marmoratus) [18]等研究中也有类似的报道。而在花鳗鲡[9]、三倍体虹鳟(Oncorhynchus mykiss)[19]、杂交黄颡鱼(Peltebagrus fulvidraco×P. vachelli)[20]、泰国草鱼(Puntius gonionotus)[21]、黄姑鱼(Nibea albiflora)[22]和大黄鱼(Larimichthys croceus)[23]等研究中, 随着饲料中鱼油添加水平升高, 鱼类生长未出现降低现象。导致这些差异的原因可能与试验鱼类品种、脂肪需要量、鱼油添加水平、鱼油组成、基础饲料脂肪水平、养殖环境等方面的差异有关, 具体情况还有待进一步查明。从上述不同鱼类添加鱼油的研究中可以看出, 饲料中适量添加鱼油大都促进鱼体生长, 可能与饲料中添加的鱼油为鱼类提供充足且高效的能量, 减少蛋白质供能的消耗, 发挥“脂肪节约蛋白质效应”有关[24-26]。
在本试验中, 美洲鳗鲡饲料中鱼油添加水平6.78%和6.43%时, WGR和FE达最高值。此时饲料中脂肪水平为11.59%和11.30%, 这与欧洲鳗鲡适宜脂肪水平为20%[7]、日本鳗鲡适宜脂肪水平为16%[6]和澳洲鳗鲡适宜脂肪水平为15%[8]相比, 美洲鳗鲡幼鱼适宜脂肪水平相对较低; 但高于花鳗鲡的8%适宜脂肪水平[27]。上述研究中不同品种鳗鲡饲料中适宜脂肪水平的变化情况与于海振[28]报道250 g、500 g两个规格不同品种鳗鲡肌肉中粗脂肪含量高低的顺序一致, 从高到低依次为欧洲鳗鲡>日本鳗鲡>美洲鳗鲡>花鳗鲡。可见, 鳗鲡饲料中适宜的脂肪水平与肌肉中粗脂肪含量密切相关。
此外, 与适宜鱼油添加水平组相比, 添加高水平的鱼油(9%和12%)显著抑制美洲鳗鲡生长性能。这种现象在斑石鲷[11]、黄鳝[12]、半滑舌鳎[13]、芙蓉鲤鲫[14]、斜带石斑鱼[15]、异育银鲫[16]、尼罗罗非鱼[17]和褐菖鲉[18]等饲料添加过量鱼油的研究中也有类似报道。研究表明, 鱼类与陆生动物一样为能而食, 其摄食量与饲料能量含量成反比; 当饲料脂肪水平升高时, 饲料的能量含量也相应增加, 鱼类的摄食量则减少, 降低了鱼类肠道对营养素的消化和吸收效率, 尤其是吸收过多的脂肪导致蛋白质利用率下降, 鱼类生长减缓[29]。这也说明鱼类对脂肪的利用有一定限度, 脂肪节约蛋白质的本质仅限于把蛋白质的分解供能降低到最低限度, 而对于蛋白质的其他功能则是脂肪无法替代[29, 30]。
3.2 饲料中鱼油添加水平对美洲鳗鲡幼鱼肠道消化酶活性的影响
在本试验中, 添加鱼油使美洲鳗鲡幼鱼肠道脂肪酶活性显著升高。这与斜带石斑鱼[15]、三倍体虹鳟[19]饲料中添加不同水平的鱼油研究结果一致。随着鱼油添加水平的上升美洲鳗鲡幼鱼肠道脂肪酶活性先升高后趋于相对稳定, 在斜带石斑鱼[15]、褐菖鲉[18]、巴丁鱼(Pangasianodon hypophthalmus)[31]和细鳞鲑 (Brachymystax lenok)[32]等饲料中添加不同水平鱼油后肠道脂肪酶活性也有类似的变化。而三倍体虹鳟随着鱼油添加水平增加肠道脂肪酶活性呈先升高后降低趋势[19]; 吉富罗非鱼饲料中添加过量鱼油水平可显著降低前、中肠脂肪酶活性[33]。本试验中添加较高鱼油水平未观察到美洲鳗鲡幼鱼脂肪酶活性受到明显抑制, 可能与鱼类对鱼油利用的能力、鱼油添加水平和脂肪需求量等方面的差异有关; 添加鱼油使美洲鳗鲡幼鱼肠道蛋白酶和淀粉酶活性降低, 与点篮子鱼(Siganus guttatus)饲料中添加鱼油后降低肠道蛋白酶和淀粉酶研究结果类似[34]; 在幼鱼和成鱼阶段石斑鱼添加9%和12%鱼油后降低肠道淀粉酶也有相同的结果[15]。然而不同鱼油添加水平间美洲鳗鲡幼鱼肠道蛋白酶和淀粉酶活性接近, 类似的结果在黄颡鱼[20]和丝尾鳠(Hemibagrus wyckioides)[35]饲料中添加鱼油研究中出现。这说明在一定鱼油水平基础上继续添加对鱼类肠道蛋白酶和淀粉酶活性影响不大。从添加鱼油对鱼类肠道消化酶影响的变化情况来看, 肉食性鱼类尤其是幼鱼阶段在脂肪源充足时, 优先利用脂肪作为能量来源, 通过提高脂肪酶的活力而增加对脂肪的消化吸收; 减少蛋白质氨基酸及碳水化合物作为能量的消耗, 相应降低肠道蛋白酶和淀粉酶的活性。
3.3 饲料中鱼油添加水平对美洲鳗鲡幼鱼体成分的影响
鱼体组成是反映鱼类生理状态和营养水平的重要指标。饲料中主要营养素水平的变化都会对鱼体组成产生影响。在本试验中, 添加6%、9%和12%鱼油显著提高美洲鳗鲡幼鱼全鱼粗脂肪含量, 而添加3%、6%和9%鱼油对全鱼粗蛋白质含量无显著影响。这些结果与尼罗罗非鱼[17]、泰国草鱼[21]、黄姑鱼[22]和大黄鱼[23]添加鱼油对全鱼体成分影响的报道相似, 说明在饲料中添加一定水平的鱼油可促进全鱼脂肪沉积[36], 而不影响鱼体中蛋白质的沉积。但本试验中仅添加12%的高水平鱼油显著降低美洲鳗鲡幼鱼全鱼粗蛋白含量, 与黑鲷(Acanthopagrus schlegelii)饲料中添加10%鱼油后全鱼粗蛋白含量变化相同[37], 说明添加过高鱼油添加可减少鱼体蛋白质的蓄积。
3.4 饲料中鱼油添加水平对美洲鳗鲡幼鱼肝脏脂肪代谢酶水平或活性的影响
FAS在鱼类肝脏合成脂肪酸的过程中起着重要作用[38], 其水平随着饲料脂肪水平的升高而降低[39]。在本试验中, 添加9%和12%水平的鱼油显著降低美洲鳗鲡幼鱼肝脏FAS水平, 与黑鲷添加10.0%鱼油[37]、道氏虹鳟添加10.95%和14.09%鱼油[40]和尼罗罗非鱼添加3.0%、6.0%、9.0%、12.0%和15.0%鱼油[17]后FAS水平降低的结果一致。研究表明, 鱼油富含EPA和DHA, 属于n-3系列不饱和脂肪酸,是FAS酶及相关基因的抑制剂[39, 41]。在道氏虹鳟添加7.86%、10.95%和14.09%鱼油[39], 斜带石斑鱼添加7.0%、10.5%和14.0%鱼油[42], 及大黄鱼添加12%鱼油也发现肝脏FAS基因表达丰度显著降低[43]。此外, 高水平n-3系列不饱和脂肪酸还可通过降低乙酰辅酶羟化酶和提高激素敏感脂肪酶的活性[44], 降低脂类合成相关基因和蛋白的表达水平[45], 从而抑制脂质合成。
LPL和HL是鱼类肝脏中参与脂肪分解代谢过程中的两个关键酶。LPL主要催化血浆中乳糜颗粒和极低密度酯蛋白, 将甘油三酯分解成脂肪酸和甘油[46]。HL主要参与高密度脂蛋白的重构和乳糜微粒残骸、低密度脂蛋白的代谢以及胆固醇的逆向转运[47]。在本试验中, 仅12%鱼油添加水平显著提高美洲鳗鲡幼鱼肝脏LPL和HL活性, 与道氏虹鳟添加10.95%和14.09%鱼油[40]、许氏平鲉(Sebastes schlegeli)添加9.0%和12.0%鱼油[48]、大菱鲆(Scophthalmus maximu)添加12.94%鱼油[49]、梭鱼(Chelon haematocheilus)添加12%和15%[26]和尼罗罗非鱼添加6.0%、9.0%、12.0%和15.0%[17]鱼油后, 肝脏LPL和HL活性与对照组相比的变化情况类似。而幼鱼和成鱼阶段石斑鱼添加高水平鱼油使这两种酶的活性显著降低[15]; 在尼罗罗非鱼鱼和多鳞鱚(Sillago sihama)等饲料中添加高水平鱼油也发现, LPL和HL活性与适宜鱼油添加水平组相比显著下降[17, 50]。这可能是不同品种鱼类在脂肪利用能力、脂肪需要量、鱼油添加水平和基础饲料脂肪水平等方面差异导致的。但总的来看, 添加一定水平的鱼油可提高肝脏脂肪分解酶的活性, 可能是饲料中添加鱼油使高水平的n-3多不饱和脂肪酸通过激活PPARɑ上调LPL靶基因表达所致[51]。鱼油调节鱼类肝脏HL活性的研究鲜见报道, 具体机制还有待进一步研究。
4. 结论
在本试验条件下, 饲料中适量添加鱼油可提高美洲鳗鲡幼鱼生长性能、肠道脂肪酶活性和全鱼粗脂肪含量, 调节肝脏脂肪代谢酶水平或活性; 美洲鳗鲡幼鱼饲料中适宜的鱼油添加水平推荐为6.43%—6.78%, 此时饲料中脂肪水平为11.30%—11.59%。
-
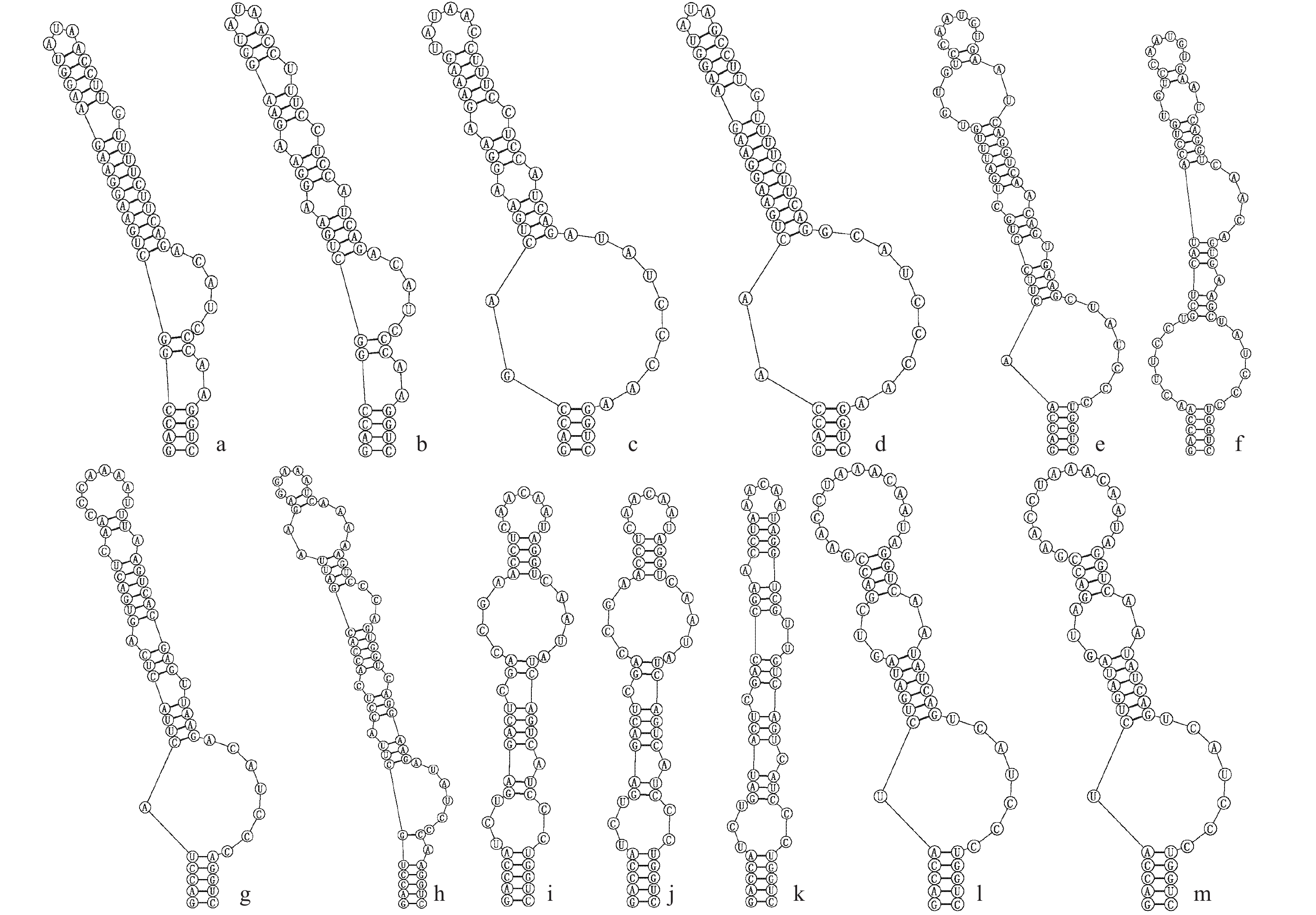
图 3 古尔班通古特沙漠微鞘藻科(Microcoleaceae)藻株的D1-D1’螺旋结构
Figure 3. D1-D1’ helix structure of algae strains of Microcoleaceae in Gurbantunggut Desert
a. Symplocastrum flechtnerii WJT32-NPBGF; b. S. californicum WJT9-NPBG9; c. S. torsivum CPER-KK1; d. S. flechtnerii 46-10B, 55-3-1 and 53-3-4B; e. Microcoleus steenstrupii LSB38; f. M. steenstrupii CXA019 and 136-1-1; g. Microcoleus sp. CXA020; h. Microcoleus sp. CXA013; i. Microcoleus vaginatus CSC-U-KK1; j. M. vaginatus CXA021; k. M. vaginatus CXA023; l. M. vaginatus CXA007; m. M. vaginatus 98-2-3
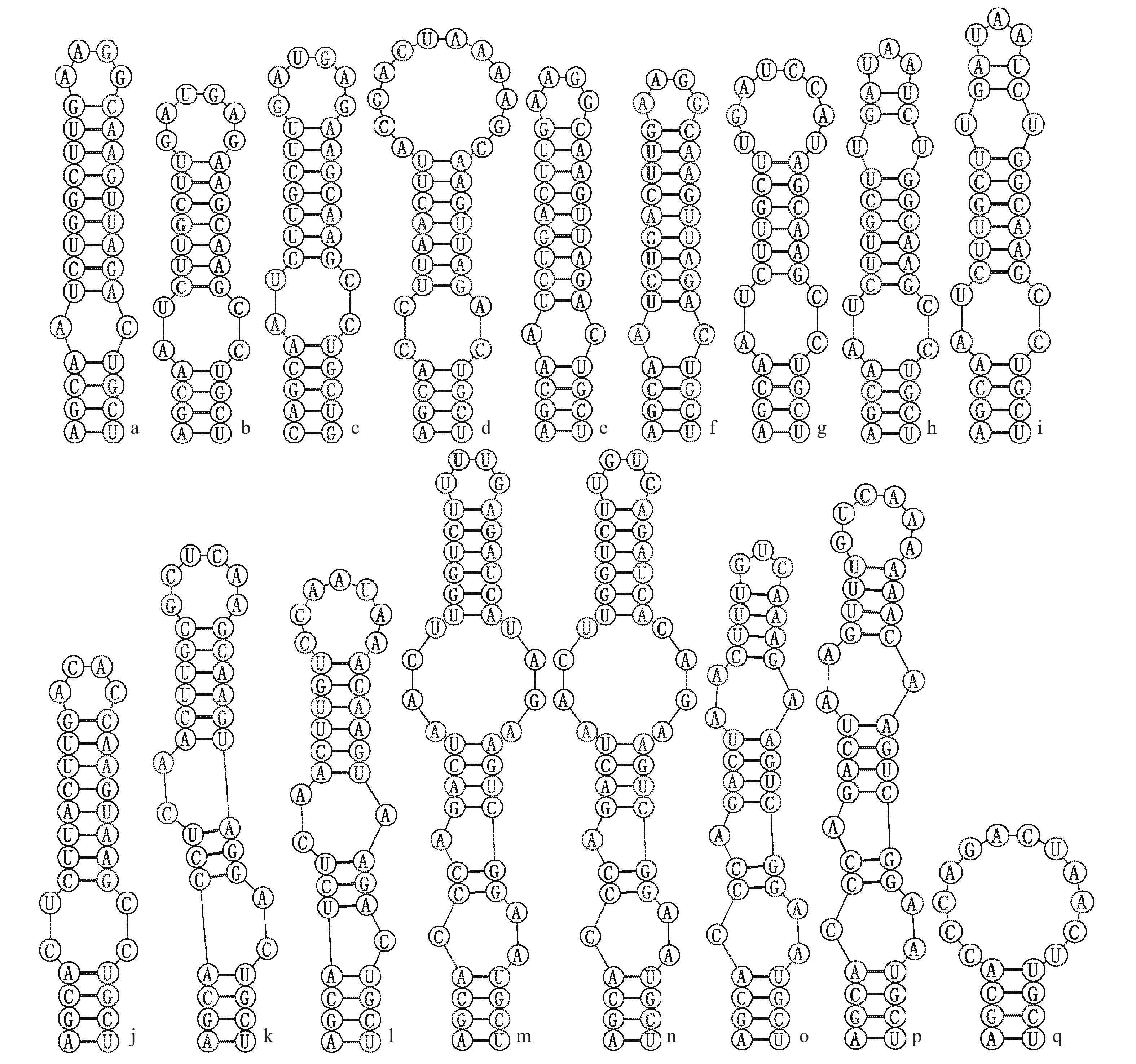
图 4 古尔班通古特沙漠微鞘藻科(Microcoleaceae)藻株的Box-B螺旋结构
Figure 4. Box-B helix structure of algae strains of Microcoleaceae in Gurbantunggut Desert
a. Symplocastrum flechtnerii WJT32-NPBGF; b. S. californicum WJT9-NPBG9; c. S. torsivum CPER-KK1; d. S. flechtnerii 46-10B; e. S. flechtnerii 55-3-1; f. S. flechtnerii 53-3-4B; g. Microcoleus steenstrupii LSB38; h. M. steenstrupii CXA019; i. M. steenstrupii 136-1-1; j. Microcoleus sp. CXA020; k. Pycnacronema arboriculum 41PC; l. Microcoleus sp. CXA013; m. Microcoleus vaginatus SRS1-KK2; n. M. vaginatus 98-2-3; o. M. vaginatus CXA023; p. M. vaginatus CXA021; q. M. vaginatus CXA007
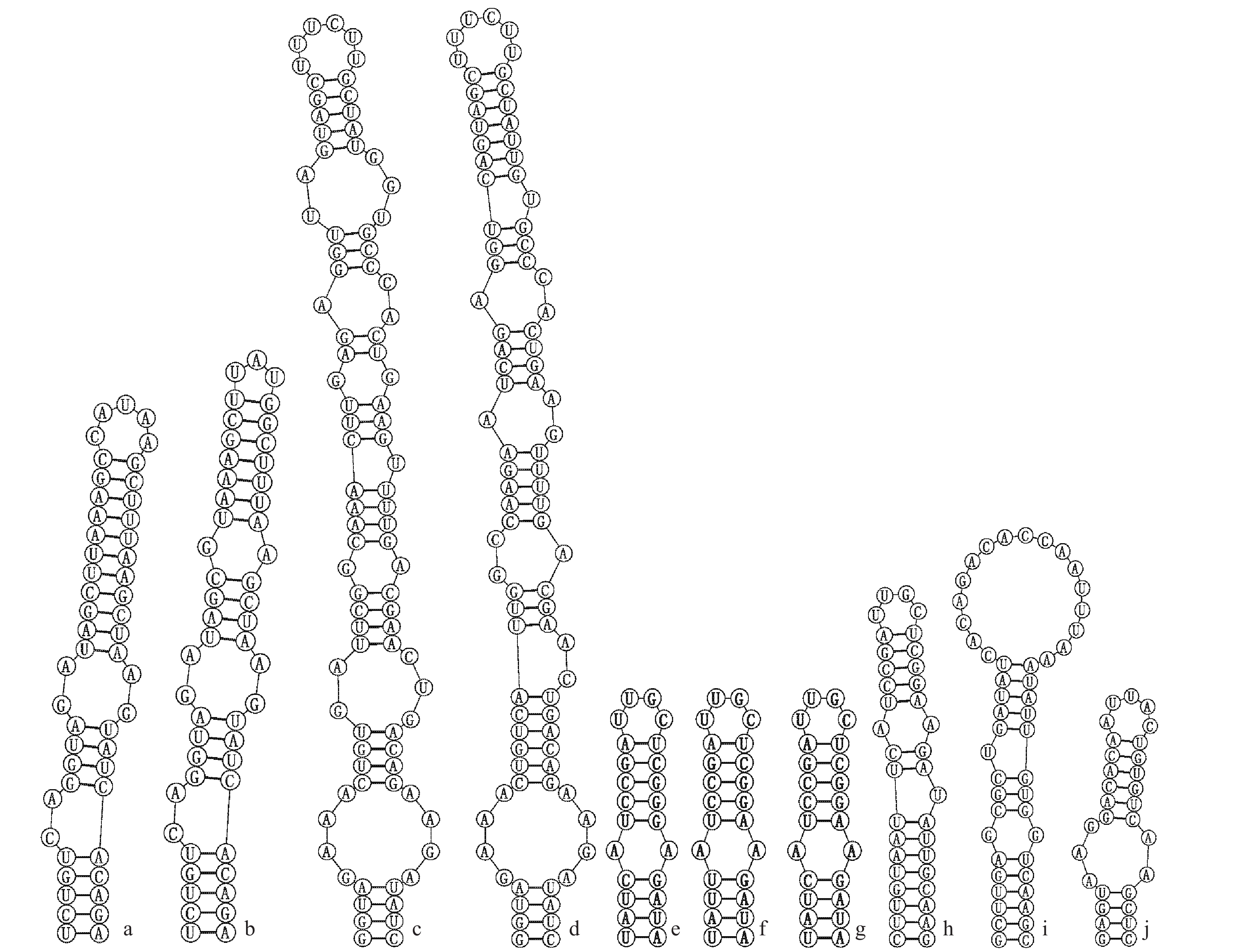
图 5 古尔班通古特沙漠微鞘藻科(Microcoleaceae)藻株的V3螺旋结构
Figure 5. V3 helix structure of algae strains of Microcoleaceae in Gurbantunggut Desert
a. Symplocastrum flechtnerii WJT32-NPBGF; b. S. flechtnerii 46-10B、55-3-1、53-3-4B; c. Microcoleus steenstrupii LSB38; d. M. steenstrupii CXA019 and 136-1-1; e. Microcoleus vaginatus SRS1-KK2; f. M. vaginatus CXA007; g. M. vaginatus CXA023 and 98-2-3; h. M. vaginatus CXA021; i. Microcoleus sp. CXA020; j. Microcoleus sp. CXA013
-
[1] 刘永定, 胡春香, 张文军. 荒漠蓝藻环境生物学与生物土壤结皮固沙 [M]. 北京: 科学出版社, 2013: 1-464. Liu Y D, Hu C X, Zhang W J. Environmental Biology of Desert Cyanobacteria and Sand Fixation of Biological Soil Crusts [M]. Beijing: Science Press, 2013: 1-464.
[2] 胡春香, 刘永定. 宁夏回族自治区沙坡头地区半荒漠土壤中藻类的垂直分布 [J]. 生态学报, 2003, 23(1): 38-44. Hu C X, Liu Y D. Vertical distribution of algae in semi-desert soil of Shapotou area, Ningxia Hui Autonomous Region [J]. Acta Ecologica Sinica, 2003, 23(1): 38-44.
[3] Qian L, Ye X W, Xiao J S, et al. Nitrogen concentration acting as an environmental signal regulates cyanobacterial EPS excretion [J]. Chemosphere, 2021(291): 132878.
[4] Zhang Y M. The microstructure and formation of biological soil crusts in their early developmental stage [J]. Chinese Science Bulletin, 2005, 50(2): 117-121.
[5] Zhang B C, Zhang Y M, Zhao J C, et al. Microalgal species variation at different successional stages in biological soil crusts of the Gurbantunggut Desert, Northwestern China [J]. Biology and Fertility of Soils, 2009, 45(5): 539-547. doi: 10.1007/s00374-009-0364-0
[6] 胡春香, 刘永定, 宋立荣. 宁夏沙坡头地区藻类及其分布 [J]. 水生生物学报, 1999, 23(5): 443-448. Hu C X, Liu Y D, Song L R. Species composition and distribution of algae in Shapotou area, Ningxia Hui Autonomous Region, China [J]. Acta Hydrobiologica Sinica, 1999, 23(5): 443-448.
[7] 张丙昌, 张元明, 赵建成, 等. 古尔班通古特沙漠生物结皮不同发育阶段中藻类的变化 [J]. 生态学报, 2009, 29(1): 9-17. doi: 10.3321/j.issn:1000-0933.2009.01.002 Zhang B C, Zhang Y M, Zhao J C, et al. Variation in algal composition among cifferent developmental stages of biological soil crusts in Gurbantunggut Desert [J]. Acta Ecologica Sinica, 2009, 29(1): 9-17. doi: 10.3321/j.issn:1000-0933.2009.01.002
[8] Dvořák P, Hašler P, Poulíčková A. Phylogeography of the Microcoleus vaginatus (cyanobacteria) from three continents–A spatial and temporal characterization [J]. PLoS One, 2012, 7(6): e40153. doi: 10.1371/journal.pone.0040153
[9] Boyer S L, Johansen J R, Flechtner V R, et al. Phylogeny and genetic variance in terrestrial Microcoleus (Cyanophyceae) species based on sequence analysis of the 16S rRNA gene and associated 16S-23S ITS region [J]. Journal of Phycology, 2002, 38(6): 1222-1235. doi: 10.1046/j.1529-8817.2002.01168.x
[10] 胡鸿钧, 李尧英, 魏印心, 等. 中国淡水藻类 [M]. 上海: 上海科学技术出版社, 1980: 57-69. Hu H J, Li Y Y, Wei Y X, et al. Freshwater Algae in China [M]. Shanghai: Shanghai Science and Technology Press, 1980: 57-69.
[11] Komárek J, Anagnostidis K. Cyanoprokaryota 2 Teil: Oscillatoriales [C]//Büdel B, Gärtner G, Krienitz L, et al. (Eds.), Süßwasserflora von Mitteleuropa, vol. 19/2. München: Elsevier, 2005: 1-759.
[12] Anagnostidis K, Komárek J. Modern approach to the classification system of cyanophytes. 3. Oscillatoriales [J]. Archiv für Hydrobiologie,Supplement, 1988(50): 327-472.
[13] 胡鸿钧, 魏印心. 中国淡水藻类-系统、分类及生态 [M]. 北京: 科学出版社, 2006: 104-146. Hu H J, Wei Y X. The Freshwater Algae of China-Systematics, Taxonomy and Ecology [M]. Beijing: Science Press, 2006: 104-146.
[14] Strunecký O, Komárek J, Johansen J R, et al. Molecular and morphological criteria for revision of the genus Microcoleus (Oscillatoriales, Cyanobacteria) [J]. Journal of Phycology, 2013, 49(6): 1167-1180. doi: 10.1111/jpy.12128
[15] Strunecký O, Komárek J, Šmarda J. Kamptonema (Microcoleaceae, Cyanobacteria), a new genus derived from the polyphyletic Phormidium on the basis of combined molecular and cytomorphological markers [J]. Preslia, 2014, 86(2): 193-208.
[16] Geng R Z, Li W K, Chao A M, et al. Establishment of a new filamentous cyanobacterial genus, Microcoleusiopsis gen. nov. (Microcoleaceae, Cyanobacteria), from Benthic Mats in Open Channel, Jiangxi Province, China [J]. Diversity, 2021, 13(11): 548. doi: 10.3390/d13110548
[17] Siegesmund M A, Johansen J R, Karsten U, et al. Coleofasciculus gen. nov. (cyanobacteria): morphological and molecular criteria for revision of the genus Microcoleus Gomont [J]. Journal of Phycology, 2008, 44(6): 1572-1585. doi: 10.1111/j.1529-8817.2008.00604.x
[18] 朱浩然. 中国淡水藻志 第九卷, 蓝藻门 藻殖段纲 [M]. 北京: 科学出版社, 2007: 72-145. Zhu H R. Flora Algarum Sinicarum Aquae Dulcis Tomus IX, Cyanophyta Hormogonophyceae [M]. Beijing: Science Press, 2007: 72-145.
[19] Casamatta D A, Johansen J R, Vis M L, et al. Molecular and morphological characterization of ten polar and near-polar strains within the Oscillatoriales (cyanobacteria) [J]. Journal of Phycology, 2005, 41(2): 421-438. doi: 10.1111/j.1529-8817.2005.04062.x
[20] Johansen J R, Kovacik L, Casamatta D A, et al. Utility of 16S-23S ITS sequence and secondary structure for recognition of intrageneric and intergeneric limits within cyanobacterial taxa: Leptolyngbya corticola sp. nov. (Pseudanabaenaceae, Cyanobacteria) [J]. Nova Hedwigia, 2011, 92(3/4): 283-302.
[21] Hall T. BioEdit: An Important Software for Molecular Biology [J]. GERF Bulletin of Bioscience, 2011, 2(1): 60-61.
[22] Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular Evolutionary Genetics Analisis (MEGA) software version 4.0 [J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. doi: 10.1093/molbev/msm092
[23] Mathews Lab. RNAstructure Version 5.6. Available online:http://rna.urmc.rochester.edu/RNAstructure.html (accessed on 13 May 2021).
[24] Pietrasiak N, Mühlsteinová R, Siegesmund M A, et al. Phylogenetic placement of Symplocastrum (Phormidiaceae, Cyanophyceae) with a new combination S. californicum and two new species: S. flechtnerae and S. torsivum [J]. Phycologia, 2014, 53(6): 529-541. doi: 10.2216/14-029.1
[25] Petersen J B. The fresh-water cyanophyceae of Iceland [J]. The Botany of Iceland, 1923(2): 1-324.
[26] Gomont M. Monographie des Oscillariées (Nostocacées homocystées) [J]. Annales des Science Naturelles, Botanique, Série 7, 1892(16): 91-264.
[27] Fernandes V M C, Giraldo-Silva A, Roush D, et al. Coleofasciculaceae, a monophyletic home for the Microcoleus steenstrupii complex and other desiccation-tolerant filamentous cyanobacteria [J]. Journal of Phycology, 2021, 57(5): 1563-1579. doi: 10.1111/jpy.13199
[28] Sorokovikova E, Belykh O, Krasnopeev A, et al. First data on cyanobacterial biodiversity in benthic biofilms during mass mortality of endemic sponges in Lake Baikal [J]. Journal of Great Lakes Research, 2020, 46(1): 75-84. doi: 10.1016/j.jglr.2019.10.017
[29] Garcia-Pichel F, Loza V, Marusenko Y, et al. Temperature drives the continental-scale distribution of key microbes in topsoil communities [J]. Science, 2013, 340(6140): 1574-1577. doi: 10.1126/science.1236404
-
期刊类型引用(2)
1. 王裕玉,贾晶,李媛媛,张新明. 淡水鳗鲡营养需求和配合饲料研究进展. 动物营养学报. 2024(05): 2728-2742 .  百度学术
百度学术
2. 徐心雨,武之绚,鲍梦圆,王海歌,牛化欣,常杰. 胆碱的生理功能及其对鱼脂肪代谢的调控机制. 饲料研究. 2023(06): 137-141 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: