ESTABLISHMENT OF A PREADIPOCYTE CELL LINE OF SPOTTED SEA BASS (LATEOLABRAX MACULATUS) AND OLEIC ACID-INDUCED DIFFERENTIATION
-
摘要:
花鲈(Lateolabrax maculatus)前脂肪细胞系为探索鱼类脂肪细胞分化和脂肪沉积的调控作用及相关分子机制提供了一种新的体外模型。研究将花鲈腹腔脂肪组织用胶原酶消化后原代培养, 再以胰酶消化后传代, 总共经过150次传代培养后, 得到花鲈前脂肪细胞系。进而, 染色体核型分析表明该细胞系长期培养仍能保持正常表型, 进一步使用线粒体cox1和cytb基因鉴定该细胞系来源于花鲈。用pEGFP-C1质粒转染细胞系, 观察到明显的绿色荧光, 表明可用于研究外源基因的表达。用不同浓度的油酸培养细胞系, 3d后细胞有明显脂滴聚集, 7d后脂滴达到最大; 油红O染色表明, 400 μmol/L油酸诱导7d后细胞即可正常分化成熟。综上所述, 实验建立了花鲈前脂肪细胞系, 该细胞系形态典型、可正常分化, 为后续研究鱼类脂肪细胞分化及脂肪沉积提供了良好的实验材料。
Abstract:The proadipocyte line of spotted sea bass (Lateolabrax maculatus) provides a new in vitro model for exploring the regulation of adipocyte differentiation and adipocyte deposition in fish and the related molecular mechanisms. This experiment aimed to establish a proadipose cell line for the spotted sea bass. Peritoneal adipose tissue was digested using collagenase and pancreatic enzyme, and after multiple passages, a preadipose cell line was successfully obtained following 150 times of culture cycles. karyotype analysis showed confirmed the maintenance of a normal phenotype in the cell line during long-term culture. Additionally, the mitochondrial cox1 and cytb genes were further used to identify the cell line as originating from the spotted seabass. The established cell lines were subjected to transfection with the pEGFP-C1 plasmid, resulting in observable green fluorescence, indicating their suitability for studying the expression of foreign genes. Furthermore, when cultured with different concentrations of oleic acid, the cell lines exhibited prominent lipid droplet aggregation after 3d, reaching its maximum accumulation after 7d. Oil red O staining demonstrated that the cells could differentiate and mature normally after 7d of induction with 400 μmol/L oleic acid. In summary, this experiment successfully established a preadipose cell line for the spotted sea bass, characterized by typical morphology and normal differentiation. This cell line serves as valuable experimental material for future studies on adipose cell differentiation and adipose deposition in fish.
-
Keywords:
- Preadipocyte /
- Cell line /
- Cell culture /
- Induction differentiation /
- Lateolabrax maculatus
-
在集约化养殖过程中, 鱼类普遍存在腹腔脂肪过度蓄积的问题[1]。脂肪过度蓄积不仅会导致养殖出“大肚子”鱼而降低经济价值, 还容易导致代谢紊乱、炎症, 抗逆抗病能力降低, 严重影响鱼类养殖的可持续性发展[2]。为缓解养殖鱼类的脂肪过度蓄积, 解析鱼类脂肪沉积的机制一直是研究热点。从细胞层面看, 脂肪蓄积的根本是前脂肪细胞的增殖、分化和成熟[3]。前脂肪细胞系是研究脂肪细胞增殖、分化的良好模型, 对于研究脂肪细胞增殖与分化过程的基因表达机制具有重要作用[4]。
目前, 鱼类上大约有300个细胞系[5], 为鱼类的发育、代谢与病害的研究带来了极大的便利, 但鱼类前脂肪细胞系的研究极少。在哺乳动物, 国内外已成功构建了人[6]、大鼠[7]和猪[8]等的前体脂肪细胞系, 它们在研究哺乳动物脂肪细胞增殖分化和代谢发挥了重要作用, 而鱼类前脂肪细胞系的相关研究则远远落后。
本实验以花鲈(Lateolabrax maculatus)腹腔脂肪为材料, 通过原代和传代培养, 建立花鲈前脂肪细胞系并进行油酸诱导分化, 以期为研究鱼类脂肪细胞分化及脂肪沉积提供实验材料。
1. 材料与方法
1.1 原代培养与传代
原代培养 挑选体重500 g的健康花鲈, 以MS-222麻醉后用75%的酒精进行体表消毒。使用灭菌手术刀解剖鱼体后, 刮取腹腔脂肪组织放入预冷的无血清培养基(DMEM/F12)中。在超净台中弃培养基, 加入PBS缓冲液充分混匀清洗后, 加入等体积的Ⅰ型胶原酶溶液, 剪碎脂肪组织使其充分消化20min。然后, 对悬液离心(300×g, 10min)后留沉淀, 加入1 mL红细胞裂解液裂解红细胞1min, 后再加入1 mL培养基终止裂解。用滤网(100 μm)过滤后离心(300×g, 8min), 留沉淀并加入2 mL无血清培养基重悬, 离心后加入生长培养基(20%胎牛血清(Gbico, 美国)+1%青-链霉素双抗溶液+DMEM/F12培养基)并重悬, 转移分装到细胞培养瓶(T25)中, 并置于28℃, 5%CO2浓度的培养箱中培养。每24h更换1次培养基, 至形成单层细胞后进行传代培养。
传代培养 弃去旧培养液后加入PBS缓冲液冲洗细胞, 后加入0.5—1 mL含有0.25%胰蛋白酶-EDTA溶液消化, 待大部分细胞变圆后轻拍培养瓶使细胞脱落, 加入生长培养基后按1﹕2的比例传代细胞。传代150次后, 得到前脂肪细胞系。
1.2 细胞系的冻存与复苏
用DMEM/F12培养基、FBS和二甲基亚砜, 按照7﹕2﹕1比例配制细胞冻存液, 置于4℃备用。当前脂肪细胞生长至汇合度为80%—90%时, 弃旧培养液, PBS冲洗细胞后加入胰酶消化, 显微镜下观察细胞整体变圆后可轻拍培养瓶使细胞脱落, 加入等体积的培养基终止消化后离心(1500 r/min, 10min)。留沉淀并加入1 mL细胞冻存液, 重悬后转移到细胞冻存管中, 于梯度降温盒中置于–80℃冰箱中, 过夜后转移到液氮长期保存。
复苏时将冻存管从液氮中取出, 于37℃水浴条件下快速解冻2—3min, 当大部分细胞解冻后即离心(1500 r/min, 3min), 留沉淀后加入培养基, 将细胞重悬后接种到细胞培养瓶(T25)培养。
为验证细胞冻存复苏后对细胞活力的影响, 从液氮中取出已冻存1、3和6个月的细胞系进行复苏, 使用台盼蓝染色计算细胞成活率, 并观察培养24h后的细胞状态。
1.3 不同培养条件下的细胞生长特性
为了探究细胞生长的最佳条件, 将原代细胞传至第5代后, 使用4种培养基DMEM/F12、DMEM高糖、L15和M199培养细胞, 并设置0、5%、15%和20%四个血清浓度。培养过程中每隔24h后用胰蛋白酶消化后使用细胞自动计数仪进行计数, 整个实验持续计数6d。以每天每孔平均细胞数为纵坐标, 以培养时间为横坐标, 绘制原代前脂肪细胞在不同条件下的生长曲线。根据公式计算细胞倍增时间: T=Δt/log2(ΔN/N0+1), 式中, Δt为培养时间长度, ΔN为培养时间增加的细胞量, N0为初始细胞量[9]。
1.4 染色体染色
使用第115代的前脂肪细胞用于染色体分析。将消化后的前脂肪细胞接种到细胞培养瓶(T75)中, 25℃中生长24h后更换10 mL新鲜培养基, 并向培养瓶中加入1 μg/mL的秋水仙素10 μL。继续培养12—15h后胰蛋白酶消化离心(1200 r/min, 10min)收获沉淀细胞, 然后加入0.075 mol/L KCl溶液5 mL处理30min, 然后加入2 mL预冷的卡诺氏固定液预固定5min, 1500 r/min离心10min留沉淀, 再加入5 mL卡诺氏固定液固定10min。以上过程重复3次, 加入300—500 μL的卡诺固定液重悬细胞, 然后使用冷滴法将细胞悬液从30 cm以上的高度滴到冷冻后的载玻片上, 制备用于染色体分析的涂片。待载玻片自然风干后用10%吉姆萨溶液染色30min, 蒸馏水冲洗后室温风干, 于滴片中央加入少量的中性树脂后封片, 待凝固后于显微镜下观察细胞的染色体形态。
1.5 细胞鉴定
通过线粒体细胞色素c氧化酶亚基Ⅰ基因(cox1)和线粒体细胞色素b (Cytb)基因鉴定该细胞系来源。首先, 提取细胞样品DNA, 设计cox1[10]和cytb[11]基因的扩增引物: cox1-F: ATATAGCGTTCCCTCGAATG; cox1-R: AAAAGGATTACCGCTACCAG; cytb-F: ATGGCAAGCCTTCGAAAAAC; cytb-R: ATGCCTCCGATTCAGGTGAG。按照以下体系和程序进行PCR扩增: PCR反应体系为20 μL, 其中ExTaq酶0.2 μL, 10×ExTaq Buffer 2 μL, dNTP Mix 1.6 μL, 引物1.6 μL, DNA 0.6 μL, 去离子水14 μL; 反应程序: 95℃ 5min; 95℃ 30s, 52℃ 30s, 72℃ 60s, 30个循环; 72℃ 7min。然后, 琼脂糖凝胶电泳检测后, 将扩增产物送至上海生工生物工程技术有限公司进行测序。测序后与已知花鲈序列对比分析。
1.6 细胞转染
使用表达增强型绿色荧光蛋白pEGFP-C1质粒, 检测细胞系的转染能力。将细胞以3×105 cells/well的密度接种到六孔细胞培养板中, 待细胞生长达到70%—80%汇合度更换新鲜培养基。使用脂质体lipo8000 (Beyotime)配制脂质体-质粒混合液, 并加入到培养基中孵育48h, 观察绿色荧光强度。
1.7 油酸诱导细胞分化
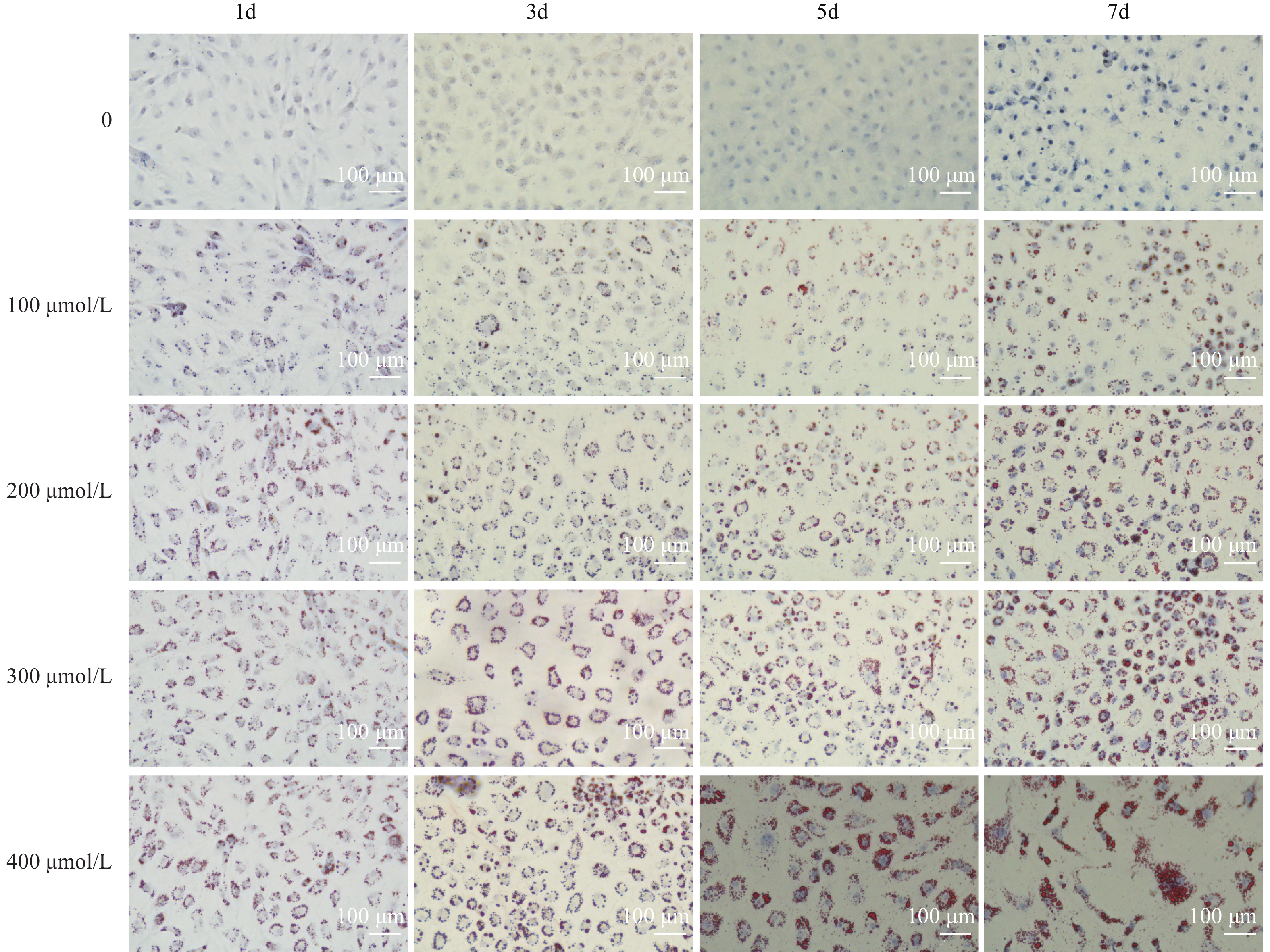
将消化后的细胞按照3×105 Cells/well的密度接种到六孔细胞培养板中, 待其长至80%—90%汇合度时, 弃去旧培养基, 添加含有0、100、200、300和400 μmol/L油酸(Sigma, 美国, 纯度>99%)的生长培养基进行处理, 每组3个重复, 分别在1d、3d、5d和7d进行油红染色, 细胞的生长状态和染色结果使用倒置显微镜进行观察。
1.8 荧光定量PCR
经400 μmol/L油酸处理后0、1d、3d、5d和7d的前脂肪细胞用胰酶消化离心收集后按照TRIzol试剂上的说明提取细胞总RNA, 然后用1.5%琼脂糖凝胶电泳和分光光度计检测RNA的质量和浓度。使用试剂盒(R211-01,Vazyme)进行逆转录合成cDNA, 使用SYBR®预混试剂(Q711-02, Vazyme)于荧光定量PCR仪(QuantStudio™ 6 Flex, Applied Biosystems)进行实时荧光定量PCR, 机器的程序设定参考 Vazyme的说明书。基因的相对表达量采用2−ΔΔCt法计算, 以β-actin作为内参基因(表 1)。
表 1 实时荧光定量PCR引物序列Table 1. Primers sequence of Real-time fluorescent quantitative PCR基因
Gene引物Primer (5′—3′) 退火温度
Tm (℃)ppar-γ ACGCCGTGGACCTGTCAGAG
CGTGATGGAGGAGGAGGAGATGG60 c/ebp α AAGATGCGCAACATGGAGAC
TCTGAAGATGCCCCGTAACG60 pgc-1α GTTCCTCCGAACTCCCAGTG
GCAACACCCCTCCAACTACA60 pgc-1β GTTCCTCCGAACTCCCAGTG
GCAACACCCCTCCAACTACA60 tfam GGTCAGACATTTCACTGGGTTG
GCGGCTCTAATGCGTGAAT60 cpt-1 CCTCAATGATACATCGGAACCC
CTGCGGCTCATCATCTAACG60 atgl CTTCCTCTCCGCAACAAGTC
TGGTGCTGTCTGGAGTGTTC60 hsl CGAAACACAGAGACGGTCCA
TCATGACATCTACCAGCCGC60 fas AAACTGAAGCCCTGTGTGCC
CACCCTGCCTATTACATTGCTC60 β-actin CAACTGGGATGACATGGAGAAG
TTGGCTTTGGGGTTCAGG60 1.9 数据分析
实验数据使用统计程序SPSS 23.0, 方法使用单因素方差分析和Duncan’s多重比较来检验均值差异, 数据结果均以平均值±标准差的方式呈现, 显著性水平为0.05。
2. 结果
2.1 原代与传代细胞的形态
原代培养中胶原酶消化接种后24h即可观察到大部分细胞贴壁, 2d后细胞即可长至80%—90%汇合度。传代过程中每天观察细胞生长状况, 细胞在传代后生长稳定, 形态保持纤维状(图 1A—E), 现已传至150代以上, 传代时间超过300d, 传代细胞冻存1、3和6个月, 复苏培养24h后细胞均能正常生长增殖, 复苏后的细胞仍呈现典型形态(图 1F—I)。
![]() 图 1 花鲈前脂肪细胞系的表观形态A. 第0代培养24h的原代细胞; B—E. 是培养24h后的第1、10、50和100代的细胞; F. 冻存前第54代细胞; G—I. 冻存1、3和6个月后复苏培养24h的细胞Figure 1. The apparent morphology of proadipose cell line of the spotted sea bassA. Primary cells cultured for 24h in the 0 generation; B—E. is the 1st, 10th, 50th, and 100th generation of cells cultured for 24h; F. Cryopreservation of pre-54th generation cells; G—I. Cells frozen 1, 3, and 6 months later are resuscitated and cultured for 24h
图 1 花鲈前脂肪细胞系的表观形态A. 第0代培养24h的原代细胞; B—E. 是培养24h后的第1、10、50和100代的细胞; F. 冻存前第54代细胞; G—I. 冻存1、3和6个月后复苏培养24h的细胞Figure 1. The apparent morphology of proadipose cell line of the spotted sea bassA. Primary cells cultured for 24h in the 0 generation; B—E. is the 1st, 10th, 50th, and 100th generation of cells cultured for 24h; F. Cryopreservation of pre-54th generation cells; G—I. Cells frozen 1, 3, and 6 months later are resuscitated and cultured for 24h2.2 细胞冻存复苏检测
如表 2所示, 冻存1、3和6个月的第54代细胞, 复苏培养后的细胞成活率均大于90%, 冻存6个月后的复苏存活率与3个月存活率差异不显著(P>0.05), 表明该细胞系在长期液氮保存条件下仍具有较高活力。
表 2 细胞冻存后复苏存活率Table 2. Cell resuscitation rate after cryopreservation冻存时间(月)
Freezing time (month)细胞存活率
Cell viability (%)1 96.33±0.88a 3 95.00±2.08a 6 92.00±1.73a 注: 同列数据肩标不同小写字母表示差异显著(P<0.05), 下同Note: In the same column, values with different small letter superscripts mean significant difference (P<0.05), the same applies below 2.3 不同培养条件下的细胞生长特性
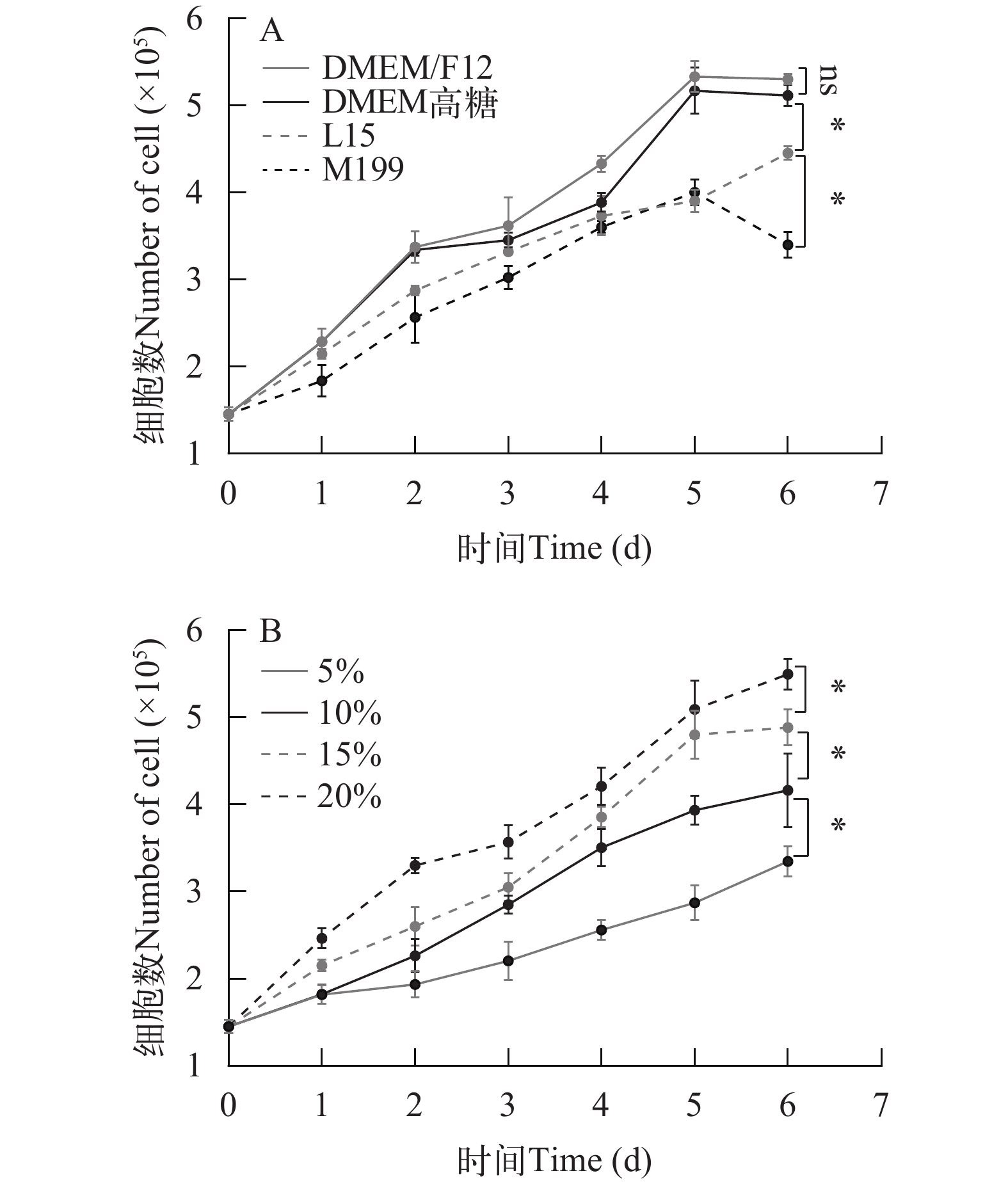
为了探究细胞生长的最佳条件, 使用4种培养基DMEM/F12、DMEM高糖、L15和M199培养细胞。如图 2A所示, 在细胞培养6d后, DMEM/F12培养基中细胞数量显著高于M199和L15培养基组(P<0.05), 而M199培养基中的细胞数量显著低于其他组(P<0.05)。在此基础上, 研究了0、5%、15%和20%血清浓度对细胞生长的影响, 如图 2B所示: 培养6d后, 20%血清浓度下细胞数量显著高于其他组(P<0.05)。
如表 3所示, DMEM/F12培养基细胞倍增时间最短, 为77h, 而在M199培养基中倍增时间最长, 为117h。因此, DMEM/F12培养基适合用来培养花鲈前脂肪细胞, 据表 4所示细胞数量倍增时间, 血清浓度为20%较为适宜。
表 3 不同培养基条件下原代细胞的倍增时间Table 3. Multiplication time of primary cells under different medium conditions培养基
Medium细胞密度Cell density (×105 cell/well) 培养时间Δt
Cultivation time (h)倍增时间T2
Doubling time (h)起始数 N0
Starting number最终数
Final number增长数ΔN
Growth numberDMEM/F12 1.45 5.30±0.04c 3.85±0.04c 144 77.01±0.40a DMEM高糖 1.45 5.11±0.07c 3.66±0.07c 79.23±0.88a L15 1.45 4.45±0.05b 3.00±0.05b 89.03±0.79b M199 1.45 3.40±0.09a 1.95±0.09a 117.57±3.63c 表 4 不同血清浓度条件下原代细胞的倍增时间Table 4. Multiplication time of primary cells under different serum concentrations血清浓度
Serum concentration细胞密度Cell density (×105 cell/well) 培养时间Δt
Cultivation time (h)倍增时间T2
Doubling time (h)起始数 N0
Starting number最终数
Final number增长数ΔN
Growth number5 1.45 3.35±0.10a 1.90±0.10a 144 119.63±4.31c 10 1.45 4.16±0.24b 2.71±0.24b 95.49±5.08b 15 1.45 4.89±0.12c 3.44±0.12c 82.26±1.64a 20 1.45 5.50±0.10d 4.05±0.10c 74.95±1.02a 2.4 细胞核型分析
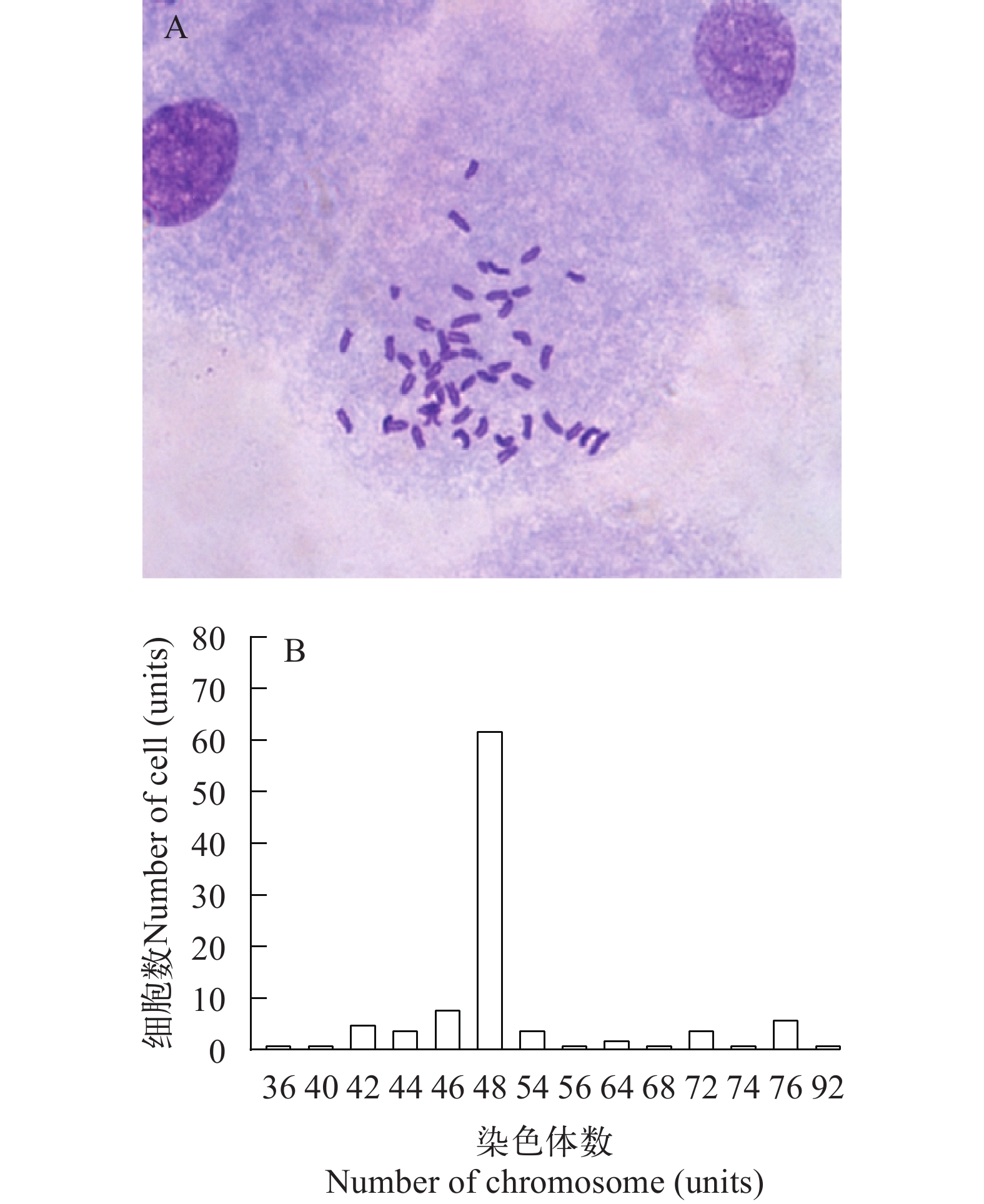
为了检查该细胞系在长期传代培养过程中是否自发转化及确定细胞来源, 通过选取100张第115代细胞分裂中期染色体照片进行计数分析, 其形态如图 3A所示, 统计得到染色体数目最少为36个, 最多为92个, 62%的细胞保持了48条染色体的二倍体核型(图 3B), 与正常花鲈染色体数目一致。
2.5 细胞鉴定
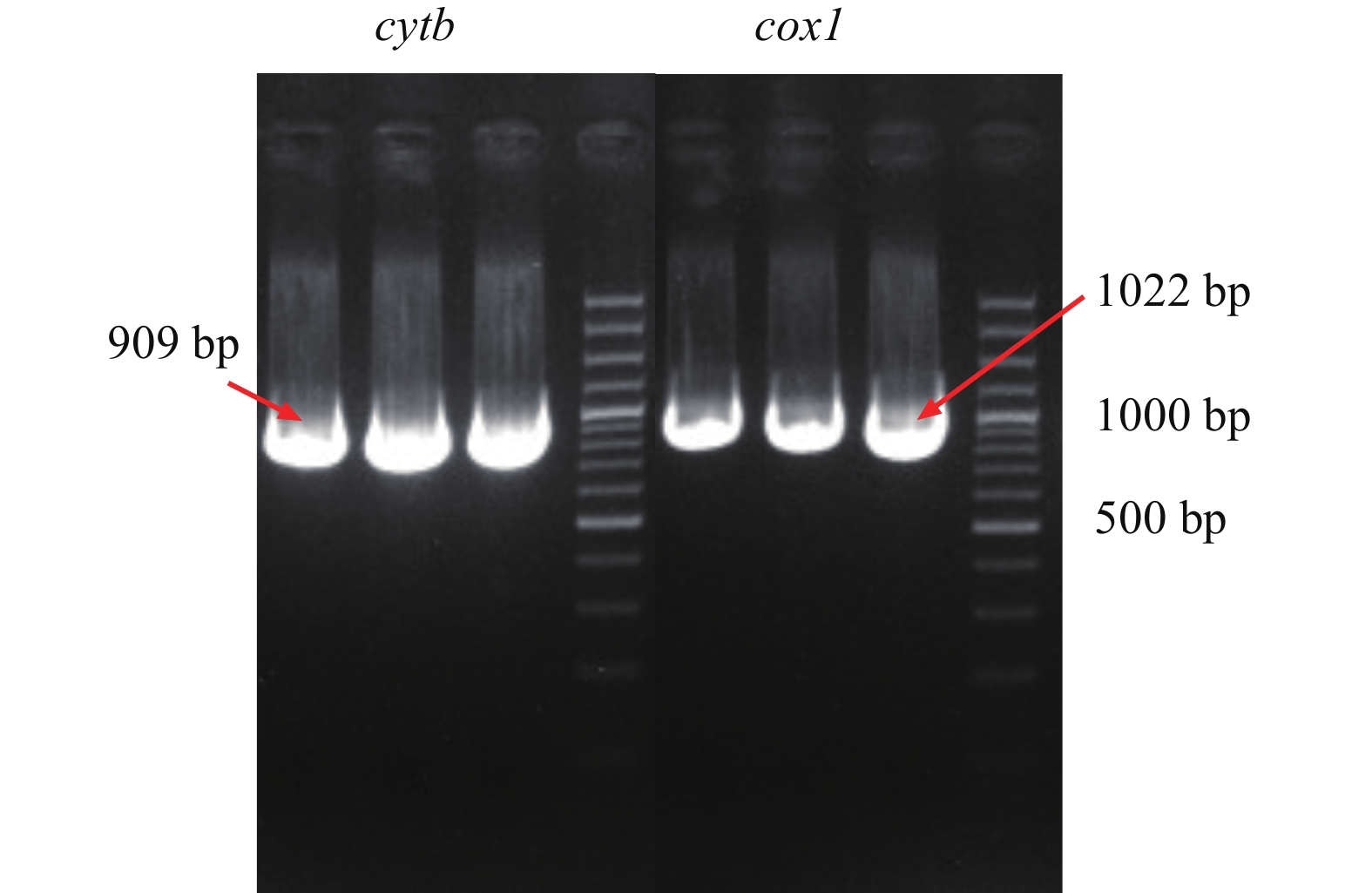
如图 4所示, 从细胞中扩增的cox1和cytb基因的目的片段, 大小为分别为1022和909 bp。通过测序结果与NCBI中花鲈的cox1和cytb序列对比, 发现一致性分别为99.90%和99.78%。
2.6 细胞转染
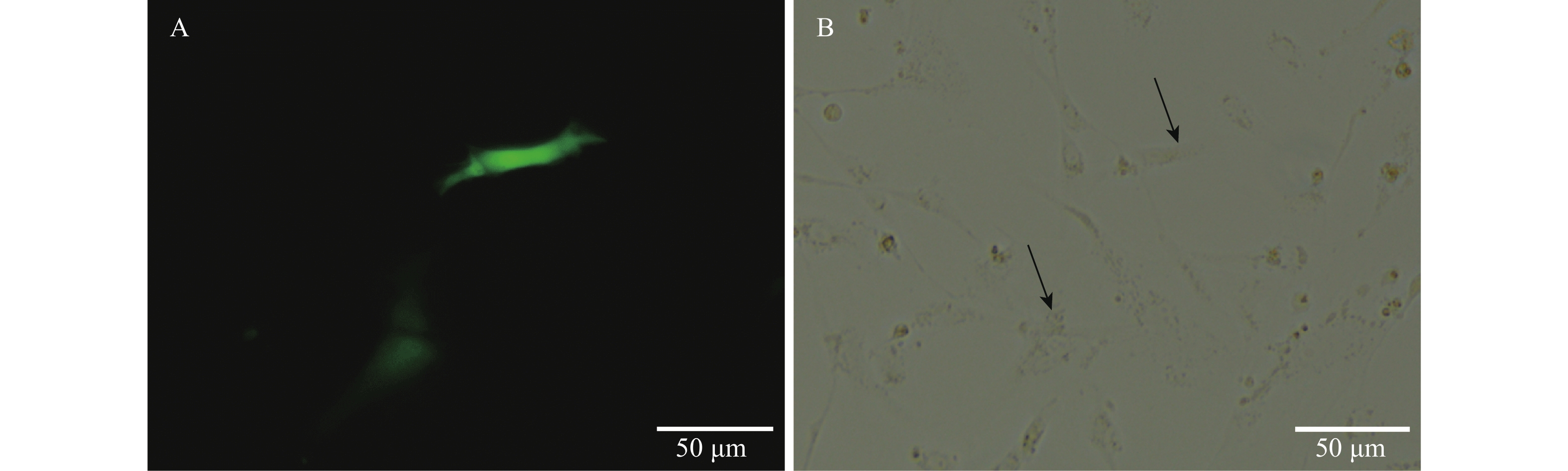
通过脂质体lipo8000成功将pEGFP-C1质粒转入脂肪细胞中, 转染48h后在细胞中观察到清晰的绿色荧光(图 5)。
![]() 图 5 pEGFP-C1质粒转染后48h的荧光蛋白表达A. 荧光下观察, 绿色代表荧光蛋白表达; B. 明场观察, 黑色箭头表示发出绿色荧光的细胞位置Figure 5. Expression of fluorescent protein 48h after transfection with pEGFP-C1 plasmidA. Fluorescent observation, green represents the expression of fluorescent protein; B. Bright field observation, red arrow indicates the location of the cell emitting green fluorescence
图 5 pEGFP-C1质粒转染后48h的荧光蛋白表达A. 荧光下观察, 绿色代表荧光蛋白表达; B. 明场观察, 黑色箭头表示发出绿色荧光的细胞位置Figure 5. Expression of fluorescent protein 48h after transfection with pEGFP-C1 plasmidA. Fluorescent observation, green represents the expression of fluorescent protein; B. Bright field observation, red arrow indicates the location of the cell emitting green fluorescence2.7 油酸诱导前脂肪细胞分化
用油红 O染色评估前脂肪细胞的分化程度, 染色结果如图 6所示。前脂肪细胞的分化程度随着分化时间而增加, 7d的分化程度显著高于1d。而在相同分化时间内, 与对照组相比, 400 μmol/L油酸诱导脂质聚积的效果优于其他组。前脂肪细胞经400 μmol/L油酸诱导7d后, 即可正常分化为脂肪细胞。
2.8 细胞分化过程基因表达的变化
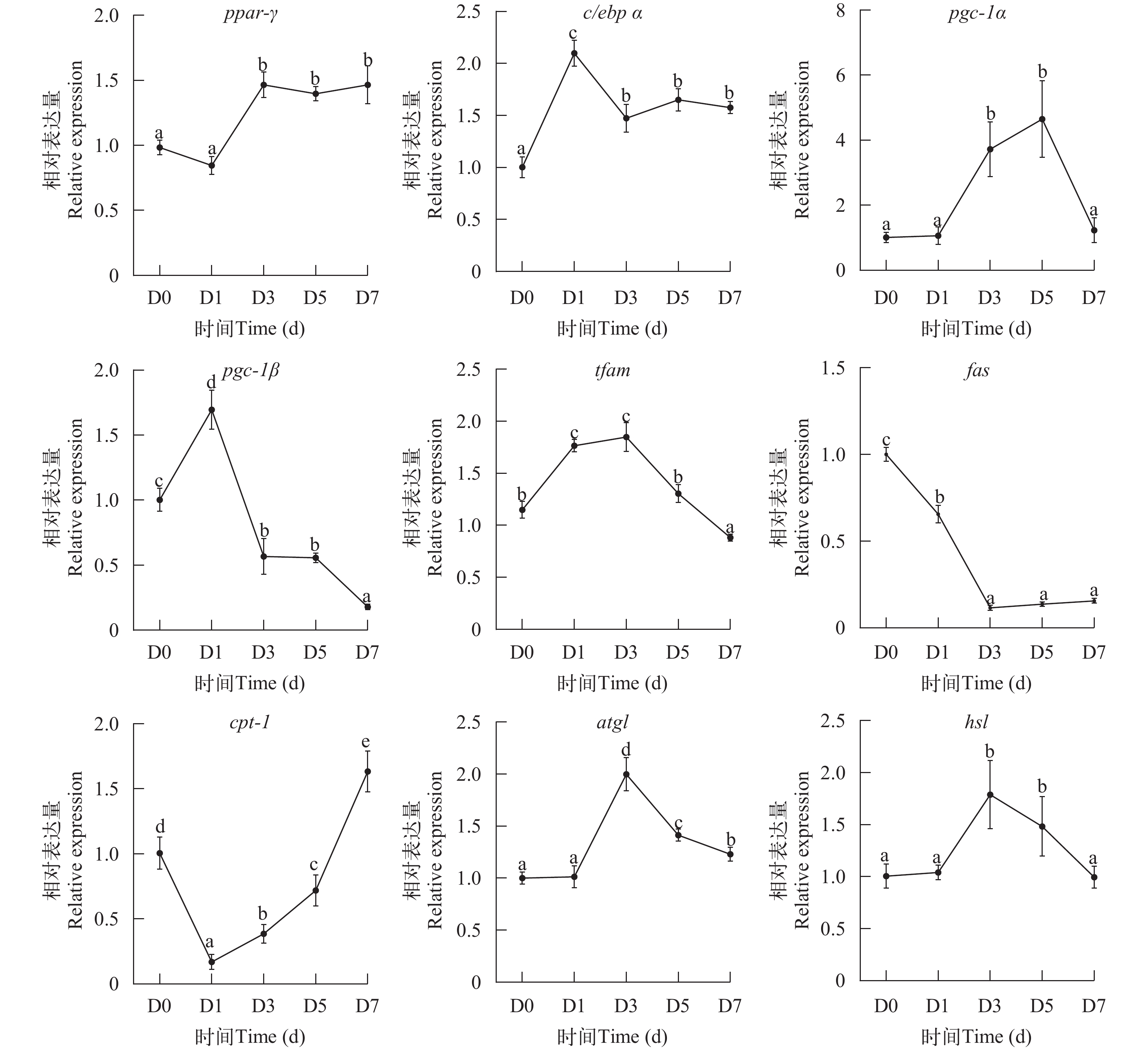
为了解细胞分化过程的代谢特征, 分析了相关基因表达的变化。如图 7所示, 分化前期ppar-γ和c/ebpα表达均显著升高, 而随分化时间的增加, 表达量维持稳定, 且7d的表达量均显著高于对照 (P<0.05)。
在分化过程中, 线粒体生成相关基因pgc-1α、pgc-1β和tfam剧烈变化, 均呈现先上调后下调的表达变化, 7d后表达量恢复至或显著低于开始时水平。
脂代谢相关基因的表达也随着分化过程剧烈变化, 分化初期cpt-1的表达下调而后逐渐上调, 而atgl、hsl与cpt-1表现为相反的趋势, fas表达随分化持续下调。
3. 讨论
花鲈是我国重要的海水养殖鱼类, 其肉质鲜美、适应能力强, 因此被广泛养殖, 2022年的养殖产量已达21.8万吨, 产量位居海水鱼第二[12]。然而, 集约化养殖的花鲈因饲料过度投喂等会导致腹脂的过度沉积。在实际生产中, 花鲈腹腔脂肪的重量可高达体重的10%。由于腹脂基本没有利用价值, 但是腹脂的生成却耗费了大量的饲料, 据估算每年将产生数亿元的浪费。除此之外, 腹脂沉积还会导致慢性炎症等问题, 导致鱼体的抗病与抗逆能力降低[2]。为了探究花鲈脂肪沉积的分子机制, 需要良好的研究模型与平台。因而, 本研究的目的就是建立花鲈前脂肪细胞系。基于此, 我们研究了花鲈前脂肪细胞的原代培养与传代方法, 包括细胞培养的条件、传代后细胞状态等。
3.1 培养细胞的生长条件
在原代前脂肪细胞培养中, 分析了4种培养基DMEM/F12、DMEM高糖、L15和M199培养细胞对细胞生长的影响。结果表明: DMEM/F12培养基对细胞数量与细胞数量倍增时间均最佳。这一结果与在草鱼(Ctenopharyngodon idella)[13]和金头鲷(Sparus aurata)[14]的前脂肪原代细胞结果一致。但目前鱼类细胞培养过程中大多是使用L-15培养基, 如齐口裂腹鱼(Schizothorax prenanti)鳃丝细胞系SPG[15]。这也说明由于鱼的不同细胞来源, 对培养基的要求不同。此外, 培养基的血清浓度对细胞的生长影响较大, 我们研究结果显示15%和20%浓度的血清显著高于10%和5%血清浓度对细胞生长的效果, 而20%的血清浓度效果稍优于15%, 表明血清浓度对细胞生长具有重要影响[16]。根据本研究的结果, 我们筛选得到了花鲈前脂肪细胞的适宜培养条件为20%的胎牛血清+DMEM/F12培养液。
3.2 细胞系的核型特征及来源
染色体分析是鉴定细胞系来源的可靠的方法, 本研究对100个分裂中期细胞的染色体进行计数, 其中62%为48条, 与花鲈的染色体数(2n=48)一致[17]。进一步, 用DNA序列鉴定了所建立细胞系的物种来源。细胞色素c氧化酶亚基(cox1)基因与细胞色素b基因(cytb)位于编码区, 进化速度适中, 富含种内或种间甚至科属间的遗传进化信息, 且结构和功能较保守, 常用于来源鉴定和生物遗传多样性研究[18, 19]。通过测序, 本细胞系的cox1和cytb与NCBI中花鲈已知cox1和cytb基因序列一致性分别为99.90%和99.78%。因此, 确定了该细胞确实来源于花鲈。
3.3 细胞系的转染
细胞系的一个重要功能就是通过转入特定基因以进行分子机制与调控表达的研究。为此, 本文研究了是否可利用脂质体lipo8000将pEGFP-C1质粒转入细胞内。结果显示: 转染后细胞能够成功表达绿色荧光。这表明该细胞系可用于转入并研究外源转入基因的表达, 能够作为后续研究的材料与平台。
3.4 油酸诱导细胞分化及基因表达特征
前脂肪细胞的一个典型特征是能够分化成为成熟的脂肪细胞, 从形态上看细胞由纤维状逐渐变圆, 且有明显的脂滴积累[20]。为此, 本研究通过不同浓度油酸诱导, 经油红O染色后发现, 培养7d后的细胞均能观察到明显的脂滴, 且400 μmol/L油酸诱导分化效果最好。这一结果表明, 花鲈前脂肪细胞可分化。通过本研究表明, 该前脂肪细胞在400 μmol/L油酸的条件下培养7d即可正常分化为脂肪细胞。
在脂肪细胞分化过程, 一些基因的表达会发生较为剧烈的变化。为进一步了解花鲈前脂肪细胞分化的特征, 分析了相关基因表达的变化规律。ppar-γ是调控哺乳动物脂肪生成的重要转录因子, 并且在大黄鱼(Pseudosciaena crocea)[21]相关的研究中也发现ppar-γ与脂肪细胞分化相关, c/ebp α在草鱼和罗非鱼(Oreochromis niloticus)的脂肪细胞分化后其表达上调[22, 23]。在本研究中, 细胞分化前期ppar-γ和c/ebpα表达均显著升高, 而随分化时间的增加, 表达量维持稳定, 这表明ppar-γ和c/ebp α可能是鱼类脂肪细胞分化所必需的转录调控因子。此外, 线粒体在脂肪细胞分化过程中发挥重要作用, 以往的研究发现在脂肪细胞分化的过程中线粒体数量会增加[24, 25]。pgc-1作为线粒体生物发生的重要基因, 在3T3-L1脂肪细胞分化的研究中发现, pgc-1β表达量会随着前脂肪细胞分化而上调[25]。在本研究中, 我们发现线粒体生成相关的pgc-1α、pgc-1β和tfam均表现先上升后下降的趋势, 与草鱼脂肪细胞分化过程中的结果类似[22]。据我们分析, 在分化前期细胞需要大量能量来合成脂滴并沉积, 因而需要大量线粒体用以供能, 而分化后期细胞的能量需求降低[26]; 因而pgc-1α、pgc-1β和tfam表达水平的变化可能反应了细胞对能量的需求。此外, 在分化过程中脂肪代谢相关的基因变化也发生较明显的变化, cpt-1表达先下调后上调, 而atgl和hsl的表达与pgc-1α和tfam类似, 但变化则相对滞后。这也说明, 线粒体是细胞代谢的核心, 最先表现出基因的表达变化, 进而导致脂代谢的改变。
4. 结论
综上所述, 将花鲈腹腔脂肪组织用胶原酶消化后原代培养, 再以胰酶消化后传代, 建立了花鲈前脂肪细胞系, 现已成功传至150代以上, 并通过核型分析和线粒体cox1和cytb基因鉴定了该细胞系。该细胞系在长期液氮保存下仍具有较高活力, 冷冻后复苏培养的细胞成活率大于90%。此外, 将pEGFP-C1质粒转入细胞后能够成功表达绿色荧光。该前脂肪细胞系经油酸诱导后具有分化能力, 脂代谢基因表达变化显著, 可作为研究鱼类脂肪细胞分化及脂肪沉积的良好模型。
-
图 1 花鲈前脂肪细胞系的表观形态
A. 第0代培养24h的原代细胞; B—E. 是培养24h后的第1、10、50和100代的细胞; F. 冻存前第54代细胞; G—I. 冻存1、3和6个月后复苏培养24h的细胞
Figure 1. The apparent morphology of proadipose cell line of the spotted sea bass
A. Primary cells cultured for 24h in the 0 generation; B—E. is the 1st, 10th, 50th, and 100th generation of cells cultured for 24h; F. Cryopreservation of pre-54th generation cells; G—I. Cells frozen 1, 3, and 6 months later are resuscitated and cultured for 24h
图 5 pEGFP-C1质粒转染后48h的荧光蛋白表达
A. 荧光下观察, 绿色代表荧光蛋白表达; B. 明场观察, 黑色箭头表示发出绿色荧光的细胞位置
Figure 5. Expression of fluorescent protein 48h after transfection with pEGFP-C1 plasmid
A. Fluorescent observation, green represents the expression of fluorescent protein; B. Bright field observation, red arrow indicates the location of the cell emitting green fluorescence
表 1 实时荧光定量PCR引物序列
Table 1 Primers sequence of Real-time fluorescent quantitative PCR
基因
Gene引物Primer (5′—3′) 退火温度
Tm (℃)ppar-γ ACGCCGTGGACCTGTCAGAG
CGTGATGGAGGAGGAGGAGATGG60 c/ebp α AAGATGCGCAACATGGAGAC
TCTGAAGATGCCCCGTAACG60 pgc-1α GTTCCTCCGAACTCCCAGTG
GCAACACCCCTCCAACTACA60 pgc-1β GTTCCTCCGAACTCCCAGTG
GCAACACCCCTCCAACTACA60 tfam GGTCAGACATTTCACTGGGTTG
GCGGCTCTAATGCGTGAAT60 cpt-1 CCTCAATGATACATCGGAACCC
CTGCGGCTCATCATCTAACG60 atgl CTTCCTCTCCGCAACAAGTC
TGGTGCTGTCTGGAGTGTTC60 hsl CGAAACACAGAGACGGTCCA
TCATGACATCTACCAGCCGC60 fas AAACTGAAGCCCTGTGTGCC
CACCCTGCCTATTACATTGCTC60 β-actin CAACTGGGATGACATGGAGAAG
TTGGCTTTGGGGTTCAGG60 表 2 细胞冻存后复苏存活率
Table 2 Cell resuscitation rate after cryopreservation
冻存时间(月)
Freezing time (month)细胞存活率
Cell viability (%)1 96.33±0.88a 3 95.00±2.08a 6 92.00±1.73a 注: 同列数据肩标不同小写字母表示差异显著(P<0.05), 下同Note: In the same column, values with different small letter superscripts mean significant difference (P<0.05), the same applies below 表 3 不同培养基条件下原代细胞的倍增时间
Table 3 Multiplication time of primary cells under different medium conditions
培养基
Medium细胞密度Cell density (×105 cell/well) 培养时间Δt
Cultivation time (h)倍增时间T2
Doubling time (h)起始数 N0
Starting number最终数
Final number增长数ΔN
Growth numberDMEM/F12 1.45 5.30±0.04c 3.85±0.04c 144 77.01±0.40a DMEM高糖 1.45 5.11±0.07c 3.66±0.07c 79.23±0.88a L15 1.45 4.45±0.05b 3.00±0.05b 89.03±0.79b M199 1.45 3.40±0.09a 1.95±0.09a 117.57±3.63c 表 4 不同血清浓度条件下原代细胞的倍增时间
Table 4 Multiplication time of primary cells under different serum concentrations
血清浓度
Serum concentration细胞密度Cell density (×105 cell/well) 培养时间Δt
Cultivation time (h)倍增时间T2
Doubling time (h)起始数 N0
Starting number最终数
Final number增长数ΔN
Growth number5 1.45 3.35±0.10a 1.90±0.10a 144 119.63±4.31c 10 1.45 4.16±0.24b 2.71±0.24b 95.49±5.08b 15 1.45 4.89±0.12c 3.44±0.12c 82.26±1.64a 20 1.45 5.50±0.10d 4.05±0.10c 74.95±1.02a -
[1] 任艳华, 张隽美, 卢荣华, 等. 鱼类营养代谢性疾病研究进展 [J]. 江苏农业学报, 2021, 37(6): 1623-1629. Ren Y H, Zhang J M, Lu R H, et al. Research progress on fish nutritional metabolic diseases [J]. Jiangsu Journal of Agricultural Sciences, 2021, 37(6): 1623-1629.
[2] Naiel M A, Negm S S, Ghazanfar S, et al. The risk assessment of high-fat diet in farmed fish and its mitigation approaches: a review [J]. Journal of Animal Physiology and Animal Nutrition, 2023, 107(3): 948-969. doi: 10.1111/jpn.13759
[3] Heinonen S, Jokinen R, Rissanen A, et al. White adipose tissue mitochondrial metabolism in health and in obesity [J]. Obesity Reviews, 2020, 21(2): e12958. doi: 10.1111/obr.12958
[4] 王伟. 鸡永生化前脂肪细胞系的建立及分析 [D]. 哈尔滨: 东北农业大学, 2018. Wang W. Establishment and analysis of immortalized chicken preadipocyte cell lines [D]. Harbin: Northeast Agricultural University, 2018.
[5] Thangaraj R S, Narendrakumar L, Prasannan Geetha P, et al. Comprehensive update on inventory of finfish cell lines developed during the last decade (2010—2020) [J]. Reviews in Aquaculture, 2021, 13(4): 2248-2288. doi: 10.1111/raq.12566
[6] Sun W, Sun X, Chu W, et al. CircRNA expression profiles in human visceral preadipocytes and adipocytes [J]. Molecular Medicine Reports, 2020, 21(2): 815-821.
[7] Green H, Meuth M. An established pre-adipose cell line and its differentiation in culture [J]. Cell, 1974, 3(2): 127-133. doi: 10.1016/0092-8674(74)90116-0
[8] Cheng Y M, Hong P C, Song M M, et al. An immortal porcine preadipocyte cell strain for efficient production of cell-cultured fat [J]. Communications Biology, 2023, 6(1): 1202. doi: 10.1038/s42003-023-05583-7
[9] Korzyńska A, Zychowicz M. A method of estimation of the cell doubling time on basis of the cell culture monitoring data [J]. Biocybernetics and Biomedical Engineering, 2008, 28(4): 75-82.
[10] 范嗣刚, 黄皓, 王鹏飞, 等. 基于cox1序列的中国6个花鲈野生群体遗传多样性 [J]. 广东海洋大学学报, 2022, 42(03): 11-17. doi: 10.3969/j.issn.1673-9159.2022.03.002 Fan S G, Huang H, Wang P F, et al. Population genetic diversity of spotted sea bass (Lateolabrax maculatus) from China Based on mitochondrial cox1 gene sequence [J]. Journal of Guangdong Ocean University, 2022, 42(03): 11-17. doi: 10.3969/j.issn.1673-9159.2022.03.002
[11] 刘明月, 蒋琦辰, 杨家新. 不同海域中国花鲈的细胞色素b序列的遗传分析 [J]. 南京师大学报(自然科学版), 2010, 33(1): 102-106. Liu M Y, Jiang Q C, Yang J X. Analysis on mitochondrial DNA cytochrome b gene of Lateolabrax japonicas from different seas [J]. Journal of Nanjing Normal University (Natural Science Edition), 2010, 33(1): 102-106.
[12] 中国渔业统计年鉴编委会. 2023中国渔业统计年鉴 [M]. 北京: 中国农业出版社, 2023. Editorial Committee of China Fishery Statistical Yearbook. China Fishery Statistical Yearbook 2023 [M]. BeiJing: China Agriculture Press, 2023.
[13] 吉红, 曹艳姿, 林亚秋, 等. 草鱼前体脂肪细胞的原代培养 [J]. 水生生物学报, 2009, 33(6): 1226-1230. Ji H, Cao Y Z, Lin Y Q, et al. Primary culture of grass carp preadipocyte in vitro [J]. Acta Hydrobiologica Sinica, 2009, 33(6): 1226-1230.
[14] Salmerón C, Acerete L, Gutiérrez J, et al. Characterization and endocrine regulation of proliferation and differentiation of primary cultured preadipocytes from gilthead sea bream (Sparus aurata) [J]. Domestic Animal Endocrinology, 2013, 45(1): 1-10. doi: 10.1016/j.domaniend.2013.02.002
[15] 巩志宏, 王娜, 刘娟娟, 等. 齐口裂腹鱼鳃丝细胞系的建立、鉴定及免疫研究 [J]. 中国水产科学, 2022, 29(10): 1407-1416. Gong Z H, Wang N, Liu J J, et al. Establishment, identification, and immunological study of gill filament cell line of Schizothorax prenanti [J]. Journal of Fishery Sciences of China, 2022, 29(10): 1407-1416.
[16] Choi H J, Lee J H, Jung H J, et al. Establishment and characterization of a new cell line derived from the fin of olive flounder (Paralichthys olivaceus) [J]. Aquaculture, 2020(528): 735534. doi: 10.1016/j.aquaculture.2020.735534
[17] Chen B, Li Y, Peng W, et al. Chromosome-level assembly of the Chinese seabass (Lateolabrax maculatus) genome [J]. Frontiers in Genetics, 2019(10): 275. doi: 10.3389/fgene.2019.00275
[18] 李楠, 王佳慧, 韩春卉, 等. COI及cytb基因对河鲀鱼鱼种鉴定的适用性研究 [J]. 中国食品卫生杂志, 2018, 30(1): 6-11. Li N, Wang J H, Han C H, et al. Application of COI and cytb gene in species identification of pufferfish [J]. Chinese Journal of Food Hygiene, 2018, 30(1): 6-11.
[19] Liu J, Berry R E, Blouin M S. Molecular differentiation and phylogeny of entomopathogenic nematodes (Rhabditida: Heterorhabditidae) based on ND4 gene sequences of Mitochondrial DNA [J]. Journal of Parasitology, 1999, 85(4): 709-715. doi: 10.2307/3285747
[20] Shang Z, Guo L, Wang N, et al. Oleate promotes differentiation of chicken primary preadipocytes in vitro [J]. Bioscience Reports, 2014, 34(1): e00093. doi: 10.1042/BSR20130120
[21] Xu D, Gong Y, Xiang X J, et al. Discovery, characterization, and adipocyte differentiation regulation in perirenal adipose tissue of large yellow croaker (Larimichthys crocea) [J]. Fish Physiology and Biochemistry, 2023, 49(4): 627-639.
[22] Liu P, Ji H, Li C, et al. Morphology, mitochondrial development and adipogenic-related genes expression during adipocytes differentiation in grass carp (Ctenopharyngodon idellus) [J]. Science Bulletin, 2015, 60(14): 1241-1251. doi: 10.1007/s11434-015-0833-9
[23] 王雅文, 乔芳, 张美玲, 等. 外源性脂肪酸对罗非鱼脂肪细胞增殖与分化的影响 [J]. 水生生物学报, 2018, 42(3): 517-524. Wang Y W, Qiao F, Zhang M L, et al. Effects of exogenous fatty acid on the proliferation and differentiation of nile tilapia preadipocytes [J]. Acta Hydrobiologica Sinica., 2018, 42(3): 517-524.
[24] Kaaman M, Sparks L M, Van Harmelen V, et al. Strong association between mitochondrial DNA copy number and lipogenesis in human white adipose tissue [J]. Diabetologia, 2007, 50(12): 2526-2533. doi: 10.1007/s00125-007-0818-6
[25] Wilson-Fritch L, Burkart A, Bell G, et al. Mitochondrial biogenesis and remodeling during adipogenesis and in response to the insulin sensitizer rosiglitazone [J]. Molecular and Cellular Biology, 2003, 23(3): 1085-1094. doi: 10.1128/MCB.23.3.1085-1094.2003
[26] Li Q, Gao Z, Chen Y, et al. The role of mitochondria in osteogenic, adipogenic and chondrogenic differentiation of mesenchymal stem cells [J]. Protein & Cell, 2017, 8(6): 439-445.



 下载:
下载: