RESEARCH PROGRESS ON THE REGULATION OF FISH GLYCOLIPID METABOLISM, IMMUNITY AND INTESTINAL FLORA BY BILE ACIDS
-
摘要:
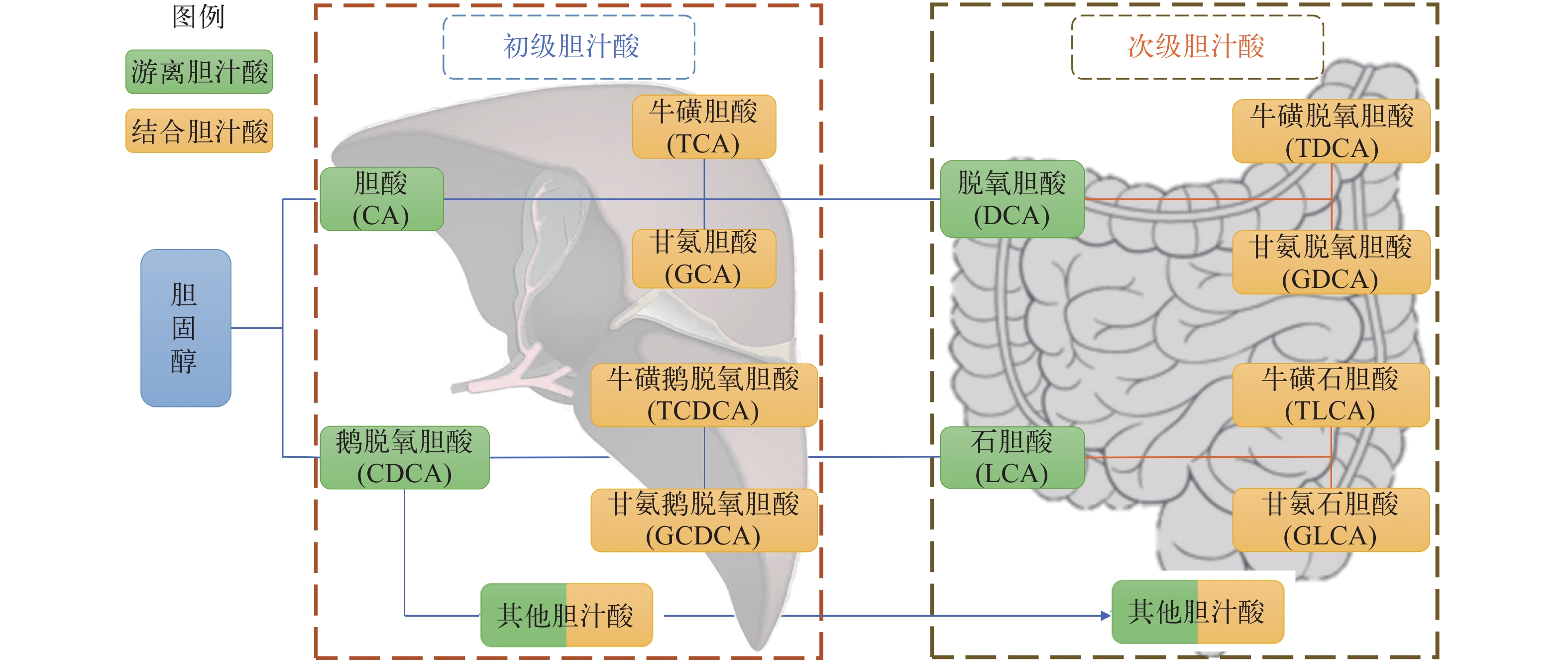
胆汁酸(BAs)是一类两亲性甾醇化合物, 按来源可分为初级胆汁酸和次级胆汁酸, 初级胆汁酸由肝脏中的胆固醇合成后进入肠道, 在肠道中, 初级胆汁酸在回肠末端和结肠上段肠道菌群的作用下转化为次级胆汁酸, 大部分肠道中的胆汁酸在回肠部位通过肝肠循环进入肝脏, 剩余胆汁酸随着粪便等排出体外。研究表明, 胆汁酸在维持鱼类糖脂稳态、提高免疫功能、重塑肠道菌群等方面具有显著效果。不同鱼类中的胆汁酸成分具有物种特异性, 不同胆汁酸的有益效果也因鱼而异, 但是目前对鱼类中胆汁酸的组成、分类及功能知之甚少。文章总结了胆汁酸的组成分类、主要受体、生物学功能及其在鱼类上的研究进展和存在的问题, 以期为鱼类中胆汁酸的进一步研究及其在水产养殖中的高效利用提供参考。
Abstract:Bile acids (BAs) constitute a class of amphipathic sterol compounds, categorized into primary and secondary bile acids based on their origins. Primary bile acids are synthesized from cholesterol in the liver and subsequently enter the intestine. In the intestine, primary bile acids undergo conversion into secondary bile acids by the intestinal flora, primarily in the terminal ileum and upper colon. The majority of bile acids in the intestine are returned to the liver through enterohepatic circulation in the ileum, while the remaining bile acids are excreted with feces. Research shows the significant role of bile acids in maintaining glycolipid homeostasis, improving immune function, and reshaping intestinal flora in fish. However, the composition, classification, and functions of bile acids in different fish species remain poorly understood. This article provides a comprehensive summary of bile acid composition, classification, main receptors, biological functions, and the current state of research and challenges in understanding bile acids in fish. The aim is to offer insights for further investigation into fish bile acids and their efficient utilization in aquaculture practices.
-
Keywords:
- Bile acids /
- Glycolipid metabolism /
- Immune regulation /
- Intestinal flora /
- Fish breeding
-
拒马河原名涞水河, 是海河流域大清河北部支流, 发源于河北省涞源县西北太行山麓, 流经紫荆关向北至涞水县折向东流, 至北京市张坊镇分为南、北二支, 南拒马河目前已经干涸消亡, 北拒马河于白沟镇流入大清河, 拒马河干流长254 km, 张坊镇以上流域面积5115 km2, 是中国北方最大的冬季不结冰河流[1—4]。拒马河流域地貌复杂, 不同河段气候与环境相差悬殊, 生境的多样性造就了丰富的水生生物资源, 是华北地区内陆水域生物多样性的重要组成部分, 具有极高的科研及保护价值[5, 6]。
河流及湖泊水文环境的改变影响其中鱼类群落的结构组成, 而鱼类群落的结构组成也是水生生态系统健康的重要指标, 可通过鱼类群落的变动来分析水环境状况的受污染程度[7, 8]。近年来, 拒马河生态环境发生了巨大变化, 生态流量逐年下降, 水生态环境受人类影响较大[5], 水质、水文流通性发生改变, 改变了生活在其中的鱼类的栖息环境, 增加了鱼类的生存压力[9]。拒马河拦河坝的建设导致河流片段化严重, 纵向连通几乎丧失, 鱼类洄游通道被阻断, 部分河段形成小型静水湖泊, 洄游性、亲流性和因拦河坝建设而失去栖息及越冬场所的鱼类减少而喜静水性鱼类增加[10, 11]。加深鱼类群落在空间和时间上对生境改变做出反应的认知对制定有效的生态环境保护策略非常重要[12], 国内关于鱼类群落与环境因子的关系的研究多集中于近海和河口, 对于内陆河流的研究较为匮乏[13—15]。目前, 拒马河鱼类资源的调查虽有不少资料, 但了解得仍然不够深入和系统, 多仅限于北京段, 如2008年杨文波等[16]对拒马河北京段的鱼类资源调查, 记录鱼类24种; 张春光等[17]在《北京及其邻近地区的鱼类》中整理历史资料, 记录拒马河历史上出现鱼类42种; 袁立来等[6]利用鱼类生物完整性指数对拒马河北京段进行了河流健康评价, 发现拒马河北京段河流健康整体处于较差水平。对拒马河上游区域的物种组成和地理分布等基本问题仍缺乏准确的数据, 因此, 系统开展拒马河鱼类资源调查, 以掌握拒马河鱼类时空分布及影响因子, 是拒马河鱼类资源开发利用和资源保护首要解决的问题。
本研究基于2019—2021年间6次拒马河鱼类资源调查数据, 从物种组成、优势种及群落结构特征等方面分析了鱼类群落结构现状, 并讨论了鱼类资源的时空分布与环境因子的关系, 为拒马河流域内的鱼类资源的保护、修复和管理提供理论基础和科学依据。
1. 材料与方法
1.1 样品采集
本次调查范围自涞源县拒马河源头至张坊镇龙安大桥, 采样点的选择参考《内陆水域渔业自然资源调查规范》[18], 综合考虑拒马河河流特点及采样点的代表性, 设置了15个采样点, 采样点的经纬度和位置见表 1和图 1。于2019年5月 (春季)、8月 (夏季)、10月 (秋季), 2020年8月、10月和2021年5月进行采样调查, 每个采样点设置两条多目刺网和地笼, 刺网规格20 m×1 m和25 m×1.5 m, 网目为3和5 cm, 地笼规格为10 m×35 cm×30 cm和10 m×25 cm×20 cm, 网目为1 cm。刺网和地笼于16:00—18:00时下网, 次日5:00—7:00起网, 放置时间约12h。依据最新鱼类学专著对采集的渔获物分类[19—21], 对新鲜鱼类样本现场进行物种鉴定和个体测量, 采用游标卡尺和电子天平测量体长(精确到1 mm)和体重(精确到0.1 g)数据, 现场无法鉴定的个体用95%的酒精保存后带回实验室进一步分类鉴定。
表 1 拒马河采样点分布Table 1. Distribution of sampling stations in the Juma River采样点
Sampling station编号
Serial number经度
Longitude纬度
Latitude拒马河源头
The source of Juma RiverS1 114°45′04.115″ 39°19′57.115″ 刁江汇
DiaojianghuiS2 115°01′36.775″ 39°25′39.702″ 紫荆关大桥
Zijingguan BridgeS3 115°10′03.338″ 39°25′41.776″ 清凉涧
QingliangjianS4 115°15′38.952″ 39°37′44.969″ 小丰口桥
Xiaofengkou BridgeS5 115°20′35.686″ 39°42′05.548″ 别岸
Bie’anS6 115°27′38.115″ 39°39′06.187″ 琅琊河
Langya RiverS7 115°29′18.773″ 39°39′08.849″ 天花板
TianhuabanS8 115°30′40.557″ 39°39′47.696″ 北石门
BeishimenS9 115°32′44.611″ 39°38′33.555″ 西河口
XihekouS10 115°34′09.356″ 39°38′27.367″ 九渡Jiudu S11 115°35′22.049″ 39°37′41.080″ 六渡Liudu S12 115°37′59.485″ 39°38′19.132″ 穆家口
MujiakouS13 115°39′48.970″ 39°37′43.089″ 千河口
QianhekouS14 115°39′57.071″ 39°36′38.520″ 龙安大桥
Longan BridgeS15 115°41′14.921″ 39°34′32.855″ 对鱼类资源调查的同时, 对15个采样点进行海拔(ASL)、水温(Tem)、水深(Dep)、溶解氧(DO)、透明度(SD)、浊度(FNU)、pH和叶绿素a(Chl.a)等环境因子的测定(水科院, 未发表数据)。
1.2 数据处理分析
采用以下多样性指数来分析拒马河鱼类群落多样性: (1)Margalef丰富度指数(DMa)[22]: DMa =(S–1)/ln N; (2)Shannon-Wiener多样性指数(H') [23]: H′= –∑Pi× ln Pi; (3)Pielou均匀度指数(J′) [24]: J′=H′/lnS。式中, S为采集到的鱼类种类数, N为采集到鱼类的个体数, Pi为样品中第i种鱼类的个体数占渔获物中全部个体数的比例。选择Pinkas等[25]提出的相对重要指数(Index of relative importance, IRI)计算拒马河鱼类群落优势种: IRI=(Ni+Wi) Fi。式中, Ni为渔获物中第i种鱼类的个体数占渔获物总个体数的百分比, Wi为第i种鱼类的生物量占渔获物总生物量的百分比, Fi为第i种鱼类在采样点出现的频率。定义IRI≥500的为优势种, 100≤IRI<500的为重要种, 10≤IRI<100的为常见种, 1≤IRI<10的为一般种, IRI<1的为稀有种[26]。
采用丰度生物量比较曲线(Abundance-biomass comparison curves, ABC曲线) [27]判断鱼类群落稳定性及受干扰程度, ABC曲线的统计量用W表示, 当生物量优势度曲线位于丰度优势度曲线之上时, W为正, 表明群落结构稳定未受干扰, 反之W为负[28]: W=∑(Bi–Ai)/50(S–1)。式中, Ai为第i种鱼类相对应的丰度累积百分比, Bi为第i种鱼类相对应的生物量累积百分比, S为物种数。
为满足数据的正态齐性和方差齐性, 分析前对鱼类丰度数据及多样性数据进行lg(x+1)对数转换, 运用SPSS 25.0通过单因素方差分析(One-way ANOVE)检验不同季节、海拔鱼类丰度及多样性的差异。若存在显著性差异, 进一步使用SNK(Student-newman-Keuls)多重比较分析不同季节、海拔间鱼类丰度及多样性的变化[33]。
在Primer 5.0软件中, 以采集到的鱼类丰度数据为原始矩阵, 进行lg(x+1)对数转换, 运用等级聚类分析(Cluster)和非参数多变量排序(NMDS)将鱼类群落划分不同的组分。运用相似性百分比分析(Similarity percentages, SIMPER)确定维持不同组分间结构相似性的关键物种[29]。
利用Canoco 5.0软件对15个采样点的鱼类物种组成和环境因子进行去趋势对应分析(Detrended correspondence analysis, DCA), 根据分析结果中各排序轴的大小选择线性模型(Redundancy analysis, RDA)或单峰模型(Canonical correspondence analysis, CCA)分析鱼类物种和环境因子的相关性[30]。如果排序轴大于4选择CCA分析, 排序轴小于3选择RDA分析, 介于3和4之间, 两种分析方法均可。
2. 结果
2.1 拒马河鱼类组成及优势种
2019—2021年在拒马河共采集鱼类5486尾, 隶属5目11科37种 (表 2)。渔获物中鲤形目占绝对优势, 有3科24种, 占总种数的64.86%; 鲈形目3科6种, 占16.22%; 鲇形目2科4种, 占10.81%; 合鳃鱼目2科2种, 占5.41%; 颌针鱼目1科1种, 占2.70%。
表 2 拒马河鱼类组成、各月份相对重要指数(IRI)及生态类型Table 2. The fish composition, index of relative important (IRI) of each month and ecological types in the Juma River物种Species 相对重要指数IRI 生态类型 2019.5 2019.8 2019.10 2020.8 2020.10 2021.5 Ecological types 鲤形目Cypriniformes 鲤科Cyprinidae 鲤亚科Cyprininae 鲫Carassius auratus 209.63 3024.43 371.53 1050.27 245.62 273.74 S, Omn, De, V 鱊亚科Acheilognathinae 兴凯鱊Acheilognathus chankaensis 8.36 — — — — — S, Omn, U,Sp 中华鳑鲏Rhodeus sinensis 8.08 — — 3.87 — — S, Omn, U, Sp 高体鳑鲏Rhodeus ocellatus 39.02 148.43 — 62.34 — 4.60 S, Omn, U, Sp 雅罗鱼亚科Leuciscinae 尖头鱥Rhynchocypris oxycephalus 668.20 216.15 101.76 476.61 44.59 90.97 R, Omn, Lo, Dr 拉氏鱥Rhynchocypris lagowskii 317.45 10.61 450.36 54.01 215.97 108.09 R, Omn, Lo, Dr 襁亚科Danioninae 宽鳍鱲Zacco platypus 1928.30 494.22 282.76 2497.27 1558.08 413.94 R, Omn, U, D 马口鱼Opsariichthys bidens 5.48 4.53 14.86 235.48 — — R, Car, U, D 亚科Gobioninae 麦穗鱼Pseudorasbora parva 2291.93 3463.52 1546.54 2742.93 2605.65 5382.96 S, Omn, De, V 点纹银Squalidus wolterstorffi 1162.26 121.92 24.68 92.90 1.49 22.05 S, Omn, Lo, Dr 中间银Squalidus intermedius — 53.15 — 34.37 — — R, Omn, Lo, Dr 兴隆山小鳔Microphysogobio hsinglungshanensis 217.79 53.69 29.31 — 12.42 369.75 R, Omn, Lo, Dr 黑鳍鳈Sarcochilichthys nigripinnis 548.01 622.04 198.44 685.56 383.17 884.47 S, Omn, Lo, Sp 棒花Gobio rivuloides 1.47 183.58 — — — 7.15 R, Omn, De, V 棒花鱼Abbottina rivularis 263.72 38.68 385.70 275.44 532.21 — R, Omn, De, V 蛇Saurogobio dabryi 0.82 1.83 26.13 40.43 337.43 46.09 R, Omn, Lo, Dr 花鳅科Cobitidae 泥鳅Misgurnus anguillicaudatus 1044.35 580.91 55.37 41.34 16.14 50.20 S, Omn, De, Dr 北方泥鳅Misgurnus bipartitus — 1.77 — — — — R, Omn, De, Dr 大鳞副泥鳅Paramisgurnus dabryanus 109.14 144.85 19.20 53.78 21.18 12.62 S, Omn, De, Dr 花斑花鳅Cobitis melanoleuca 95.38 115.57 — 12.07 1.72 71.63 S, Omn, De, Dr 条鳅科Nemacheilidae 北鳅Lefua costata — — — — 2.28 1.41 R, Omn, De, Dr 赛丽高原鳅Triplophysa sellaefer 11.33 — 5.83 — 104.93 37.93 R, Omn, De, Dr 尖头高原鳅TriplophysaCuneicephala — — 2.16 — — — R, Omn, De, Dr 达里湖高原鳅Triplophysa dalaica 97.01 12.11 80.15 — 168.26 127.34 R, Omn, De, Dr 合鳃鱼目Symbranchiformes 刺鳅科Mastacembelidae 刺鳅Sinobdella sinensis 50.12 26.09 — 59.92 — 2.85 S, Car, De, D 合鳃鱼科Symbranchidae 黄鳝Monopterus albus 12.24 — — — — — S, Car, De, Dr 鲈形目Percoidei 鰕虎鱼科Gobiidae 子陵吻鰕虎鱼Rhinogobius giurinus 2.65 8.25 4.56 53.91 38.20 5.10 R, Car, De, D 林氏吻鰕虎鱼Rhinogobius lindbergi 68.08 19.58 9.97 — 0.01 26.13 R, Car, De, D 波氏吻鰕虎鱼Rhinogobius cliffordpopei 44.63 0.96 1.70 — 1.31 — R, Car, De, D 福岛吻鰕虎鱼Rhinogobius fukushimai 30.47 0.63 0.43 1.83 — 2.40 R, Car, De, D 沙塘鳢科Odontobuidae 小黄䱂鱼Micropercops swinhonis 1250.14 308.40 786.30 453.05 386.69 663.59 S, Omn, De, D 丝足鲈科Osphronemidae 圆尾斗鱼Macropodus chinensis 1.40 — 0.44 0.98 1.42 2.62 S, Car, Lo, Dr 鲇形目Siluriformes 鲿科Bagridae 黄颡鱼Pelteobagrus fulvidraco 313.28 861.57 449.50 1265.35 191.14 10.27 S, Car, De, D 瓦氏黄颡鱼Pelteobagrus vachellii 7.92 37.05 0.58 — 9.54 — R, Car, De, D 乌苏里黄颡鱼Pelteobagrus ussuriensis — 287.03 — 37.59 — 20.41 R, Car, De, D 鲇科Siluridae 鲇Silurus asotus 10.83 203.88 198.89 26.22 — — S, Car, De, V 颌针鱼目Beloniformes 青鳉科Adrianichthyidae 青鳉Oryzias sinensis — 1.13 — — — — S, Omn, U, V 注: S. 喜缓流或静水; R. 亲流性; Car. 肉食性; Omn. 杂食性; U. 中上层; Lo. 中下层; De. 底栖。V. 黏性卵; D. 沉性卵; Dr. 漂流性卵; Sp. 喜贝类性卵Note: S. slow flow; R. riffle; Car. carnivore; Omn. omnivore; U. upper; Lo. lower; De. demersal; V. viscid egg; D. demersal egg; Dr. drifting egg; Sp. spawning in shellfish 鱼类生态类型(表 2): 按生活习性可以将采集到的鱼类划分为亲流性鱼类(R)和喜缓流或静水性鱼类(S), 其中亲流性鱼类有20种, 占采集到的鱼类总种数的54.05%, 喜缓流或静水性鱼类有17种, 占总种数的45.95%; 按食性可以划分为杂食性鱼类(Omn)和肉食性鱼类(Car), 杂食性鱼类有25种, 占总种数的67.57%, 肉食性鱼类有12种, 占总种数的32.43%; 按不同栖息水层划分, 底栖鱼类(De)有23种, 占62.16%, 中下层鱼类(Lo)有8种, 占21.62%, 中上层鱼类(Up)有6种, 占16.22%; 按产卵类型划分, 产漂流性卵的鱼类(Dr)有16种, 占43.24%, 产沉性卵的鱼类(D)有11种, 占29.73%, 产黏性卵的鱼类(V)6种, 占16.22%, 喜贝类性产卵的鱼类(Sp)4种, 占10.81%。
以相对重要指数IRI≥500的为优势种, 在6次采样调查中, 拒马河优势种有10种, 重要种有12种, 主要种有8种, 一般种有7种。各月份优势种存在差异, 2019年5月优势种为尖头鱥Rhynchocypris oxycephalus Sauvage、宽鳍鱲Zacco platypus Temminck & Schlegel、麦穗鱼Pseudorasbora parva Temminck & Schlegel、点纹银Squalidus wolterstorffi Regan、黑鳍鳈Sarcochilichthys nigripinnis Günther、泥鳅Misgurnus anguillicaudatus Cantor、小黄䱂鱼Micropercops swinhonis Günther; 2019年8月优势种为鲫Carassius auratus Linnaeus、麦穗鱼、黑鳍鳈、泥鳅、黄颡鱼Tachysurus fulvidraco Richardson; 2019年10月优势种为麦穗鱼、小黄䱂鱼; 2020年8月优势种为鲫、宽鳍鱲、麦穗鱼、黑鳍鳈、黄颡鱼; 2020年10月优势种为宽鳍鱲、麦穗鱼、棒花鱼Abbottina rivularis Basilewsky; 2021年5月优势种为麦穗鱼、黑鳍鳈、小黄䱂鱼。麦穗鱼在6次采样调查中均作为优势种出现。
2.2 拒马河鱼类群落特征
单因素方差分析显示(表 3), 不同季节间个体数(N)、物种数(S)、Shannon-Wiener多样性指数(H')、Margalef丰富度指数(DMa)呈现显著性差异(P<0.05), Pielou均匀度指数(J')无显著性差异(P>0.05)。SNK多重比较分析显示, 物种数、个体数均以2019年5月最多, 15个采样点平均捕获鱼类91.00尾9.67种, 2021年10月最少, 平均38.73尾5.07种; Shannon-Wiener多样性指数(H')、Margalef丰富度指数(DMa)均以2019年8月份最高, 分别是1.76(1.09—2.20)和2.06(1.12—2.98)。2019—2021年调查显示拒马河夏季的Shannon-Wiener多样性指数(H')、Margalef丰富度指数(DMa)和Pielou均匀度指数(J')均值高于春、秋两季(图 2)。
表 3 基于单因素方差分析检验(F值)拒马河鱼类多样性指数不同季节、不同海拔的变化Table 3. Changes of fish diversity index in different seasons and different altitudes in the Juma River based on One-way ANOVA test (F value)项目Item 个体数
Number of
individuals (N)物种数
Number of
species (S)多样性指数
Shannon-Wiener
diversity (H')均匀度指数
Pielou
evenness (J')丰富度指数
Margalef
richness (Dma)季节Season 2.935* 7.986** 6.504** 1.022ns 4.9** 海拔Altitude 12.206** 0.122ns 1.616ns 7.368ns 3.765ns 注: ns、*和**分别代表P>0.05、P<0.05、和P<0.01Note: ns, * and ** represent P>0.05, P<0.05 and P<0.01 物种数(S)、Shannon-Wiener多样性指数(H')、Margalef丰富度指数(DMa)、Pielou均匀度指数(J')在不同海拔无显著性差异(P>0.05), 只有个体数(N)呈现显著性差异(P<0.05), 海拔高于500 m的位点平均可采集鱼类143.91尾, 海拔低于500 m的位点可采集48.19尾(图 2)。
NMDS排序分析和聚类分析结果一致, 拒马河鱼类群落自上游至下游可划分为3组, 即S1和S2为组Ⅰ, S3和S4为组Ⅱ, 其余采样点为组Ⅲ(图 3)。相似性百分比分析SIMPER(表 4)显示, 组Ⅰ平均相似度为51.01%, 主要贡献种有麦穗鱼、鲫、小黄䱂鱼、泥鳅、拉氏鱥Rhynchocypris lagowskii Dybowski、赛丽高原鳅Triplophysa sellaefer Nichols、尖头鱥、达里湖高原鳅Triplophysa dalaica Kessler和林氏吻鰕虎鱼Rhinogobius lindbergi Berg, 累积贡献度为90.07%; 组Ⅱ平均相似度为66.92%, 主要贡献种有麦穗鱼、小黄䱂鱼、棒花鱼、黄颡鱼、鲫、子陵吻鰕虎鱼Rhinogobius giurinus Rutter、中间银Squalidus intermedius Nichols和林氏吻鰕虎鱼, 累积贡献度为90.16%; 组Ⅲ平均相似度为61.00%, 主要贡献种有麦穗鱼、宽鳍鱲、小黄䱂鱼、黑鳍鳈、鲫、黄颡鱼、泥鳅、棒花鱼、高体鳑鲏Rhodeus ocellatus Kner、兴隆山小鳔Microphysogobio hsinglungshanensis Mori、点纹银、刺鳅Sinobdella sinensis Bleeker和棒花Gobio rivuloides Nichols, 累积贡献度为91.23%。
表 4 拒马河不同位点的主要贡献种相似性百分比分析Table 4. The main contributionspecies of Juma River in different locals of similarity percentage analysis物种Species 组Ⅰ GroupⅠ 组Ⅱ GroupⅡ 组Ⅲ GroupⅢ AA AS (%) Con (%) AA AS (%) Con (%) AA AS (%) Con (%) 麦穗鱼Pseudorasbora parva 277.50 10.87 21.30 145.00 14.29 21.36 51.91 9.14 14.99 鲫Carassius auratus 73.00 8.74 17.14 9.00 6.23 9.31 13.09 5.24 8.59 小黄䱂鱼Micropercops swinhonis 24.50 6.56 12.86 41.00 10.97 16.40 31.91 7.28 11.93 泥鳅Misgurnus anguillicaudatus 23.50 6.00 11.76 9.09 3.63 5.95 拉氏鱥Rhynchocypris lagowskii 78.00 3.65 7.16 赛丽高原鳅Triplophysa sellaefer 17.50 2.82 5.54 尖头鱥Rhynchocypris oxycephalus 135.00 2.82 5.54 达里湖高原鳅Triplophysa dalaica 78.50 2.24 4.39 林氏吻鰕虎鱼Rhinogobius lindbergi 3.50 2.24 4.39 3.00 3.29 4.92 棒花鱼Abbottina rivularis 39.50 9.39 14.04 4.73 2.43 3.98 黄颡鱼Pelteobagrus fulvidraco 15.00 7.18 10.73 6.91 3.74 6.12 子陵吻鰕虎鱼Rhinogobius giurinus 8.50 4.82 7.20 中间银Squalidus intermedius 9.00 4.15 6.21 宽鳍鱲Zacco platypus 55.91 8.07 13.22 黑鳍鳈Sarcochilichthys nigripinnis 32.55 7.26 4.33 高体鳑鲏Rhodeus ocellatus 5.55 2.31 3.79 兴隆山小鳔Microphysogobio hsinglungshanensis 13.82 2.16 3.54 点纹银Squalidus wolterstorffi 18.27 2.11 3.45 刺鳅Sinobdella sinensis 2.45 1.21 1.99 棒花Gobio rivuloides 2.36 1.09 1.78 注: AA. 平均多度, AS. 平均相似度, Con. 贡献度Note: AA. average abund, AS. average similarity, Con. contribution 2.3 丰度生物量比较曲线
鱼类群落的优势度曲线变化趋势(图 4)显示, 2020年8月拒马河鱼类群落的生物量优势度曲线位于丰度优势度曲线之上, 统计值W>0, 表示该月份鱼类群落结构稳定未受干扰, 其余月份的丰度累积百分比与生物量累积百分比的大小交错分布, ABC曲线中丰度优势度曲线与生物量优势度曲线相交, 统计量W<0, 鱼类群落受到中等程度干扰。2020年夏季数量优势度曲线和丰度优势度曲线均排在前5位的优势种类为麦穗鱼、宽鳍鱲和尖头鱥, 该季度所采集渔获物中, 平均个体生物量为8.99 g, 平均个体生物量最大的是黄颡鱼, 为30.86 g, 平均个体生物量最小的是福岛吻鰕虎鱼Rhinogobius fukushimai Mori, 为0.50 g。
2.4 拒马河鱼类群落结构与环境因子的关系
DCA排序结果显示四个排序轴长度均小于3(表 5), 其中一、二轴长分别为2.84和2.28, 累积解释物种变化率为13.74%和22.72%, 物种和环境与排序轴相关性为94.14%、87.37%, 拒马河鱼类群落参数对环境因子的响应呈线性关系, 因此拒马河鱼类群落与环境因子分析适用于RDA分析。
表 5 拒马河鱼类群落DCA分析Table 5. Detrended correspondence analysis of fish community in the Juma River排序轴编号No. Axis 1 Axis 2 Axis 3 Axis 4 特征值Eigenvalues 0.3306 0.2159 0.1402 0.0736 排序轴梯度长度Gradient length 2.84 2.28 2.13 1.81 物种累计解释变量百分比
Cumulative percentage explained variation of species (%)13.74 22.72 28.54 31.60 物种和环境因子与排序轴相关系数
Species-environment correlations0.9414 0.8737 0.8688 0.8913 RDA分析中第一轴和第二轴为主成分轴(表 6), 第一轴解释变化率为21.73%, 前两轴累计解释变化率为29.03%, 物种和环境同前两轴相关关系分别为94.66%和81.29%。拒马河鱼类群落与环境因子RDA排序图结果(图 5)显示, 影响拒马河鱼类群落结构组成影响最大的环境变量为海拔(ASL), 对主要种类的解释量为20.60%, 是显著影响因子(蒙特卡洛检验F=8.8, P=0.002), 海拔与pH(蒙特卡洛检验F=0.2, P=0.024)同第一轴的相关性较强。海拔对尖头高原鳅Triplophysa Cuneicephala Shaw & Tchang、达里湖高原鳅、尖头鱥、拉氏鱥、马口鱼Opsariichthys bidens Günther、蛇Saurogobio dabryi Bleeker、棒花鱼等影响较大。黑鳍鳈、刺鳅、瓦氏黄颡鱼Pelteobagrus vachellii Richardson等对pH的变化呈负相关, 而兴凯鱊Acanthorhodeus chankaensis Dybowski对pH的变化呈正相关。水温(蒙特卡洛检验F=2.8, P=0.008)与第二轴相关性较强, 对鲫、高体鳑鲏和乌苏里黄颡鱼Pelteobagrus ussuriensis Dybowski等的影响较大。
表 6 拒马河鱼类群落RDA分析Table 6. Redundancy analysis of fish community in the Juma River排序轴编号No. Axis 1 Axis 2 Axis 3 Axis 4 特征值Eigenvalues 0.217 0.073 0.047 0.034 累计解释变化率
Cumulative percentage explained variation (%)21.73 29.03 33.69 37.09 物种和环境因子与排序轴相关系数
Species-environment correlations0.9466 0.8129 0.7315 0.5583 累计解释拟合变化率
Explained fitted variation (cumulative)50.19 67.05 77.82 85.67 ![]() 图 5 拒马河鱼类与环境因子的RDA图Tem. 水温; Dep. 水深; DO. 溶解氧; Chl.a. 叶绿素a; SD. 透明度; ASL. 海拔; FNU. 浊度; PH. 酸碱度; sp1. 鲫; sp2. 兴凯鱊; sp3. 中华鳑鲏; sp4. 高体鳑鲏; sp5. 尖头鱥; sp6. 拉氏鱥; sp7. 宽鳍鱲; sp8. 马口鱼; sp9. 麦穗鱼; sp10. 点纹银; sp11. 中间银; sp12. 兴隆山小鳔; sp13. 黑鳍鳈; sp14. 棒花; sp15. 棒花鱼;sp16. 蛇; sp17. 泥鳅; sp18. 北方泥鳅; sp19. 大鳞副泥鳅; sp20. 花斑花鳅; sp21. 北鳅; sp22. 塞丽高原鳅; sp23. 尖头高原鳅; sp24. 达里湖高原鳅; sp25. 刺鳅; sp26. 黄鳝; sp27. 子陵吻鰕虎鱼; sp28. 林氏吻鰕虎鱼; sp29. 波氏吻鰕虎鱼; sp30. 福岛吻鰕虎鱼; sp31. 小黄䱂鱼; sp32. 圆尾斗鱼; sp33. 黄颡鱼; sp34. 瓦氏黄颡鱼; sp35. 乌苏里黄颡鱼; sp36. 鲇; sp37. 青鳉Figure 5. Redundancy analysis of fish community and environmental factors in the Juma RiverTem. temperature; Dep. depth; DO. dissolved oxygen; Chl.a. chlorophyll a; SD. transparency; ASL. altitude; FNU. formazin unit; pH. potential of hydrogen sp1. Carassius auratus; sp2. Acheilognathus chankaensis; sp3. Rhodeus sinensis; sp4. Rhodeus ocellatus; sp5. Rhynchocypris oxycephalus; sp6. Rhynchocypris lagowskii; sp7. Zacco platypus; sp8. Opsariichthys bidens; sp9. Pseudorasbora parva; sp10. Squalidus wolterstorffi; sp11. Squalidus intermedius; sp12. Microphysogobio hsinglungshanensis; sp13. Sarcochilichthys nigripinnis; sp14. Gobio rivuloides; sp15. Abbottina rivularis; sp16. Saurogobio dabryi; sp17. Misgurnus anguillicaudatus; sp18. Misgurnus bipartitus; sp19. Misgurnus dabryanus; sp20. Cobitis melanoleuca; sp21. Lefua costata; sp22. Triplophysa sellaefer; sp23. Triplophysa cuneicephala; sp24. Triplophysa dalaica; sp25. Sinobdella sinensis; sp26. Monopterus albus; sp27. Rhinogobius similis; sp28. Rhinogobius lindbergi; sp29. Rhinogobius cliffordpopei; sp30. Rhinogobius fukushimai; sp31. Micropercops swinhonis; sp32. Macropodus ocellatus; sp33. Tachysurus fulvidraco; sp34. Pelteobagrus vachellii; sp35. Pelteobagrus ussuriensis; sp36. Silurus asotus; sp37. Oryzias sinensis
图 5 拒马河鱼类与环境因子的RDA图Tem. 水温; Dep. 水深; DO. 溶解氧; Chl.a. 叶绿素a; SD. 透明度; ASL. 海拔; FNU. 浊度; PH. 酸碱度; sp1. 鲫; sp2. 兴凯鱊; sp3. 中华鳑鲏; sp4. 高体鳑鲏; sp5. 尖头鱥; sp6. 拉氏鱥; sp7. 宽鳍鱲; sp8. 马口鱼; sp9. 麦穗鱼; sp10. 点纹银; sp11. 中间银; sp12. 兴隆山小鳔; sp13. 黑鳍鳈; sp14. 棒花; sp15. 棒花鱼;sp16. 蛇; sp17. 泥鳅; sp18. 北方泥鳅; sp19. 大鳞副泥鳅; sp20. 花斑花鳅; sp21. 北鳅; sp22. 塞丽高原鳅; sp23. 尖头高原鳅; sp24. 达里湖高原鳅; sp25. 刺鳅; sp26. 黄鳝; sp27. 子陵吻鰕虎鱼; sp28. 林氏吻鰕虎鱼; sp29. 波氏吻鰕虎鱼; sp30. 福岛吻鰕虎鱼; sp31. 小黄䱂鱼; sp32. 圆尾斗鱼; sp33. 黄颡鱼; sp34. 瓦氏黄颡鱼; sp35. 乌苏里黄颡鱼; sp36. 鲇; sp37. 青鳉Figure 5. Redundancy analysis of fish community and environmental factors in the Juma RiverTem. temperature; Dep. depth; DO. dissolved oxygen; Chl.a. chlorophyll a; SD. transparency; ASL. altitude; FNU. formazin unit; pH. potential of hydrogen sp1. Carassius auratus; sp2. Acheilognathus chankaensis; sp3. Rhodeus sinensis; sp4. Rhodeus ocellatus; sp5. Rhynchocypris oxycephalus; sp6. Rhynchocypris lagowskii; sp7. Zacco platypus; sp8. Opsariichthys bidens; sp9. Pseudorasbora parva; sp10. Squalidus wolterstorffi; sp11. Squalidus intermedius; sp12. Microphysogobio hsinglungshanensis; sp13. Sarcochilichthys nigripinnis; sp14. Gobio rivuloides; sp15. Abbottina rivularis; sp16. Saurogobio dabryi; sp17. Misgurnus anguillicaudatus; sp18. Misgurnus bipartitus; sp19. Misgurnus dabryanus; sp20. Cobitis melanoleuca; sp21. Lefua costata; sp22. Triplophysa sellaefer; sp23. Triplophysa cuneicephala; sp24. Triplophysa dalaica; sp25. Sinobdella sinensis; sp26. Monopterus albus; sp27. Rhinogobius similis; sp28. Rhinogobius lindbergi; sp29. Rhinogobius cliffordpopei; sp30. Rhinogobius fukushimai; sp31. Micropercops swinhonis; sp32. Macropodus ocellatus; sp33. Tachysurus fulvidraco; sp34. Pelteobagrus vachellii; sp35. Pelteobagrus ussuriensis; sp36. Silurus asotus; sp37. Oryzias sinensis3. 讨论
3.1 拒马河鱼类群落组成结构特征
拒马河位于太行山迎风区北部, 北连西北山间盆地和北京西山地区, 西部以山西省为邻, 南部与大清河南支山区相接[31], 根据李国良[32]对河北淡水鱼类地理区系的划分, 拒马河流域大部分属于冀西山地, 海拔高度由500 m增至1000 m以上, 鱼类资源以条鳅科(赛丽高原鳅、达里湖高原鳅)、花鳅科(北方泥鳅Misgurnus bipartitus Dybowski、泥鳅)和鲤科中的雅罗鱼亚科(尖头鱥、拉氏鱥、马口鱼、宽鳍鱲)、亚科(麦穗鱼、点纹银、中间银)、鲃亚科(多鳞铲颌鱼Onychostoma macrolepis Bleeker)鱼类为主。根据历史记载, 拒马河鱼类资源并不丰富, 李国良[33]和王所安[20]记录了9种, 杨文波等[16]在2008年对拒马河北京段调查中监测到24种, 袁立来等[6]在2019—2020年对拒马河北京段调查中监测到33种。然而, 针对整个拒马河流域的调查, 近几十年未见报道。本研究在2019—2021年6次对拒马河鱼类资源调查中共发现37种, 与王鸿媛等[34]的记录相比减少了多鳞铲颌鱼、花䱻Hemibarbus maculatus Bleeker、黄线薄鳅Leptobotia flavolineata Wang、东方薄鳅Leptobotia orierntalis Xu, Fang & Wang和花斑副沙鳅Parabotia fasciata Dabry & Thiersant等, 这些鱼类对生态环境的改变极为敏感, 仅分布于水质清澈、溶氧量高和无污染的狭窄水域。综合之前调查[5, 6, 16], 这几种鱼类很可能已经在拒马河流域消失。受地理环境因素和人类活动的影响, 拒马河鱼类分布具有明显的区域性, 海拔在500 m以上的上游区域(组Ⅰ), 渔获物以花鳅科和条鳅科鱼类为主, 包括北鳅Lefua costata Kessler、达里湖高原鳅、赛丽高原鳅、尖头高原鳅、花斑花鳅Cobitis melanoleuca Nichols和北方泥鳅等; 海拔在200m以上的中游区域(组Ⅱ), 水生态环境受人类影响相对较小, 如S3和S4, 渔获物以棒花鱼、中间银为主要组成; 海拔在200 m以下的下游区域(组Ⅲ), 位于旅游景区, 水生态环境受到人类影响较大, 如自S5至S15, 渔获物以黑鳍鳈、麦穗鱼、小黄䱂鱼、高体鳑鲏和泥鳅等喜栖息小河流水环境具有一定耐受力的鱼类为主。组Ⅰ的平均相似性为51.01%, 小于组Ⅱ的66.92%和组Ⅲ的61.00%, 体现了拒马河上游地区相较于中下游地区更具生境多样性。
2019—2021年拒马河优势种有鲫、麦穗鱼、黑鳍鳈和宽鳍鱲等, 按照初次性成熟小于2龄, 最大体长小于24 cm的鱼类划分为小型鱼类的标准[35], 拒马河鱼类群落优势种几乎都是小型鱼类。从食性上看, 拒马河鱼类以杂食性为主, 马口鱼、黄颡鱼和刺鳅等偏肉食性鱼类较少, 表明拒马河鱼类群落高位营养级少, 水生态环境更适合杂食性鱼类的生存。生态类型方面, 亲流性的鱼类物种数较多, 符合内陆河流鱼类组成特点, 但优势种中喜缓流及静水的鱼类较多, 原因可能是拒马河拦河坝的修建导致河流片段化, 部分河段水流速度减慢甚至形成小型静水湖泊, 破坏了亲流性鱼类的捕食、产卵场所同时也为喜静水的鱼类提供了更合适的栖息环境所导致[9, 36, 37], 在设计河坝时, 应优先考虑设计过鱼通道及保护可能因河坝建设而受到影响的鱼类, 降低因河坝的建设而导致的水文环境的改变对其造成的影响。在此次鱼类资源调查中, 麦穗鱼在所有月份都作为鱼类群落的优势种出现, 具有较高的生态优势度。麦穗鱼适应能力强、繁殖力高、食性广, 同拒马河土著鱼类构成了竞争关系, 且吞食鱼卵, 干扰产卵场, 对土著鱼类的生存构成极大威胁[38]。对于麦穗鱼多的河段, 应定期监控其种群动态, 必要情况下可采取人为措施控制其种群数量。
多样性指数(H')和均匀度指数(J')是群落结构稳定的重要评价指标[39], 物种丰富度越高, 个体数分布越均匀, 群落结构越稳定, 多样性指数和均匀度指数也就较大, 反之, 物种受到环境的胁迫, 群落结构不稳定, 多样性指数则低。在本研究中, 拒马河鱼类群落夏季的多样性指数高于春、秋两季, 这可能与夏季水温上升鱼类的活动频率增加有关。鱼类群落结构及物种多样性可以衡量水体健康情况, 水生态环境恶化会直接影响鱼类的物种多样性, 拒马河鱼类群落的Shannon-Wiener多样性指数(H')、Margalef丰富度指数(DMa)及Pielou均匀度指数(J')均表明拒马河的水环境受到了一定程度的污染[40]。
3.2 拒马河鱼类群落稳定性
Warwick[41]于1986年提出丰度生物量比较曲线用于判断鱼类群落稳定性。ABC曲线将生物量优势度曲线和丰度优势度曲线放置在同一坐标系中, 通过两条曲线的分布来分析鱼类群落的受干扰程度[42]。ABC曲线基于r选择和k选择的传统进化理论, 群落结构稳定时, 群落以k选择种类(生长慢, 性成熟晚的大个体种类)为主要组成, 生物量优势度曲线位于丰度优势度曲线之上。随着干扰的增加, k选择的物种逐渐减少而r选择的物种(生长快, 性成熟早的小个体种类)逐渐增加, 丰度生物量比较曲线随之发生改变, 群落受到中度干扰时, 生物量优势度曲线与丰度优势度曲线相交; 群落受到严重干扰时, 生物量优势度曲线位于丰度优势度曲线之下[43]。根据李胜法等[43]的研究标准, 拒马河鱼类群落整体只有2020年夏季结构稳定未受干扰, 其他月份鱼类群落结构受到中等程度的干扰, 但在拒马河不同河段受干扰程度存在差异, 海拔500 m以上的两个位点, 平均采集鱼类143.91尾, 显著高于海拔低于500 m位点的48.19尾, 并采集到数量可观的尖头鱥、拉氏鱥、赛丽高原鳅等对水质要求高的鱼类, 可看出该河段鱼类群落受扰动程度较小。
3.3 拒马河鱼类群落结构与环境因子关系
拒马河鱼类多样性指数中个体数、物种数、多样性指数、丰富度指数在不同季节间呈现显著性差异, 表明拒马河鱼类群落主要受非生物因子的影响。Kadye等[44]研究证明, 温度、海拔、pH、溶解氧和距河口距离等是影响河流鱼类群落结构的主要环境因子。王卓等[45]在研究汉江平川段鱼类群落结构与环境因子的关系中发现电导率(Cond)、5日生化需氧量(BOD5)、pH和硫酸浓度是影响该江段鱼类群落结构的主要环境因子。本文通过RDA分析得出海拔是影响拒马河鱼类群落结构的主要环境因子, 对达里湖高原鳅、尖头高原鳅和北鳅等鳅科鱼类影响较大。水温作用于鱼类的分布、生长、繁殖和迁移, 对拒马河鱼类群落结构的影响仅次于海拔, 自拒马河源头至龙安大桥水温逐渐上升, 鲫和高体鳑鲏等温水性鱼类数量也逐渐增加。兴凯鱊与pH的变化呈正相关, 而棒花鱼、刺鳅和瓦氏黄颡鱼等同pH的变化呈负相关, pH会对鱼的摄食和生长产生影响, 也会影响鱼的感官、代谢、呼吸等生理过程[46]。溶解氧与波氏吻鰕虎鱼Rhinogobius cliffordpopei Nichols、福岛吻鰕虎鱼等小型肉食性鱼类相关性较强, 符合肉食性鱼类耗氧高的特点。叶绿素a也是影响拒马河鱼类群落结构的重要环境因子, 叶绿素a与浮游植物的密度密切相关, 对小黄䱂鱼和棒花鱼等杂食性鱼类影响较大。
4. 结论
本研究系统地调查了拒马河鱼类资源, 共发现鱼类37种, 隶属于5目11科, 补充了拒马河上游区域的物种组成和地理分布等缺乏的基本问题, 为拒马河鱼类资源开发利用和资源保护提供了基础数据。基于等级聚类分析(Cluster)和非参数多变量排序(NMDS)分析发现, 拒马河鱼类分布在空间上具有明显的区域性, 上游以适应清澈流水环境的花鳅科和条鳅科鱼类为主; 中上游以棒花鱼、中间银为主; 中下游以黑鳍鳈、麦穗鱼、小黄䱂鱼和泥鳅等具有一定耐受力的鱼类为主, 这对拒马河生态修复和水利工程修建能提供理论依据。通过群落优势种和丰度生物量比较曲线分析发现, 拒马河以耐污性较强的小型鱼类为主, 主要为鲫、麦穗鱼、黑鳍鳈和宽鳍鱲等, 鱼类群落结构受到一定程度的干扰; 冗余分析显示, 海拔是影响拒马河鱼类分布的主要环境因子。拒马河是大清河水系的主要河流, 目前已有“北京市房山区拒马河水生野生动物自然保护区”, 建议进一步根据拒马河独特的水生态环境划定生态保护红线, 加强对该流域生物多样性的保护。
附表 S1 拒马河鱼类分布Appendix S1. Fish species distribution in Juma River物种
Species采样地点Sampling site 拒马河
源头刁江
汇紫荆关
大桥清凉
涧小丰
口桥别岸 琅琊
河天花
板北石
门西河
口九渡 六渡 穆家
口千河
口龙安
大桥鲤形目Cypriniformes 鲤科Cyprinidae 鲤亚科Cyprininae 鲫Carassius auratus + + + + + + + + + + + + + + + 鱊亚科AcheilognatSpnae 兴凯鱊Acanthorhodeus chankaensis + + 中华鳑鲏Rhodeus sinensis + + + 高体鳑鲏Rhodeus ocellatus + + + + + + + + + + 雅罗鱼亚科Leuciscinae 尖头鱥Rhynchocypris oxycephalus + + + + + + + + + 拉氏鱥Rhynchocypris lagowskii + + + + + + + 襁亚科Danioninae 宽鳍鱲Zacco platypus + + + + + + + + + + + + 马口鱼Opsariichthys bidens + + + + + + 亚科Gobioninae 麦穗鱼Pseudorasbora parva + + + + + + + + + + + + + + + 点纹银Squalidus wolterstorffi + + + + + + + + + + 中间银Squalidus intermedius + + + + + 兴隆山小鳔Microphysogobio hsinglungshanensis + + + + + + + + + 黑鳍鳈Sarcochilichthys nigripinnis + + + + + + + + + + + 棒花Gobio rivuloides + + + + + + + + + + 棒花鱼Abbottina rivularis + + + + + + + + + + + + + 蛇Saurogobio dabryi + + + + 花鳅科Cobitidae 泥鳅Misgurnus anguillicaudatus + + + + + + + + + + + + + + 北方泥鳅Misgurnus bipartitus + 大鳞副泥鳅Paramisgurnus dabryanus + + + + + + 花斑花鳅Cobitis melanoleuca + + + + 条鳅科Nemacheilidae 北鳅Lefua costata + 赛丽高原鳅Triplophysa sellaefer + + + + 尖头高原鳅Triplophysacuneicephala + 达里湖高原鳅Triplophysa dalaica + + + + 合鳃鱼目SymbrancSpformes 刺鳅科Mastacembelidae 刺鳅Sinobdella sinensis + + + + + + + 合鳃鱼科Symbranchidae 黄鳝Monopterus albus + 鲈形目Percoidei 鰕虎鱼科Gobiidae 子陵吻鰕虎鱼Rhinogobius giurinus + + + + 林氏吻鰕虎鱼Rhinogobius lindbergi + + + + + + + + + 波士吻鰕虎鱼Rhinogobius cliffordpopei + + + + + + + 福岛吻鰕虎鱼Rhinogobius fukushimai + + + + + + + 沙塘鳢科Odontobuidae 小黄䱂鱼Micropercops swinhonis + + + + + + + + + + + + + + + 丝足鲈科Osphronemidae 圆尾斗鱼Macropodus chinensis + + + 鲇形目Siluriformes 鲿科Bagridae 黄颡鱼Pelteobagrus fulvidraco + + + + + + + + + + + + + 瓦氏黄颡鱼Pelteobagrus vachellii + + + + 乌苏里黄颡鱼Pelteobagrus ussuriensis + + + + + 鲇科Siluridae 鲇Silurus asotus + + + + + + + 颌针鱼Beloniformes 青鳉科Adrianichthyidae 青鳉Oryzias sinensis + 注: “+”表示现场调查采集到样本Note: “+” represents collected fish species in the surveys -
表 1 外源胆汁酸对鱼类能量代谢和健康状况的主要影响
Table 1 Main effects of exogenous bile acids on energy metabolism and health status of fish
胆汁酸种类
Bile acid物种
Species添加量
Level (mg/kg)饲喂时间(周)
Feeding time (week)作用
Effect参考文献
Reference70.9% 猪脱氧胆酸、8.0%猪胆酸和20.2%鹅脱氧胆酸 大口黑鲈 350 8 增重、提高蛋白转化和抗氧化
能力[10] 牛磺胆酸 虹鳟 2000 7 提高脂肪消化率 [11] 鹅脱氧胆酸 大黄鱼 150—450 10 增重和提高抗氧化能力, 降低肝脂质 [12] 牛磺胆酸 草鱼 80—320 7 改善生长性能、肠道免疫功能及肠道菌群 [13] 69.9%猪脱氧胆、18.9%鹅脱氧胆酸和7.8%猪胆酸 尼罗罗非鱼 50—1350 9 增重、促进脂质代谢 [14] 70.9% 猪脱氧胆酸、8.0%猪胆酸和20.2%鹅脱氧胆酸 鳜 900 8 增重、提高存活率及抗氧化能力, 降低肝脂质, 改善肠道菌群 [15] 牛磺胆酸 珍珠龙胆石
斑鱼300—1500 8 减少肝脏脂质沉积, 减轻炎症反应 [16] 猪脱氧胆酸 红鳍东方鲀 200 8 降低肝脏脂质积累、血清三酰基甘油和胆固醇水平 [17] 69.9%猪脱氧胆、18.9%鹅脱氧胆酸和7.8%猪胆酸 半滑舌鳎 300—900 8 增重、提高存活率、肠道抗氧化能力和免疫力, 改善肠道菌群 [18] 表 2 五种养殖鱼类的胆汁酸成分构成
Table 2 Bile acid composition of five cultured fish species
胆汁酸种类
Bile acid大菱鲆
Scophthalmus maximus[24]草鱼Ctenopharyngodon idellus[25] 虹鳟
Oncorhynchus mykiss[26]鲤
Cyprinus carpio[27]尼罗罗非鱼
Oreochromis nilotica[28]CA √ √ √ √ √ CDCA √ √ √ √ √ GCA √ √ √ √ √ GCDCA √ √ √ √ √ TCA √ √ √ √ √ TCDCA √ √ √ √ √ UDCA GUDCA TUDCA √ DCA √ √ GDCA √ TDCA √ √ HCA √ GHCA √ √ THCA HDCA √ GHDCA THDCA ωMCA √ √ βMCA TβMCA √ √ TωMCA √ √ LCA √ TLCA √ √ GLCA √ √ √ 7,12-KLCA √ √ isoLCA √ ALCA √ ACA √ NCA √ 表 3 不同胆汁酸受体的胆汁酸激动剂及表达组织
Table 3 Bile acid agonists and expression tissues of different bile acid receptors
类型Type 受体Receptor 胆汁酸Bile acid 表达组织Expression tissue 核受体 法尼醇X受体(FXR) CDCA>CA>LCA>DA 肝脏、小肠、髓系细胞、脂肪细胞、骨骼肌 维生素D受体(VDR) LCA 小肠、髓系细胞、内分泌组织、肾脏、皮肤 孕烷X受体(PXR) 3-one LCA、LCA、CDCA、CDA、CA 肝脏、小肠 组成型雄甾烷受体(CAR) CA、6-one LCA 肝脏 肝X受体(LXRs) Hyo-CDA 肝脏、单核细胞/巨噬细胞、脂肪细胞 孤核受体γt (ROR γ t) 3, 12-oxo-LCA 淋巴细胞 膜受体 G蛋白偶联受体5 (TGR5/GPBAR1) LCA>CDA>CDCA>UCDA>CA 小肠、髓系细胞、肝脏、脂肪细胞、胆道、中枢神经系统 VEGF受体 CDCA 胃癌和结肠癌细胞系 甲酰肽受体1 (FMLP) CDCA拮抗剂 巨噬细胞 毒蕈碱受体M2/M3 CDA、LCA 心脏、中枢神经系统 1-磷酸鞘氨醇受体 2 (S1PR2) GCA、TCA、GCDCA、TCDCA、GCDA、TCDA 肝脏 -
[1] Collins S L, Stine J G, Bisanz J E, et al. Bile acids and the gut microbiota: metabolic interactions and impacts on disease [J]. Nature Reviews Microbiology, 2023, 21(4): 236-247. doi: 10.1038/s41579-022-00805-x
[2] Chen L, Jiao T, Liu W, et al. Hepatic cytochrome P450 8B1 and cholic acid potentiate intestinal epithelial injury in colitis by suppressing intestinal stem cell renewal [J]. Cell Stem Cell, 2022, 29(9): 1366-1381. doi: 10.1016/j.stem.2022.08.008
[3] Perino A, Schoonjans K. Metabolic Messengers: bile acids [J]. Nature Metabolism, 2022, 4(4): 416-423. doi: 10.1038/s42255-022-00559-z
[4] Cai J, Sun L, Gonzalez F J. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis [J]. Cell Host & Microbe, 2022, 30(3): 289-300.
[5] Jia W, Li Y, Cheung K C, et al. Bile acid signaling in the regulation of whole body metabolic and immunological homeostasis [J]. Science China Life Sciences, 2023(67): 865-878.
[6] Cai J, Rimal B, Jiang C, et al. Bile acid metabolism and signaling, the microbiota, and metabolic disease [J]. Pharmacology & Therapeutics, 2022(237): 108238.
[7] Yang B, Huang S, Zhao G, et al. Dietary supplementation of porcine bile acids improves laying performance, serum lipid metabolism and cecal microbiota in late-phase laying hens [J]. Animal Nutrition, 2022(11): 283-292.
[8] 葛晓可, 李璐, 马晓娇, 等. 不同油脂水平日粮添加胆汁酸对肉鸡肝脏及其脂代谢的影响 [J]. 江苏农业科学, 2019, 47(21): 236-241. Ge X K, Li L, Ma X J, et al. Effects of adding bile acids to diets with different fat levels on liver and lipid metabolism of broiler chickens [J]. Jiangsu Agricultural Sciences, 2019, 47(21): 236-241.
[9] Song M, Zhang F, Chen L, et al. Dietary chenodeoxycholic acid improves growth performance and intestinal health by altering serum metabolic profiles and gut bacteria in weaned piglets [J]. Animal Nutrition, 2021, 7(2): 365-375. doi: 10.1016/j.aninu.2020.07.011
[10] Guo J L, Kuang W M, Zhong Y F, et al. Effects of supplemental dietary bile acids on growth, liver function and immunity of juvenile largemouth bass (Micropterus salmoides) fed high-starch diet [J]. Fish & Shellfish Immunology, 2020(97): 602-607.
[11] Verdegem M, Weththasinghe P, Schrama J. The effect of dietary non-starch polysaccharide level and bile acid supplementation on fat digestibility and the bile acid balance in rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture, 2020(523): 735174.
[12] Ding T, Xu N, Liu Y, et al. Effect of dietary bile acid (BA) on the growth performance, body composition, antioxidant responses and expression of lipid metabolism-related genes of juvenile large yellow croaker (Larimichthys crocea) fed high-lipid diets [J]. Aquaculture, 2020(518): 734768.
[13] Peng X R, Feng L, Jiang W D, et al. Supplementation exogenous bile acid improved growth and intestinal immune function associated with NF-κB and TOR signalling pathways in on-growing grass carp (Ctenopharyngodon idella): Enhancement the effect of protein-sparing by dietary lipid [J]. Fish & Shellfish Immunology, 2019(92): 552-569.
[14] Jiang M, Wen H, Gou G, et al. Preliminary study to evaluate the effects of dietary bile acids on growth performance and lipid metabolism of juvenile genetically improved farmed tilapia (Oreochromis niloticus) fed plant ingredient‐based diets [J]. Aquaculture Nutrition, 2018, 24(4): 1175-1183. doi: 10.1111/anu.12656
[15] Zhang Y, Feng H, Liang X F, et al. Dietary bile acids reduce liver lipid deposition via activating farnesoid X receptor, and improve gut health by regulating gut microbiota in Chinese perch (Siniperca chuatsi) [J]. Fish & Shellfish Immunology, 2022(121): 265-275.
[16] Xu J, Yao X, Li X, et al. Farnesoid X receptor regulates PI3K/AKT/mTOR signaling pathway, lipid metabolism, and immune response in hybrid grouper [J]. Fish Physiology and Biochemistry, 2022, 48(6): 1521-1538. doi: 10.1007/s10695-022-01130-z
[17] Liao Z, Sun B, Zhang Q, et al. Dietary bile acids regulate the hepatic lipid homeostasis in tiger puffer fed normal or high-lipid diets [J]. Aquaculture, 2020(519): 734935.
[18] Li Y, Wang S, Hu Y, et al. Dietary bile acid supplementation reveals beneficial effects on intestinal healthy status of tongue sole (Cynoglossus semiliaevis) [J]. Fish & Shellfish Immunology, 2021(116): 52-60.
[19] Wang L, Sagada G, Wang C, et al. Exogenous bile acids regulate energy metabolism and improve the health condition of farmed fish [J]. Aquaculture, 2023(562): 738852.
[20] Jia W, Xie G, Jia W. Bile acid–microbiota crosstalk in gastrointestinal inflammation and carcinogenesis [J]. Nature Reviews Gastroenterology & Hepatology, 2018, 15(2): 111-128.
[21] Spinelli V, Lalloyer F, Baud G, et al. Influence of Rouxen-Y gastric bypass on plasma bile acid profiles: a comparative study between rats, pigs and humans [J]. International Journal of Obesity, 2016, 40(8): 1260-1267. doi: 10.1038/ijo.2016.46
[22] Yang T, Shu T, Liu G, et al. Quantitative profiling of 19 bile acids in rat plasma, liver, bile and different intestinal section contents to investigate bile acid homeostasis and the application of temporal variation of endogenous bile acids [J]. The Journal of Steroid Biochemistry and Molecular Biology, 2017(172): 69-78.
[23] Zheng X, Chen T, Jiang R, et al. Hyocholic acid species improve glucose homeostasis through a distinct TGR5 and FXR signaling mechanism [J]. Cell Metabolism, 2021, 33(4): 791-803. doi: 10.1016/j.cmet.2020.11.017
[24] 姚婷, 韦娴, 薛敏, 等. 大菱鲆胆汁和血浆中的胆汁酸轮廓分析 [J]. 动物营养学报, 2020, 32(12): 5816-5826. Yao T, Wei X, Xue M, et al. Contour identification and analysis of bile acids in bile and plasma of Scophthalmus maximus [J]. Journal of Animal Nutrition, 2020, 32(12): 5816-5826.
[25] Xiong F, Wu S G, Zhang J, et al. Dietary bile salt types influence the composition of biliary bile acids and gut microbiota in grass carp [J]. Frontiers in Microbiology, 2018(9): 2209.
[26] Staessen T W, Verdegem M C, Nederlof M A, et al. Effect of type of dietary non-protein energy source (starch vs. fat) on the body bile acid pool size and composition, faecal bile acid loss and bile acid synthesis in rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture Nutrition, 2021, 27(3): 865-879. doi: 10.1111/anu.13231
[27] Wei X, Yao T, Fall F N, et al. An integrated bile acids profile determination by UHPLC-MS/MS to identify the effect of bile acids supplement in high plant protein diet on common carp (Cyprinus carpio) [J]. Foods, 2021, 10(10): 2465. doi: 10.3390/foods10102465
[28] 李淼. 蜡样芽孢杆菌调节罗非鱼免疫及脂代谢的机制探究 [D]. 上海: 华东师范大学, 2022: 11-14. Li M. Mechanisms of Bacillus cereus on regulating immunity and lipid metabolism in Nile tilapia [D]. Shanghai: East China Normal University, 2022: 11-14.
[29] Chiang J Y. Recent advances in understanding bile acid homeostasis [J]. F1000Research, 2017: 6.
[30] Chiang J Y. Bile acid metabolism and signaling in liver disease and therapy [J]. Liver Research, 2017, 1(1): 3-9. doi: 10.1016/j.livres.2017.05.001
[31] Tian J J, Jin Y Q, Yu E M, et al. Farnesoid X receptor is an effective target for modulating lipid accumulation in grass carp, Ctenopharyngodon idella [J]. Aquaculture, 2021(534): 736248. doi: 10.1016/j.aquaculture.2020.736248
[32] Wu K, Zhao T, Hogstrand C, et al. FXR-mediated inhibition of autophagy contributes to FA-induced TG accumulation and accordingly reduces FA-induced lipotoxicity [J]. Cell Communication and Signaling, 2020(18): 1-16.
[33] Ji K, Liang H, Ren M, et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels [J]. Fish & Shellfish Immunology, 2020(105): 126-134.
[34] Liu D, Han C, Wan H, et al. Effects of inhibiting PI3K-Akt-mTOR pathway on lipid metabolism homeostasis in goose primary hepatocytes [J]. Animal, 2016, 10(8): 1319-1327. doi: 10.1017/S1751731116000380
[35] Saxton R A, Sabatini D M. mTOR signaling in growth, metabolism, and disease [J]. Cell, 2017, 168(6): 960-976. doi: 10.1016/j.cell.2017.02.004
[36] Ricoult S J, Yecies J L, Ben-Sahra I, et al. Oncogenic PI3K and K-Ras stimulate de novo lipid synthesis through mTORC1 and SREBP [J]. Oncogene, 2016, 35(10): 1250-1260. doi: 10.1038/onc.2015.179
[37] Liang H, Yang X, Li H, et al. Schisandrol B protects against cholestatic liver injury by inhibiting pyroptosis through pregnane X receptor [J]. Biochemical Pharmacology, 2022(204): 115222.
[38] Little M, Dutta M, Li H, et al. Understanding the physiological functions of the host xenobiotic-sensing nuclear receptors PXR and CAR on the gut microbiome using genetically modified mice [J]. Acta Pharmaceutica Sinica B, 2022, 12(2): 801-820. doi: 10.1016/j.apsb.2021.07.022
[39] Hu J, Tian J, Zhang F, et al. Pxr-and Nrf2-mediated induction of ABC transporters by heavy metal ions in zebrafish embryos [J]. Environmental Pollution, 2019(255): 113329.
[40] 马军国, 周春娥, 李效宇. 咪唑类离子液体处理对草鱼 CYP3A 和 PXR 基因表达的影响 [J]. 水生态学杂志, 2013, 34(6): 70-75. doi: 10.3969/j.issn.1674-3075.2013.06.012 Ma J G, Zhou C E, Li X Y. Effects of the treatment of imidazolium ionic liquids on gene expression of cytochrome P450 3A and pregrane X receptor (PXR) in Ctenopharyngodon idellus [J]. Journal of Aquatic Ecology, 2013, 34(6): 70-75. doi: 10.3969/j.issn.1674-3075.2013.06.012
[41] Lieu T, Jayaweera G, Zhao P, et al. The bile acid receptor TGR5 activates the TRPA1 channel to induce itch in mice [J]. Gastroenterology, 2014, 147(6): 1417-1428. doi: 10.1053/j.gastro.2014.08.042
[42] Perino A, Velazquez-Villegas L A, Bresciani N, et al. Central anorexigenic actions of bile acids are mediated by TGR5 [J]. Nature Metabolism, 2021, 3(5): 595-603. doi: 10.1038/s42255-021-00398-4
[43] Keitel V, Gertzen C G, Spomer L, et al. TGR5 (GPBAR1) in the liver [J]. The Liver:Biology and Pathobiology, 2020(24): 286-298.
[44] Biagioli M, Carino A, Cipriani S, et al. The bile acid receptor GPBAR1 regulates the M1/M2 phenotype of intestinal macrophages and activation of GPBAR1 rescues mice from murine colitis [J]. The Journal of Immunology, 2017, 199(2): 718-733. doi: 10.4049/jimmunol.1700183
[45] Fiorucci S, Biagioli M, Zampella A, et al. Bile acids activated receptors regulate innate immunity [J]. Frontiers in Immunology, 2018(9): 1853.
[46] 杨修利, 田思聪, 庞博, 李宝龙, 单毓娟. 以FXR为核心的胆汁酸代谢机制研究进展 [J]. 生物医学, 2018, 8(4): 62-68. doi: 10.12677/HJBM.2018.84008 Yang X L, Tian S C, Pang B, et al. Advanced progression in the mechanism of bile acid metabolism targeting FXR [J]. Hans Journal of Biomedicine, 2018, 8(4): 62-68. doi: 10.12677/HJBM.2018.84008
[47] 叶倩伶, 王明刚, 毛德文, 等. 胆汁酸在肝肠循环中的作用及中药参与其调控的相关机制 [J]. 临床肝胆病杂志, 2020, 36(11): 2617-2620. doi: 10.3969/j.issn.1001-5256.2020.11.050 Ye Q L, Wang M G, Mao D W, et al. Role of bile acids in enterohepatic circulation and mechanism of action of traditional Chinese medicine in regulating bile acids [J]. Journal of Clinical Hepatology, 2020, 36(11): 2617-2620. doi: 10.3969/j.issn.1001-5256.2020.11.050
[48] 朱龙, 程洁, 王竹青, 等. 胆汁酸对加州鲈生长性能、形体指数及肌肉营养成分的影响 [J]. 中国饲料, 2017(1): 28-32. Zhu L, Cheng J, Wang Z Q, et al. Effects of bile acids on growth performance, body shape index and muscle nutritional components of California seabass [J]. China Feed, 2017(1): 28-32.
[49] Gu H, An H J, Gwon M G, et al. The effects of synthetic srebp-1 and ppar-γ decoy oligodeoxynucleotide on acne-like disease in vivo and in vitro via lipogenic regulation [J]. Biomolecules, 2022, 12(12): 1858. doi: 10.3390/biom12121858
[50] Kim H, Fang S. Crosstalk between FXR and TGR5 controls glucagon-like peptide 1 secretion to maintain glycemic homeostasis [J]. Laboratory Animal Research, 2018(34): 140-146.
[51] Duboc H, Taché Y, Hofmann A F. The bile acid TGR5 membrane receptor: from basic research to clinical application [J]. Digestive and Liver Disease, 2014, 46(4): 302-312. doi: 10.1016/j.dld.2013.10.021
[52] Trabelsi M S, Daoudi M, Prawitt J, et al. Farnesoid X receptor inhibits glucagon-like peptide-1 production by enteroendocrine L cells [J]. Nature Communications, 2015, 6(1): 7629. doi: 10.1038/ncomms8629
[53] Ploton M, Mazuy C, Gheeraert C, et al. The nuclear bile acid receptor FXR is a PKA-and FOXA2-sensitive activator of fasting hepatic gluconeogenesis [J]. Journal of Hepatology, 2018, 69(5): 1099-1109. doi: 10.1016/j.jhep.2018.06.022
[54] Parlar Y E, Ayar S N, Cagdas D, et al. Liver immunity, autoimmunity, and inborn errors of immunity [J]. World Journal of Hepatology, 2023, 15(1): 52. doi: 10.4254/wjh.v15.i1.52
[55] Hang S, Paik D, Yao L, et al. Bile acid metabolites control TH17 and Treg cell differentiation [J]. Nature, 2019, 576(7785): 143-148. doi: 10.1038/s41586-019-1785-z
[56] Li W, Hang S, Fang Y, et al. A bacterial bile acid metabolite modulates Treg activity through the nuclear hormone receptor NR4A1 [J]. Cell Host & Microbe, 2021, 29(9): 1366-1377.
[57] Bai X, Liu P, Shen H, et al. Water-extracted Lonicera japonica polysaccharide attenuates allergic rhinitis by regulating NLRP3-IL-17 signaling axis [J]. Carbohydrate Polymers, 2022(297): 120053.
[58] Fiorucci S, Carino A, Baldoni M, et al. Bile acid signaling in inflammatory bowel diseases [J]. Digestive Diseases and Sciences, 2021(66): 674-693.
[59] Calzadilla N, Comiskey S M, Dudeja P K, et al. Bile acids as inflammatory mediators and modulators of intestinal permeability [J]. Frontiers in Immunology, 2022(13): 1021924.
[60] Awad E, Awaad A. Role of medicinal plants on growth performance and immune status in fish [J]. Fish & Shellfish Immunology, 2017(67): 40-54.
[61] 何杰. 饲料添加胆汁酸对异育银鲫生长、氧化损伤修复、内源胆汁酸代谢以及CyHV-2免疫保护作用的影响 [D]. 苏州: 苏州大学, 2018: 57. He J. The effects of bile acids supplementation on the growth, oxidative damagerepair, endogenous bile acid metabolism, and CyHV-2 immune protectionof allogyogenetics silver crucian carp Carassius auratus gibelio [D]. Suzhou: Suzhou University, 2018: 57.
[62] Yin P, Xie S, Zhuang Z, et al. Dietary supplementation of bile acid attenuate adverse effects of high-fat diet on growth performance, antioxidant ability, lipid accumulation and intestinal health in juvenile largemouth bass (Micropterus salmoides) [J]. Aquaculture, 2021(531): 735864.
[63] Zhang Y, Liang X F, He S, et al. Effects of long-term low-concentration nitrite exposure and detoxification on growth performance, antioxidant capacities, and immune responses in Chinese perch (Siniperca chuatsi) [J]. Aquaculture, 2021(533): 736123.
[64] Hou Y, Hou Y, Yao L, et al. Effects of chromium yeast, tributyrin and bile acid on growth performance, digestion and metabolism of Channa argus [J]. Aquaculture Research, 2019, 50(3): 836-846. doi: 10.1111/are.13954
[65] De Vos W M, Tilg H, Van Hul M, et al. Gut microbiome and health: mechanistic insights [J]. Gut, 2022, 71(5): 1020-1032. doi: 10.1136/gutjnl-2021-326789
[66] De Aguiar Vallim T Q, Tarling E J, Edwards P A. Pleiotropic roles of bile acids in metabolism [J]. Cell Metabolism, 2013, 17(5): 657-669. doi: 10.1016/j.cmet.2013.03.013
[67] Ridlon J M, Alves J M, Hylemon P B, et al. Cirrhosis, bile acids and gut microbiota: unraveling a complex relationship [J]. Gut Microbes, 2013, 4(5): 382-387. doi: 10.4161/gmic.25723
[68] Devkota S, Wang Y, Musch M W, et al. Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10−/− mice [J]. Nature, 2012, 487(7405): 104-108. doi: 10.1038/nature11225
[69] Veeravalli S, Mathews A P. Continuous fermentation of xylose to short chain fatty acids by Lactobacillus buchneri under low pH conditions [J]. Chemical Engineering Journal, 2018(337): 764-771.
[70] Zhang Y, Liang X-F, He S, et al. Effects of high carbohydrate diet-modulated microbiota on gut health in Chinese perch [J]. Frontiers in Microbiology, 2020(11): 575102.
[71] Urdaneta V, Casadesús J. Interactions between bacteria and bile salts in the gastrointestinal and hepatobiliary tracts [J]. Frontiers in Medicine, 2017(4): 163.
-
期刊类型引用(4)
1. 金禹成,王晓玲,秦瑜,肖满义,周禹廷,祝贵兵. 拒马河沉积物N_2O产生潜势、途径与微生物群落结构的研究. 环境科学学报. 2024(08): 311-322 .  百度学术
百度学术
2. 李君轶,吴金明,杜浩,张辉,邵俭,危起伟. 嘉陵江源鱼类群落结构特征与环境因子的关系. 淡水渔业. 2024(05): 24-32 .  百度学术
百度学术
3. 康玲玲,马超,孙光,盛祥锐,韩静,罗遵兰. 潮白河怀柔段鱼类多样性特征及水生态系统健康评价. 环境科学研究. 2024(10): 2214-2224 .  百度学术
百度学术
4. 杨姣姣,陈冬,黄立成,李杨,董晋延,黄超,王纯波,刘永定,杜劲松,潘珉. 滇池不同湖区浮游动物群落稳定性及其驱动因子分析. 湖泊科学. 2023(05): 1752-1766 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载: