ANTIOXIDANT AND NON-SPECIFIC IMMUNE RESPONSES OF FOUR SPECIES OF FISH LARVAE UNDER AMMONIA STRESS
-
摘要: 为探究氨氮胁迫对不同食性鱼类的影响, 研究选取不同食性的4种鱼类(鲢Hypophthalmichthys molitrix、草鱼Ctenopharyngodon idella、团头鲂Megalobrama amblycephala和黄颡鱼Pelteobagrus fulvidraco)仔鱼为研究对象, 探讨不同浓度氨氮(0、1、2和3 mg/L)短期胁迫(96h)对其生长、抗氧化和非特异性免疫响应的影响及其分子机制。结果显示: (1)氨氮胁迫导致4种仔鱼的体长生长速度呈现剂量依赖性减缓; (2)不同浓度氨氮导致4种仔鱼体内T-AOC、CAT和GPx含量显著降低(P<0.05), 2和3 mg/L氨氮暴露显著降低了草鱼、团头鲂和黄颡鱼仔鱼体内SOD活力(P<0.05), 仅检测到黄颡鱼gpx及鲢sod转录水平出现显著性下调(P<0.05); (3)在不同浓度氨氮胁迫下, 4种仔鱼相关免疫基因转录水平均呈现一定的上调, 仅鲢il1β转录水平显著下降(P<0.05), 相对地草鱼仔鱼LYZ含量显著性下降, 黄颡鱼仔鱼LYZ含量在2 mg/L氨氮组显著性上升(P<0.05)。双因素方差分析显示, 氨氮对所有抗氧化酶、免疫指标及免疫相关基因有显著影响, 不同种仔鱼之间T-AOC、CAT、GPx和C3及基因cuznsod、gpx、il1β和c3之间差异显著(P<0.05), 但鱼种和氨氮互作效应仅对C3和基因gpx、tnfα、il1β、c3影响显著(P<0.05)。研究表明, 高浓度氨氮急性胁迫引起仔鱼生长迟缓和氧化应激, 降低了其抗氧化性能, 削弱了其非特异免疫防御机能。相比较而言, 肉食性的黄颡鱼仔鱼对氨氮的耐受性较其他几种仔鱼弱, 草食性的团头鲂和草鱼仔鱼居中, 而鲢仔鱼对氨氮的耐受性较强。Abstract: Ammonia, a ubiquitous pollutant in the aquatic system, has been proved to be high toxic to fish. The early life state of fish is acturally more sensitive to the influence of external environmental factors than adult fish since its antioxidant and immune systems are in lower level. However, there are limited information on difference responses of different species of fish larvae to ammonia stress. Aim to explore the effects of ammonia on the antioxidant and non-specific immune response of different species of fish larvae, four different feed-habits species of fish larvae (omnivory silver carp Hypophthalmichthys molitrix, herbivorous grass carp Ctenopharyngodon idella, Wuchang bream Megalobrama amblycephala and predacity yellow catfish Pelteobagrus fulvidraco) were selected and exposed to different concentrations of total ammonia nitrogen (0, 1 mg/L, 2 mg/L and 3 mg/L) for 96h. The results showed that acute ammonia exposue caused significant decrease of body length on four species of fish larvae in a dependent-concentration manner (P<0.05). Meantime, ammonia exposure significant decreased levels of total antioxidant capacity (T-AOC), catalase (CAT) and glutathione peroxidase (GPx) in four species of fish larvae (P<0.05). Also, 2 and 3 mg/L ammonia significantly reduced the activities of superoxde dismutase (SOD) in the larves of grass carp, Wuchang bream and yellow catfish (P<0.05). As for antioxidative-related genes, significant decrease of transcriptional levels were only detected in yellow catfish gpx and silver carp sod after ammonia exposure (P<0.05). In terms of immune parmameters, ammonia exposure significantly up-regulated transcriptional levels of immune-related genes in four species of fish larvae except silver carp interleukin1β (il1β) (P<0.05). By contrast, significant decrease of lysozyme contents were observed in grass carp larvae after ammonia exposure, and significant increase of lysozyme contents were detected in yellow catfish larvae exposed to 2 mg/L ammonia (P<0.05). The results of two-way ANOVA also confirmed that ammonia could caused to varying degree changes for all parameters including antioxidant enzymes, immune indexes and immune-related gene expression in four species of fish larvae (P<0.05). There were significant differences on levels of T-AOC, CAT, GPx, C3 and the gene expression levels of cuznsod, gpx, il1β, c3 among four species of fish larvae. However, interactive effects of ammonia and species were only observed on C3 contents and the expression of genes gpx, tnfα, il1β and c3 (P<0.05). In summary, ammonia exposure caused oxidative stress, decreased the antioxidant capacities and disturbed innate immune responses in four species of fish larvae, which led to growth retardation. Among four species of fish larvae, the predacity yellow catfish was the weakest to ammonia tolerance, the herbivorous Wuchang bream and grass carp is the next, and omnivory silver carp were the strongest.
-
Keywords:
- Ammonia-nitrogen exposure /
- Feeding habits /
- Larvae /
- Oxidative stress /
- Tolerance /
- Non-specific immune
-
近年来, 我国极为重视水产养殖环境污染和发展之间关系, 并以绿色发展为理念, 积极通过实施“五大行动”推进水产绿色健康养殖。氨氮是鱼类蛋白质分解代谢的最终产物, 主要通过鳃排泄到周围环境中[1-3]。水体中氨氮以离子氨(NH4+)和非离子氨(NH3)两种形式存在, 其中, NH3具有很好的脂溶性, 能够自由地穿过生物膜, 对鱼类毒性较大; 而NH4+只能通过离子交换进入生物体内, 对鱼类的毒性相对较小[4]。随着集约化养殖的发展, 大量残饵及粪便在水体中积累并转化为氨氮, 使得养殖环境中氨氮含量迅速升高。高浓度的氨氮对鱼类的发育、生长和繁殖造成严重威胁, 特别是在鱼类的早期生长阶段[5-7]。为解决氨氮对水产绿色健康养殖发展的制约, 氨氮胁迫对鱼类应激和健康的影响越来越受到人们的关注。
氨氮最先通过鳃上皮细胞进入鳃组织, 使鳃组织严重病变, 导致鳃组织出现坏死、溶血、血红蛋白缺乏、耗氧量减少和呼吸障碍[8, 9]。进入体内的氨氮可以直接影响生物体内物质代谢以及损伤神经系统, 从而引起应激反应影响机体的健康[3, 10, 11]。氨氮也可影响细胞内的NO和Ca2+浓度, 导致自由基的产生, 进而使得DNA和类固醇组件损伤、酶失活和脂质过氧化等, 最终造成生物体各种生理病变[12-16]。近年来研究表明, 氨氮对鱼类抗氧化系统的影响根据鱼种类和氨暴露浓度不同而有所差异: 氨氮暴露会导致鱼类体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)活性激活, 抵抗氨氮氧化胁迫[17-20]; 氨氮暴露也可抑制鱼体抗氧化系统, 使得SOD和CAT活力随着氨氮浓度的升高而下降[21]。此外, 当鱼类处于应激状态, 其特异性和非特异性免疫防御体系的功能也会受到不同程度的影响, 导致机体对各类病原敏感性的升高[22-25]。大菱鲆(Scophthalmus maximus)幼鱼在氨氮暴露后, 肿瘤坏死因子α(TNFα)和白细胞介素1β(IL1β)基因表达水平均显著性上调, 溶菌酶(LYZ)表达水平显著性下调, 干扰先天性免疫反应[26]。相似地, 氨氮暴露可诱导河豚(Takifugu obscurus)肝脏中B细胞因子、tnfα、il-6和il-12的转录表达水平升高[27]。氨氮暴露也可以提高鱼体内LYZ活力和补体(C3, C4)含量以及免疫球蛋白水平, 促进机体免疫应答[28, 29]。综上所述, 氨氮作为重要的水环境因子, 其对鱼类抗氧化系统和免疫系统的危害不可忽视。鱼类早期的生命阶段比成鱼对外界环境因子的影响更加敏感, 特别是其抗氧化和免疫系统还处于较低水平[30]。然而, 目前关于氨氮对鱼类的抗氧化和免疫的影响主要集中在幼鱼和成鱼阶段, 关于刚孵化出膜的仔鱼对氨氮胁迫响应机制的研究还非常缺乏, 特别是不同种类的仔鱼暴露在氨氮环境中响应差异的研究。
鲢(Hypophthalmichthys molitrix)、草鱼(Ctenopharyngodon idella)、团头鲂(Megalobrama amblycephala)和黄颡鱼(Pelteobagrus fulvidraco)都是我国重要的经济养殖鱼类, 它们因其肉质鲜美、生长速度快、经济价值高而受到人民的青睐, 其人工繁殖对满足水产养殖需求至关重要[31]。其中, 鲢为滤食杂食性, 产漂流性卵; 草鱼和团头鲂均为草食性, 但草鱼产漂流性卵, 团头鲂产黏性卵; 黄颡鱼为肉食性, 产沉性卵。由于它们的食性不同, 使得它们成为开展本研究绝佳的实验对象。本研究从免疫与抗氧化的角度, 探讨氨氮对鲢、草鱼、团头鲂和黄颡鱼仔鱼氧化应激和免疫的影响及其分子机制的差异, 以期探究鱼类早期发育过程中的氧化应激和免疫系统在鱼类抵抗外源环境因子影响中的响应模式, 为全面评估和解析氨氮对鱼类的危害以及苗种培育技术提升提供一定的理论依据。
1. 材料与方法
1.1 实验材料
鲢、草鱼、团头鲂和黄颡鱼仔鱼(出膜后24h)由湖南省田家湖渔业科技有限责任公司提供; 实验所用的塑料鱼缸(32 cm×22 cm×17 cm)和培养皿(直径10 cm)购自武汉迪跃生物; 游标卡尺(0—150 mm, 上海恒量量具有限公司); HQ40D水质分析仪(哈希, 美国); 总蛋白浓度, 补体C3、溶菌酶(LYZ)、总抗氧化能力(T-AOC)、丙二醛(MDA)的含量及谷胱甘肽过氧化物酶(GPx)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活力所用检测试剂盒购自南京建成生物工程研究所; TRIzol试剂购自TaKaRa(中国大连); Hifair® Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digeater plus)和HifairTM qPCR SYB® Green Mater Mix (No Rox)的试剂盒购自上海翊圣生物科技有限公司。氯化铵(NH4Cl, 国药, 99.5%), MS-222购自Sigma-Aldrich公司(美国), 其他所用试剂均为分析纯。
1.2 半致死浓度测定
半致死浓度(LC50)测定实验在湖南省华容县田家湖渔业科技有限责任公司进行。选用基地驯化多年的成鱼亲本(鲢、草鱼、团头鲂和黄颡鱼)分别进行人工催产受精, 采集同一批健康孵化出膜的仔鱼作为实验对象。制备1 g/L的氨标准储备液(氯化铵配制), 分别稀释成1、2、4、6、8 和10 mg/L共6个浓度组的氨氮溶液(以总氨氮计), 对照组为24h曝气自来水。半致死浓度测定选用直径100 mm培养皿, 每个培养皿放入100条仔鱼, 每个浓度5个平行, 分别在暴露前(0)和暴露后3h、6h、12h、24h、48h、72h和96h记录各个浓度组的死亡数量, 最后利用SPSS 22.0计算半致死浓度。
1.3 氨氮暴露实验
根据半致死浓度结果, 设置1个对照组和3个暴露组, 氨氮浓度分别为0 (24h 曝气自来水), 1 mg/L (25% LC50), 2 mg/L (50% LC50), 3 mg/L (75% LC50), 每个浓度组3个平行培养缸。每个缸放入1500条鱼苗, 暴露96h后进行样品的采集, 实验期间每24h更换相同浓度的NH4Cl溶液, 使浓度保持在设置浓度的±20%以内, 并每隔3h查看, 及时利用胶头滴管吸出死亡的鱼苗, 防止污染实验缸水环境。实验期间鲢和草鱼水温为(24±0.2)℃, 团头鲂和黄颡鱼水温为(25.1±0.2)℃左右, 溶解氧均>5 mg/L, pH为8.8±0.2, 根据Emerson等[32]描述的方法计算实际水体中非离子氨(NH3)浓度:
非离子氨(NH3)=总氨氮/[1+10(pKa-pH)]
式中, pKa=0.09018+2729.92/T(T=273+t℃)。
采集样品前用浓度为200 mg/L的MS-222麻醉实验仔鱼, 每个浓度组随机取40尾仔鱼利用游标卡尺测量体长。对每个浓度组, 随机选取200条仔鱼混合在一起作为1个平行样, 液氮速冻后保存于–80℃用作酶活性和蛋白含量检测, 共6个平行; 随机选取20条仔鱼混在一起作为1个平行样, 放入液氮速冻后保存于–80℃冰箱中保存, 用于RNA提取和基因表达测定, 共6个平行。
1.4 抗氧化和免疫指标测定
采用南京建成生物工程研究所生化试剂盒测定匀浆中补体C3、LYZ、T-AOC、MDA的含量及GPx、SOD和CAT的活力。
1.5 基因表达水平测定
采用RNAiso Plus试剂(TaKaRa, 大连)提取总RNA, 利用PrimeScriptTM RT Reagent Kit with gDNA Eraser (TaKaRa, 大连)反转录成cDNA, 用于实时荧光定量PCR分析。qPCR的引物序列运用Primer Premier 5.0软件设计和参考相关文献(表 1)。根据试剂盒操作说明, 利用SYBR Premix Ex TaqⅡ(TaKaRa, 大连)进行qPCR反应, 扩增程序为: 95℃预变性5min, 然后变性95℃ 10s, 退火58℃ 20s, 延伸72℃ 20s, 共40个循环。实验采用 β-actin作为内参基因, 2–∆∆Ct方法计算相对表达量(R)[33]。
表 1 实时荧光定量PCR引物序列Table 1. Primer sequences for qPCR鱼种
Species目的基因
Target gene引物序列
Primer sequences (5′—3′)登录号/参考文献
Accession number/Reference草鱼
C. i.白细胞介素1β(il1β) CACAACCTTCCCACCAAT
GCCGTGCTAATAAACCATCJQ692172 肿瘤坏死因子α (tnfα) GGAGACAAACTGCTCACCGA
TGACTGCAGTGGAAGCTCAGHQ696609 补体3(c3) ACGGCCTTTGTTGTGATTGC
TTGGTCAGTCGTGGAAGTCGAY374472 过氧化氢酶(cat) GAAGTTCTACACCGATGAGG
CCAGAAATCCCAAACCATFJ560431 谷胱甘肽过氧化物酶(gpx) GGGCTGGTTATTCTGGGC
AGGCGATGTCATTCCTGTTCEU828796 铜锌超氧化物歧化酶(cuznsod) TTGGAGACAATACAAATGGGTG
CATCGGAATCGGCAGTCAGU901214 肌动蛋白(β-actin) CTCGCTCTGCAGGTATGGAG
TTCATTGTGCTAGGGGCCAGM25013 鲢
H. m.白细胞介素1β(il1β) TCTGATGAGATGGGCTGCTC
CTGGCACATTTCCACCTGCTC[34] 肿瘤坏死因子α (tnfα) CAAACCGGAGACAGACTGCT
TTGCAGTGGAAGCTCAGGAGFJ913063 补体3(c3) CGCTTGTGAAGGCCAAAGAC
CCTGTGTGGTACCAGAACCGAM773827 过氧化氢酶(cat) TGAGTCTGGGTCGGCAGATA
TCCGGATCCTTCAGGTGAGTHM230689 谷胱甘肽过氧化物酶(gpx) GAGCCCAAATCCCAGCTTCT
CGGGCCAATGAGGAACTTCTEU108012 铜锌超氧化物歧化酶(cuznsod) TCTCGGGTGAAATCACTGGC
TGATGCAGCCGTTTGTGTTGHM469964 肌动蛋白(β-actin) TGGATCGGAGGTTCCATCCT
TGGTCCAGACTCGTCGTACTAF301605 团头鲂
M. a.白细胞介素1β (il1β) ACGATAAGACCAGCACGACC
CTGTTTCCGTCTCTCAGCGTKF515511 肿瘤坏死因子α (tnfα) TCCAAGGCAGCCATCCATTT
GCCTGAAGAGAAAGCCTGGTKF515512 补体3(c3) ACGGCCTTTGTTGTGATTGC
CGTCATCGCAACAGCGTAAGKP192115 过氧化氢酶(cat) GTTTCCGTCCTTCATCCACTCT
GACCAGTTTGAAAGTGTGCGATKF378714 谷胱甘肽过氧化物酶(gpx) CTTTTGTCCTTGAAGTATGTCC CTTGAGGAAGACGAAGAGAGGG KF378713 铜锌超氧化物歧化酶(cuznsod) TCAGCGTGAACCATCCACAA
GACAACAGACCGGCCAAGTAKF479046 肌动蛋白(β-actin) ACCCACACCGTGCCCATCTA
CGGACAATTTCTCTTTCGGCTGAY170122 黄颡鱼
P. f.白细胞介素1β (il1β) TGGAATGGAGCGCTTCCTTT
GAACCAGCCCGGGTATTTCAJQ730738 肿瘤坏死因子α(tnfα) ATCAGGTGAACGCTGATGCT
GTGTTGAGGGAAGGGGTCTGXM027141814 补体3(c3) GGTGTCGGAAGGTGTGCTAA
CTGACCAGCCACCATGATGTXM027136454 过氧化氢酶(cat) AAGGCAACCCTGTCTACTGC
TTGTACAGGTCACGGATGGCKX455919 谷胱甘肽过氧化物酶(gpx) TATGACCTGCGTGCTACCAC
TGGTGCCTCATAGTGATGCCXM027155811 铜锌超氧化物歧化酶(cuznsod) TTGGAGACAATACAAATGGGTG
CATCGGAATCGGCAGTCAXM027176836 肌动蛋白(β-actin) GTACCACCATGTACCCTGGC
GTGCCTTTCATTCAGCCACCEU161065 1.6 数据分析与处理
实验数据采用使用SPSS 22.0(Chicago, USA)对体长指标进行单因素方差分析(One-Way ANOVA), 随后采用Duncan进行多重比较。采用双因素方差分析(Two-Way ANOVA)方法对实验中其他数据(T-AOC、MDA、SOD、CAT、GPx、LYZ、C3及相关的基因)进行分析, 随后采用Duncan进行多重比较, 差异显著水平均设为P<0.05。
2. 结果
2.1 四种仔鱼氨氮的半致死浓度
经SPSS分析, 鲢仔鱼96h总氨暴露的LC50为4.089 mg/L (NH3为0.697 mg/L), 草鱼仔鱼为4.276 mg/L (NH3为0.801 mg/L), 团头鲂仔鱼为3.718 mg/L (NH3为1.142 mg/L), 黄颡鱼仔鱼为3.699 mg/L (NH3为1.136 mg/L)。
2.2 氨氮暴露对4种仔鱼的体长的影响
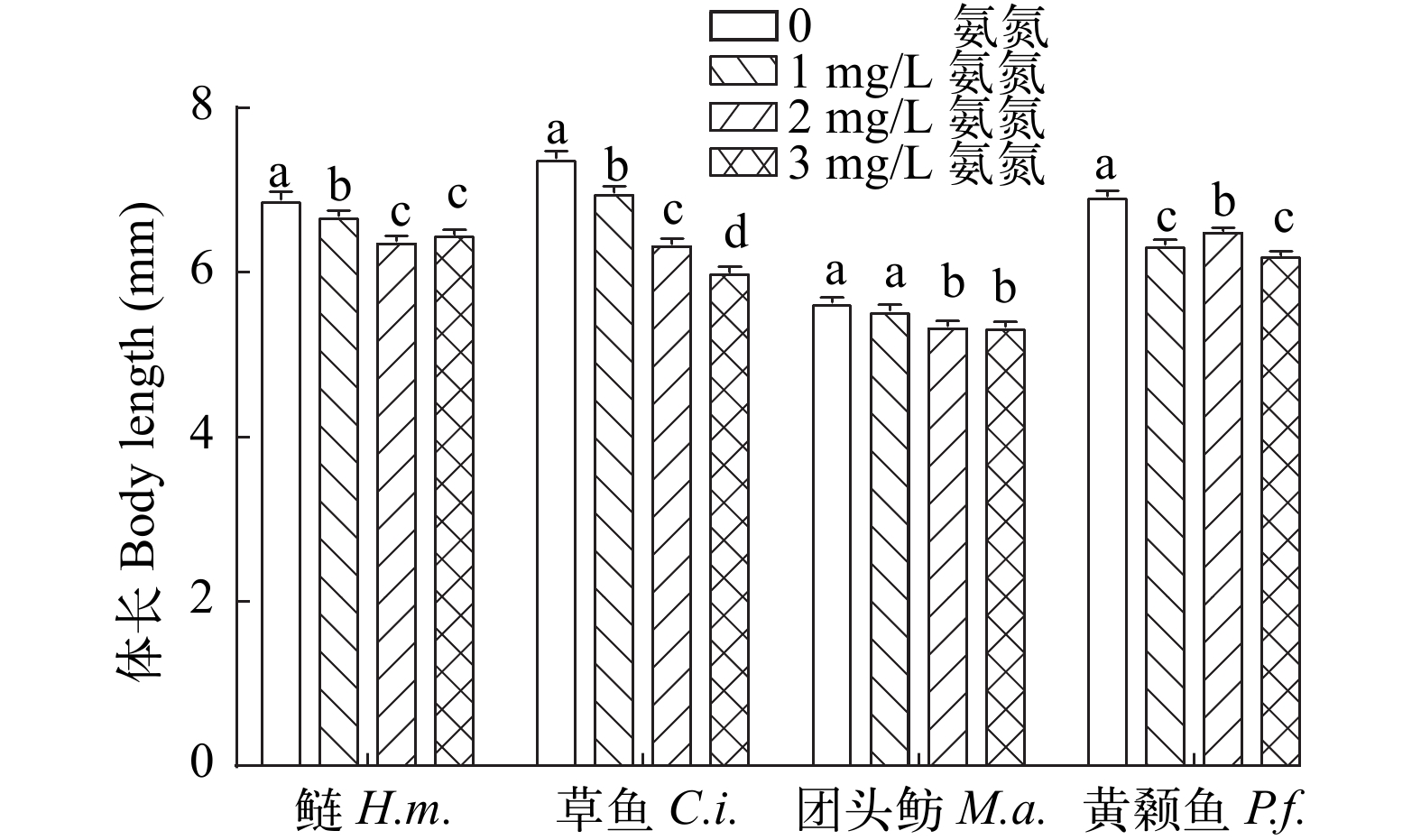
在氨氮暴露后, 4种不同鱼类仔鱼的体长随着氨氮暴露浓度增加而降低(图 1)。与对照组相比, 所有氨氮暴露组中鲢、草鱼和黄颡鱼仔鱼体长均显著降低(P<0.05), 其最高降幅依次为7.31%、18.71%和10.32%; 而团头鲂仔鱼体长显著降低仅出现在2和3 mg/L氨氮处理组(P<0.05), 最高下降了5.22%。
![]() 图 1 氨氮暴露对4种仔鱼体长的影响结果以均值±标准误(n=40)的形式表示, 不同字母代表组间差异显著(P<0.05); 下同Figure 1. Effects of total ammonia nitrogen on body length of four species of fish larvaeData are shown as mean±SE (n=40), different small letters mean significant differences among different treatment groups (P<0.05). The same applies below
图 1 氨氮暴露对4种仔鱼体长的影响结果以均值±标准误(n=40)的形式表示, 不同字母代表组间差异显著(P<0.05); 下同Figure 1. Effects of total ammonia nitrogen on body length of four species of fish larvaeData are shown as mean±SE (n=40), different small letters mean significant differences among different treatment groups (P<0.05). The same applies below2.3 氨氮对4种仔鱼氧化和抗氧化指标的影响
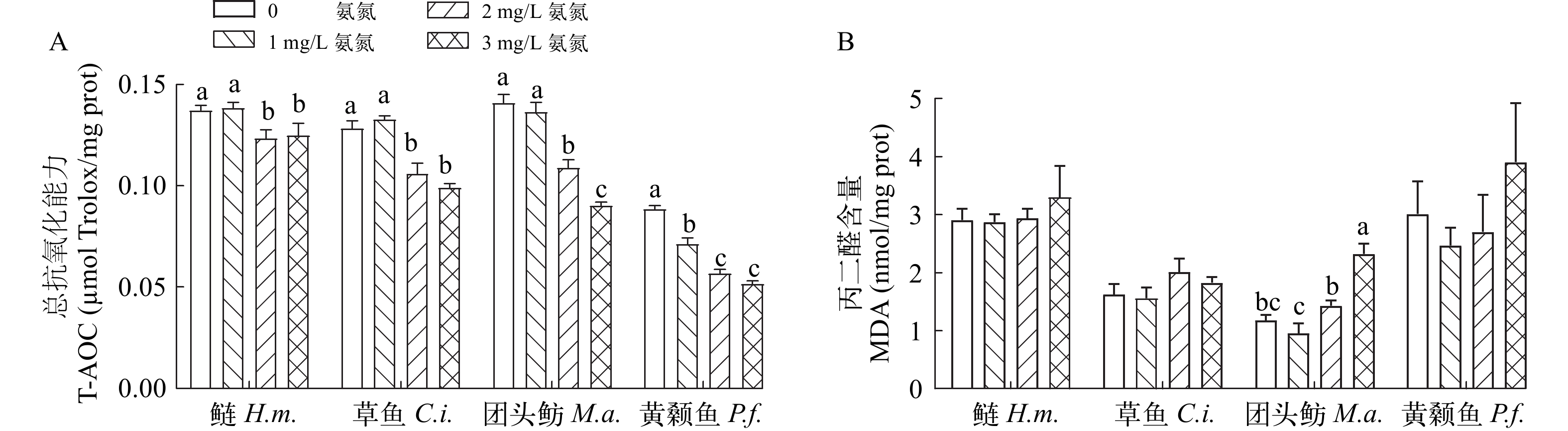
氨氮暴露导致4种不同鱼类仔鱼的T-AOC活力降低(图 2A)。与对照组相比, 2和3 mg/L氨氮胁迫导致鲢仔鱼、草鱼仔鱼和团头鲂仔鱼的T-AOC显著降低(P<0.05), 其最高降幅分别为9.02%、17.36%和22.62%; 所有氨氮处理组中黄颡鱼仔鱼T-AOC均显著降低(P<0.05), 最高下降了19.43%。相对地, 氨氮暴露仅导致团头鲂仔鱼体内MDA含量显著性升高(P<0.05; 图 2B)。
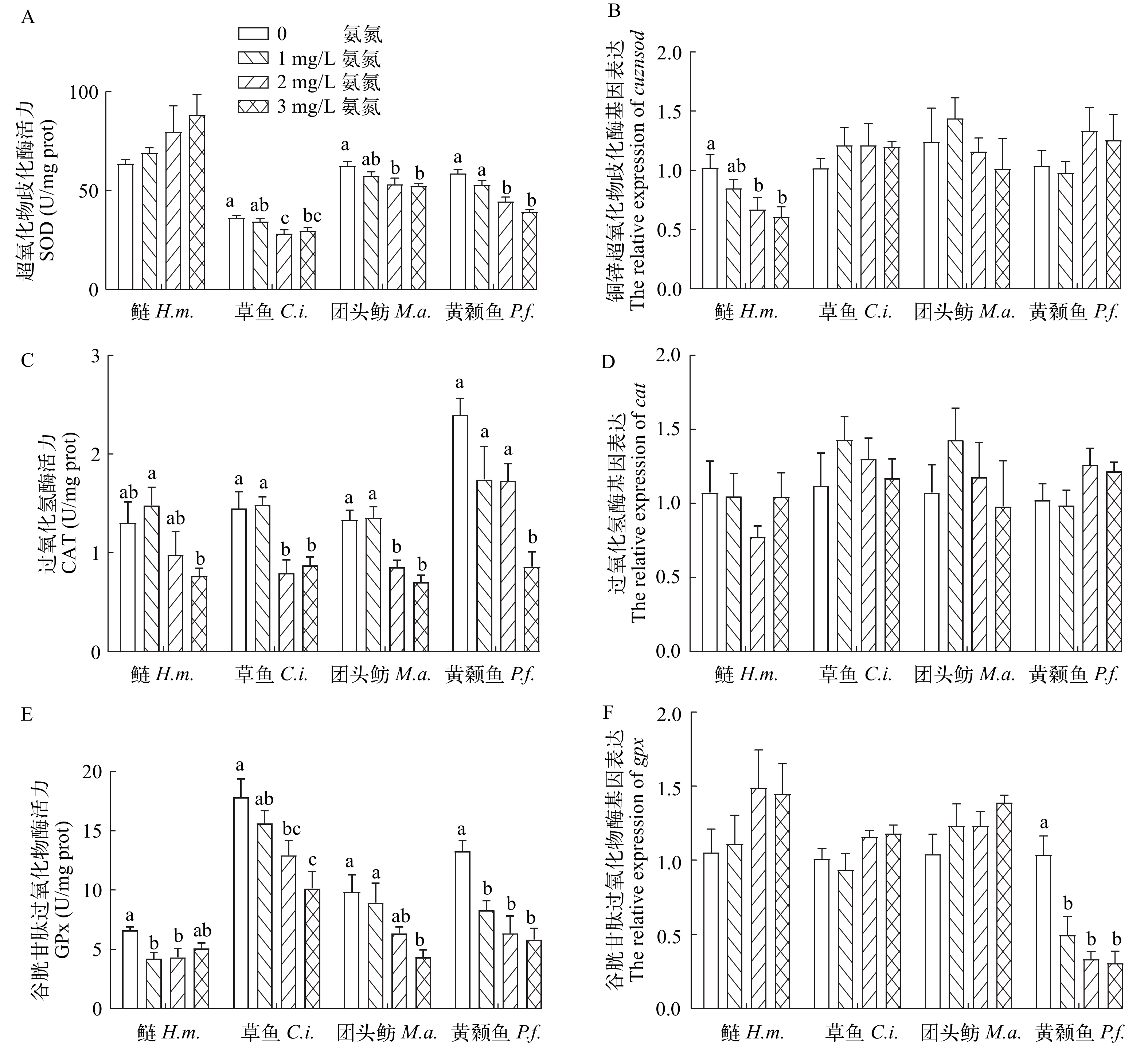
鲢仔鱼SOD活力在氨氮暴露后升高, 但没有表现出显著性变化(P>0.05), 但2和3 mg/L氨氮胁迫显著降低了草鱼仔鱼、团头鲂仔鱼和黄颡鱼仔鱼体内SOD活性, 其最高降幅分别为17.81%、14.79%和23.98% (P<0.05; 图 3A)。在基因水平上, 2和3 mg/L氨氮处理导致鲢仔鱼cuznsod表达水平的显著性下调(P<0.05; 图 3B)。
![]() 图 3 氨氮暴露对4种仔鱼抗氧化酶含量和基因表达的影响A. 超氧化物歧化酶; B. 铜锌超氧化物歧化酶基因表达; C. 过氧化氢酶; D. 过氧化氢酶基因表达; E. 谷胱甘肽过氧化物酶; F. 谷胱甘肽过氧化物酶基因表达Figure 3. Effects of total ammonia nitrogen on antioxidant enzymatic activity and gene expression of four species of fish larvae (n=6)A. Superoxide dismutase (SOD) activity; B. The relavtive expression of cuznsod; C. Catalase (CAT) activity; D. The relavtive expression of cat; E. Glutathione peroxidase (GPx) activity; F. The relavtive expression of gpx
图 3 氨氮暴露对4种仔鱼抗氧化酶含量和基因表达的影响A. 超氧化物歧化酶; B. 铜锌超氧化物歧化酶基因表达; C. 过氧化氢酶; D. 过氧化氢酶基因表达; E. 谷胱甘肽过氧化物酶; F. 谷胱甘肽过氧化物酶基因表达Figure 3. Effects of total ammonia nitrogen on antioxidant enzymatic activity and gene expression of four species of fish larvae (n=6)A. Superoxide dismutase (SOD) activity; B. The relavtive expression of cuznsod; C. Catalase (CAT) activity; D. The relavtive expression of cat; E. Glutathione peroxidase (GPx) activity; F. The relavtive expression of gpx如图 3C所示, 氨氮胁迫导致4种仔鱼的CAT活力降低。与对照组相比, 3 mg/L氨氮处理组中鲢仔鱼和黄颡鱼仔鱼体内CAT活性分别降低了41.14%和64.12% (P<0.05), 而草鱼仔鱼和团头鲂仔鱼CAT活性在2和3 mg/L氨氮组均显著下降, 最高降幅分别为45.01%和47.12% (P<0.05)。氨氮的胁迫并未造成4种仔鱼cat转录水平发生显著改变(P>0.05; 图 3D)。
4种仔鱼GPx的活性在氨氮胁迫后均降低(图 3E)。与对照组相比, 1和2 mg/L氨氮处理导致鲢仔鱼GPx活性显著性降低了34.48%和23.21% (P<0.05); 2和3 mg/L氨氮处理导致草鱼仔鱼GPx活性显著降低了27.51%和43.12% (P<0.05); 而团头鲂仔鱼GPx活性仅在3 mg/L氨氮处理组显著降低了55.73% (P<0.05); 仅黄颡鱼仔鱼GPx活性在3个处理组中均显著性降低, 最高降幅为56.04% (P<0.05)。与对照相比, 仅黄颡鱼基因gpx转录水平在3个氨氮处理组均显著性下调(P<0.05), 且降幅超过52.23% (图 3F)。
2.4 氨氮对4种仔鱼非特异性免疫指标的影响
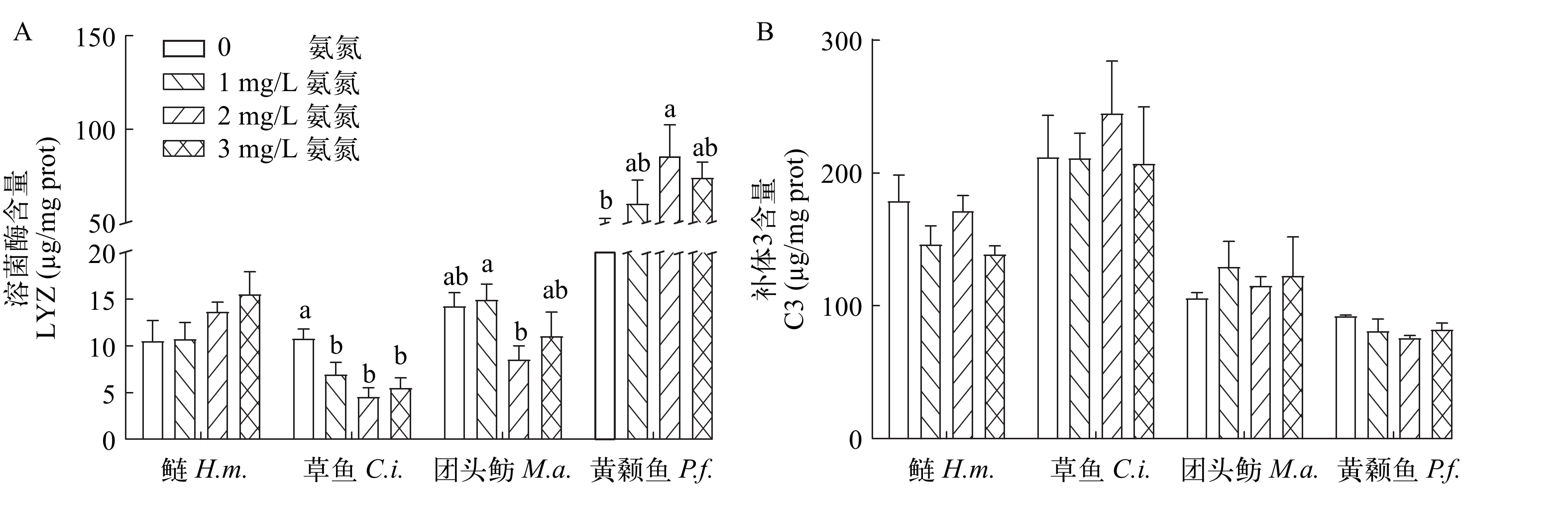
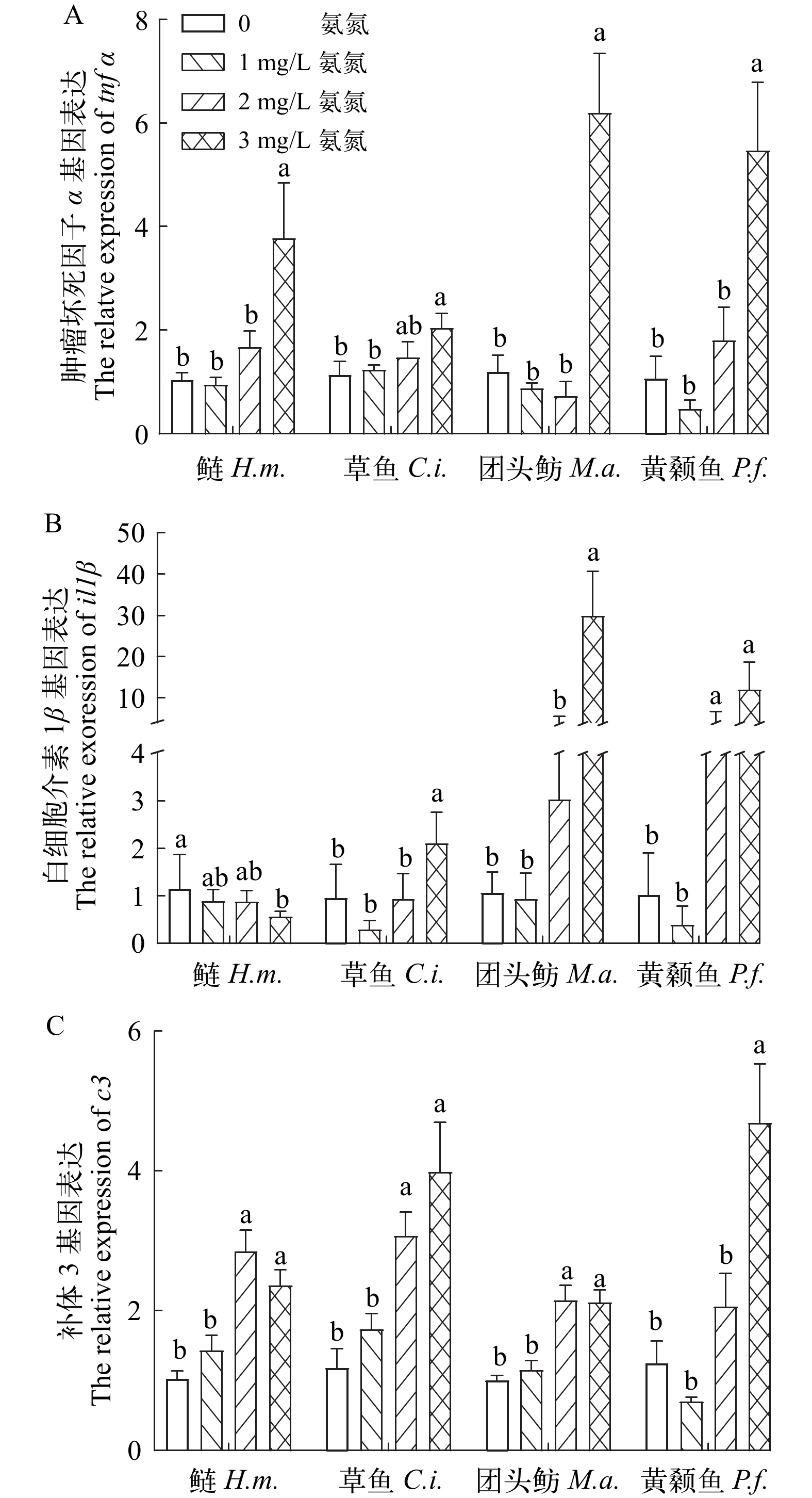
与对照组相比, 氨氮暴露导致草鱼仔鱼体内LYZ含量显著降低(P<0.05), 但未造成鲢仔鱼和团头鲂仔鱼体内LYZ含量出现显著性变化(P>0.05)。然而, 2 mg/L处理组黄颡鱼仔鱼LYZ含量增加显著(P<0.05; 图 4A)。如图 4B所示, 氨氮暴露对鲢、草鱼、团头鲂和黄颡鱼4种仔鱼体内补体C3含量均无显著性影响(P>0.05)。
在氨氮暴露后, 除了鲢仔鱼il1β基因表达呈现下降趋势, 4种鱼仔鱼所有检测基因(il1β、 tnfα和c3)均呈现上升趋势(图 5)。与对照组相比, 3 mg/L氨氮暴露导致tnfα基因表达在鲢、草鱼、团头鲂和黄颡鱼仔鱼体内分别显著升高了206.12%、79.67%、416.44%和267.18%(P<0.05)。同时, 3 mg/L氨氮暴露导致草鱼和团头鲂仔鱼体内il1β基因表达显著上升55.41%和2701.84%; 鲢体内显著下降51.17%(P<0.05); 而黄颡鱼仔鱼体内il1β基因表达在2和3 mg/L暴露下显著增加205%和773.68% (P<0.05)。3 mg/L氨氮诱导黄颡鱼仔鱼c3基因表达显著上升275.43%, 而2和3 mg/L氨氮均在鲢、团头鲂和草鱼仔鱼中诱导c3表达显著升高(P<0.05), 其最高涨幅分别为177.04%、374.61%和112.99%。
2.5 氨氮和鱼的种类双因素对仔鱼抗氧化酶和先天性免疫指标的影响
双因素方差分析结果显示, 氨氮对所有抗氧化酶活性、免疫指标以及免疫相关基因均有显著影响(P<0.05), 不同种类仔鱼(鲢、草鱼、团头鲂和黄颡鱼)的T-AOC、CAT、GPx、C3和基因sod、gpx、il1β、c3之间差异显著(P<0.05), 而鱼种和氨氮互作效应仅对C3和基因gpx、tnfα、il1β、c3影响显著(P<0.05; 表 2)。对于交互作用显著的指标, 我们通过单因素方差分析进一步解析了同一氨暴露下鱼种之间的差异 (表 3), 结果显示: 在无氨氮的对照组, 鲢和草鱼仔鱼体内C3含量显著高于黄颡鱼和团头鲂仔鱼(P<0.05), 而基因gpx、tnfα、il1β和c3 mRNA表达水平在4种仔鱼间没有显著差异; 在低浓度氨氮(1 mg/L)处理条件下, 黄颡鱼仔鱼c3和tnfα转录水平显著低于鲢和草鱼仔鱼, 其il1β基因转录水平显著低于鲢和团头鲂仔鱼(P<0.05), 而在高浓度氨氮(3 mg/L)处理下, 黄颡鱼仔鱼c3转录水平显著高于鲢和团头鲂仔鱼, il1β转录水平显著高于鲢和草鱼仔鱼, tnfα基因转录水平显著高于草鱼仔鱼(P<0.05; 表 3)。
表 2 氨氮和鱼的种类双因素对仔鱼抗氧化酶和先天性免疫指标的影响Table 2. Effects of ammonia and species on antioxidant enzyme of different feeding habits fish larvae指标Index 主效应 P值Major impact P-value 鱼种类
Fish species氨氮浓度
Ammonia concentration鱼种类×氨氮浓度
Fish species×Ammonia concentration总抗氧化T-AOC <0.001 <0.001 0.150 丙二醛MDA 0.288 0.037 0.916 超氧化物歧化酶SOD 0.972 <0.001 0.149 过氧化氢酶CAT <0.001 0.003 0.080 谷胱甘肽过氧化物酶GPx <0.001 <0.001 0.087 溶菌酶LYZ 0.315 <0.001 0.219 补体3C3 0.001 <0.001 0.027 铜/锌超氧化物歧化酶基因cuzusod 0.001 0.540 0.113 过氧化氢酶基因cat 0.158 0.580 0.302 谷胱甘肽过氧化物酶基因gpx <0.001 0.673 0.015 肿瘤坏死因子α基因tnfα 0.124 <0.001 0.001 白细胞介素1β基因il1β <0.001 <0.001 <0.001 补体3基因c3 <0.001 <0.001 <0.001 表 3 氨氮暴露下4种仔鱼之间C3含量及基因c3、gpx、il1β和tnfα转录水平变化Table 3. The changes of C3 levels and c3, il1β, tnfα translation among four species of fish larvae after ammonia exposure指标Index 氨氮
Ammonia nitrogen (mg/L)鱼种Species 鲢 H.m. 草鱼 C.i. 团头鲂 M.a. 黄颡鱼 P.f. 补体3含量
C30 179.01±17.61a 212.13±27.95a 105.94±3.51b 92.35±0.69b 1 146.38±12.48b 211.40±16.76a 129.45±17.20bc 81.05±7.02c 2 171.57±10.33b 244.82±35.29a 115.24±6.20bc 75.99±1.29 c 3 138.91±5.61ab 207.25±38.14a 122.51±26.30b 82.44±4.14b 补体3基因
c30 1.03±0.10 1.19±0.25 1.01±0.04 1.25±0.36 1 1.43±0.26ab 1.74±0.05a 1.15±0.11bc 0.70±0.07c 2 2.85±0.33 3.07±0.24 2.15±0.26 2.06±0.58 3 2.37±0.23bc 3.99±0.80ab 2.12±0.19c 4.69±1.02a 谷胱甘肽过氧化物酶
gpx0 1.05±0.15 1.01±0.09 1.04±0.16 1.04±0.12 1 1.11±0.22a 0.94±0.07b 1.23±0.16b 0.50±0.14b 2 1.49±0.22a 1.16±0.03b 1.23±0.12b 0.33±0.06b 3 1.45±0.25a 1.18±0.06b 1.39±0.05b 0.30±0.09b 白细胞介素1β基因
il1β0 1.16±0.30 0.96±0.31 1.07±0.12 1.02±0.44 1 0.89±0.11a 0.29±0.09b 0.94±0.25a 0.40±0.04b 2 0.88±0.12b 0.94±0.25b 3.04±0.47a 4.21±1.19a 3 0.57±0.05c 2.12±0.30c 29.98±5.31a 12.06±2.78b 肿瘤坏死因子α基因
tnfα0 1.04±0.15 1.14±0.28 1.20±0.24 1.07±0.48 1 0.95±0.18a 1.23±0.11a 0.88±0.09ab 0.49±0.21b 2 1.68±0.38 1.48±0.23 0.73±0.35 1.81±0.79 3 3.79±1.15ab 2.05±0.28b 6.20±1.14a 5.47±1.40a 3. 讨论
3.1 氨氮胁迫对仔鱼生长的影响
苗种培育是制约养殖后期发展的重要阶段, 在保障人工繁殖鱼苗孵化率的同时, 需要特别重视出膜后仔鱼的生长发育。其中, 仔鱼的生长发育是评价人工繁殖是否成功以及优良品种选育的重要时期, 因为仔鱼往往对外界环境较为敏感, 易受到环境因素(氨氮、亚硝酸盐和温度)的影响, 例如氨氮进入鱼体后能破坏脑中枢神经系统, 影响鱼的摄食和食物吸收, 进而抑制鱼的生长[15, 21, 35, 36]。Foss等[35]发现, 长期氨氮胁迫导致大菱鲆幼鱼特定生长率和增重率降低。Li 等[15]研究指出, 高浓度氨氮(26.88 mg/L)暴露明显抑制了黄颡鱼的摄食、生长及饲料转化效率。在本实验中, 氨氮暴露使4种仔鱼体长生长显著减缓, 且随着氨氮浓度升高体长呈现剂量依赖性下降, 表明氨氮胁迫对鱼类早期生长发育造成一定的负面影响, 其中氨氮暴露对生长影响最显著的是草鱼和黄颡鱼。相似地, 尼罗罗非鱼(Oreochromis niloticus)受精卵暴露于0.05—0.6 mg/L的氨氮20d和60d后, 死亡率与对照组相比显著性上升, 且高浓度氨氮暴露时, 仔鱼表现出各种生理反应, 其中包括体长生长减缓, 脊柱弯曲、卵黄囊缩小等[36]。Segner和Verreth[37]研究也指出, 鱼卵较大的鱼类(例如鲑)可以维持较长时间的卵黄囊期, 可以支持其生长至较大的仔鱼。相比之下, 卵和仔鱼较小的海鱼品种, 在外源喂养开始时器官发育不完全[38, 39]。
3.2 氨氮胁迫对仔鱼氧化和抗氧化系统的影响
鱼类的生长和鱼体的健康密不可分, 而鱼类抗氧化系统和氧化系统之间的平衡往往是评价鱼类健康的重要指标, 因为多种环境污染物的毒性机制之一是过量生成的活性氧(ROS)引起氧化应激[40-42]。MDA是脂质过氧化的重要标志之一。此外,T-AOC是衡量机体抗氧化酶系统和非酶系统功能强弱的综合性指标。MDA和T-AOC水平的动态变化可以充分反应机体氧化应激状态[43, 44]。急性氨氮暴露能导致罗非鱼肌肉和肝脏ROS含量增加, 并造成相应的氧化损伤[17], 且高浓度氨氮易导致鱼体内MDA的积累[18, 45]。在本研究中, 随着氨氮浓度升高, 4种鱼体内T-AOC含量显著降低, 而MDA含量都有一定的上升, 表明氨氮的暴露导致鱼体抗氧化能力的减弱, 造成了氧化应激损伤。抗氧化能力在不同种类的鱼之间会有很大的差异, 这可能与它们对引起氧化损伤的外源污染物的抵抗力不同有关[46, 47]。通过显著性分析和双因素方差分析发现, 不同仔鱼之间T-AOC含量差异显著, 并且氨氮对于不同仔鱼T-AOC含量均具有显著抑制作用, 其中对黄颡鱼仔鱼T-AOC削弱程度最大, 其次是团头鲂仔鱼, 初步表明鲢和草鱼仔鱼的氨耐受性较强。
细胞内ROS水平由相互作用的抗氧化防御体系协同控制[17, 48], 抗氧化酶活性的增加表明氧化应激的发生和清除生成的ROS的适应性反应, 而其活性的降低则暗示其抗氧化防御能力的破坏。在本实验中, 氨氮暴露导致4种仔鱼的抗氧化酶SOD、CAT和GPx的活性和基因转录水平出现不同程度的下降, 进一步证实氨氮的暴露造成了氧化应激损伤, 进而削弱了其抗氧化能力。我们研究还发现, 氨氮暴露后4种仔鱼中仅鲢仔鱼体内SOD含量未出现显著性变化, 而CAT和GPx 活力显著性降低, 表明鲢仔鱼不依赖SOD作为抵抗氨介导的ROS。与我们结果相似的, 刚孵化鲢体内SOD的活力在NH3 (0.06—0.264 mg/L)暴露3d和7d后没有受到显著影响[31]。本实验中草鱼、团头鲂和黄颡鱼仔鱼的SOD、CAT和GPx均显著性下降, 且黄颡鱼gpx基因的转录水平在氨氮暴露后也显著下调, 表明这3种鱼的抗氧化酶SOD、CAT和GPx都参与氨氮胁迫下ROS的清除。Chen等[49]研究发现, 氨氮(NH3: 0.176—0.879 mg/L)暴露草鱼卵至神经胚和孵化, 可使其SOD水平显著下降。Zhang等[50]研究结果揭示, 20 mg/L总氨氮长期暴露导致团头鲂幼鱼(14.27±0.01) g肝脏中SOD、CAT和GPx活性显著降低。同样, 黄颡鱼在氨氮暴露后其SOD、CAT和GPx活力也显著性下降[15, 21]。在正常情况下, 细胞内ROS可被SOD分解为H2O2, CAT和GPx可催化H2O2形成水和分子态氧, 所以SOD在抗氧化防御过程中起到首要地位[51, 52]。本实验发现, 氨氮处理后鲢仔鱼体内SOD活性显著高于其他3种仔鱼, 这可能是鲢仔鱼较其他3种仔鱼耐氨氮性强的原因。双因素方差分析进一步显示, 与对照组相比, 氨氮胁迫导致黄颡鱼仔鱼抗氧化酶降低的程度最大, 其次是草鱼和团头鲂仔鱼, 另一方面4种仔鱼自身之间抗氧化酶CAT和GPx活性就有显著差异, 而不同鱼抗氧化应激的响应能力可能与它们食性相关[53, 54]。姜丹莉[54]研究发现, 草食性草鱼和肉食性青鱼捕捞后肝脏糖含量下降, 而杂食性银鲫(Carassiusautatus gibelio)捕捞后肝糖原含量未发生显著变化, 其血浆葡萄糖和乳酸浓度增幅较小, 表明银鲫的捕捞应激反应强度低于草鱼和青鱼。综上所述, 在氨氮暴露下, 鲢仔鱼抗氧化能力最高, 耐氨氮能力最强; 黄颡鱼仔鱼抗氧化能力最低, 耐氨氮能力最低。
3.3 氨氮胁迫对仔鱼免疫系统的影响
鱼类生活的水环境病原体复杂多变, 病原体会增加宿主免疫系统功能障碍, 因此集约化养殖中氨氮对鱼类免疫影响已成为热点问题[29, 55], 而鱼类先天性免疫被认为是抵抗外界病原体的第一道防线[56, 57]。溶菌酶在生物体中广泛存在, 其转录水平或者活力是鱼类先天免疫的重要指标。章琼[60]研究报道, 72h氨氮(20 mg/L)急性胁迫导致团头鲂成鱼鳃组织中溶菌酶基因表达量显著下降, 免疫系统功能减弱。相似地, 急性氨氮暴露也造成瓦氏黄颡鱼成鱼血清中溶菌酶含量显著性降低, 导致免疫系统功能减弱[61]。同样, 长期氨氮(5.56—5.80 mg/L)暴露导致黄颡鱼幼鱼(1.94±0.05) g肝脏中溶菌酶活性显著降低[62]。相反, 黄颡鱼在氨氮(5.70 mg/L)3h短期急性暴露后, 肝脏中溶菌酶呈现显著性上升[15]。在本研究中, 氨氮暴露后鲢和团头鲂仔鱼LYZ含量没有显著变化, 但草鱼鲂仔鱼中显著下降, 而黄颡鱼中显著升高, 可见氨氮胁迫导致4种仔鱼呈现差异性免疫响应, 草鱼表现为免疫反应抑制, 黄颡鱼表现为免疫反应兴奋, 而鲢和团头鲂免疫反应未受影响。本实验双因素方差分析显示, 氨氮对LYZ含量影响显著, 但是4种仔鱼体内LYZ之间没有显著差异。鱼类的补体可裂解外界细胞, 对外来生物产生调节作用, 其中补体C3在补体级联反应中起着核心作用[58, 59]。在本研究中, 氨氮暴露未导致C3含量在4种仔鱼中出现显著变化, 但c3基因表达呈现显著升高。相似地, 高浓度氨氮(10 mg/L)急性胁迫24h后, 团头鲂成鱼血清中C3和C4含量没有显著变化[63]。同样, 在24h急性氨暴露后, 草鱼成鱼血清中C3含量无显著变化[64]。综合以上结果表明, 氨氮暴露下4种仔鱼通过提高C3基因表达量维持体内C3含量恒定。
细胞因子家族中il1β和tnfα被视为重要的促炎细胞因子, 在受到外界损伤时作为几种免疫反应的中间因素参与炎症反应[65-68]。氨氮(10 mg/L)急性胁迫导致鲫(Carassius auratus)肝脏中tnfα和il1β表达升高[66], 表明机体发生了炎症反应。同样, 急性氨氮暴露也可诱导河豚(Takifugu obscurus)和翘嘴鳜(Siniperca chuatsi)肝脏中tnfα表达升高[70, 71]。此外, 急性96h氨氮(0.14和0.28 mg/L)胁迫导致黄颡鱼头肾巨噬细胞il1和tnf基因相对表达量显著下降[72]。在本研究中, 3 mg/L氨氮处理导致4种仔鱼体内tnfα基因表达量均显著升高, 且其在鲢和草鱼仔鱼体内的涨幅低于团头鲂和黄颡鱼仔鱼, 表明团头鲂和黄颡鱼仔鱼可能较其他两种仔鱼对氨耐受性弱。与tnfα表达结果相似, 氨氮暴露导致草鱼仔鱼、团头鲂仔鱼和黄颡鱼仔鱼il1β表达显著升高, 且黄颡鱼仔鱼中il1β表达对氨胁迫表现更加敏感, 但鲢仔鱼体内il1β表达显著下降。双因素方差分析表明, 同一氨氮浓度下4种仔鱼之间tnfα 和il1β表达存在显著差异, 黄颡鱼仔鱼体内免疫炎症因子(tnfα 和il1β)在低浓度氨氮(1 mg/L)下表达量较低, 但在高浓度氨氮(3 mg/L)条件下表达量较高, 而鲢和草鱼仔鱼却表现出相反趋势。由此可见, 氨氮暴露干扰了4种仔鱼免疫反应, 引发炎症反应, 其中黄颡鱼仔鱼和团头鲂仔鱼较其他两种仔鱼对氨耐受性更弱。
4. 结论
氨氮胁迫导致4种不同食性鱼类仔鱼产生氧化应激和免疫炎症响应, 损害机体内酶的平衡, 降低仔鱼的抗氧化能力和先天性免疫功能, 影响基因的转录水平和酶的合成, 导致生长迟缓甚至死亡。在抗氧化和免疫对氨氮耐受性方面, 鲢仔鱼的抗性最强, 其次是草鱼和团头鲂仔鱼, 而黄颡鱼仔鱼抵抗力较弱。鉴于此, 苗种培育阶段应该重视水体中氨氮浓度控制, 特别是在肉食性黄颡鱼仔鱼的培育过程。
-
图 1 氨氮暴露对4种仔鱼体长的影响
结果以均值±标准误(n=40)的形式表示, 不同字母代表组间差异显著(P<0.05); 下同
Figure 1. Effects of total ammonia nitrogen on body length of four species of fish larvae
Data are shown as mean±SE (n=40), different small letters mean significant differences among different treatment groups (P<0.05). The same applies below
图 3 氨氮暴露对4种仔鱼抗氧化酶含量和基因表达的影响
A. 超氧化物歧化酶; B. 铜锌超氧化物歧化酶基因表达; C. 过氧化氢酶; D. 过氧化氢酶基因表达; E. 谷胱甘肽过氧化物酶; F. 谷胱甘肽过氧化物酶基因表达
Figure 3. Effects of total ammonia nitrogen on antioxidant enzymatic activity and gene expression of four species of fish larvae (n=6)
A. Superoxide dismutase (SOD) activity; B. The relavtive expression of cuznsod; C. Catalase (CAT) activity; D. The relavtive expression of cat; E. Glutathione peroxidase (GPx) activity; F. The relavtive expression of gpx
表 1 实时荧光定量PCR引物序列
Table 1 Primer sequences for qPCR
鱼种
Species目的基因
Target gene引物序列
Primer sequences (5′—3′)登录号/参考文献
Accession number/Reference草鱼
C. i.白细胞介素1β(il1β) CACAACCTTCCCACCAAT
GCCGTGCTAATAAACCATCJQ692172 肿瘤坏死因子α (tnfα) GGAGACAAACTGCTCACCGA
TGACTGCAGTGGAAGCTCAGHQ696609 补体3(c3) ACGGCCTTTGTTGTGATTGC
TTGGTCAGTCGTGGAAGTCGAY374472 过氧化氢酶(cat) GAAGTTCTACACCGATGAGG
CCAGAAATCCCAAACCATFJ560431 谷胱甘肽过氧化物酶(gpx) GGGCTGGTTATTCTGGGC
AGGCGATGTCATTCCTGTTCEU828796 铜锌超氧化物歧化酶(cuznsod) TTGGAGACAATACAAATGGGTG
CATCGGAATCGGCAGTCAGU901214 肌动蛋白(β-actin) CTCGCTCTGCAGGTATGGAG
TTCATTGTGCTAGGGGCCAGM25013 鲢
H. m.白细胞介素1β(il1β) TCTGATGAGATGGGCTGCTC
CTGGCACATTTCCACCTGCTC[34] 肿瘤坏死因子α (tnfα) CAAACCGGAGACAGACTGCT
TTGCAGTGGAAGCTCAGGAGFJ913063 补体3(c3) CGCTTGTGAAGGCCAAAGAC
CCTGTGTGGTACCAGAACCGAM773827 过氧化氢酶(cat) TGAGTCTGGGTCGGCAGATA
TCCGGATCCTTCAGGTGAGTHM230689 谷胱甘肽过氧化物酶(gpx) GAGCCCAAATCCCAGCTTCT
CGGGCCAATGAGGAACTTCTEU108012 铜锌超氧化物歧化酶(cuznsod) TCTCGGGTGAAATCACTGGC
TGATGCAGCCGTTTGTGTTGHM469964 肌动蛋白(β-actin) TGGATCGGAGGTTCCATCCT
TGGTCCAGACTCGTCGTACTAF301605 团头鲂
M. a.白细胞介素1β (il1β) ACGATAAGACCAGCACGACC
CTGTTTCCGTCTCTCAGCGTKF515511 肿瘤坏死因子α (tnfα) TCCAAGGCAGCCATCCATTT
GCCTGAAGAGAAAGCCTGGTKF515512 补体3(c3) ACGGCCTTTGTTGTGATTGC
CGTCATCGCAACAGCGTAAGKP192115 过氧化氢酶(cat) GTTTCCGTCCTTCATCCACTCT
GACCAGTTTGAAAGTGTGCGATKF378714 谷胱甘肽过氧化物酶(gpx) CTTTTGTCCTTGAAGTATGTCC CTTGAGGAAGACGAAGAGAGGG KF378713 铜锌超氧化物歧化酶(cuznsod) TCAGCGTGAACCATCCACAA
GACAACAGACCGGCCAAGTAKF479046 肌动蛋白(β-actin) ACCCACACCGTGCCCATCTA
CGGACAATTTCTCTTTCGGCTGAY170122 黄颡鱼
P. f.白细胞介素1β (il1β) TGGAATGGAGCGCTTCCTTT
GAACCAGCCCGGGTATTTCAJQ730738 肿瘤坏死因子α(tnfα) ATCAGGTGAACGCTGATGCT
GTGTTGAGGGAAGGGGTCTGXM027141814 补体3(c3) GGTGTCGGAAGGTGTGCTAA
CTGACCAGCCACCATGATGTXM027136454 过氧化氢酶(cat) AAGGCAACCCTGTCTACTGC
TTGTACAGGTCACGGATGGCKX455919 谷胱甘肽过氧化物酶(gpx) TATGACCTGCGTGCTACCAC
TGGTGCCTCATAGTGATGCCXM027155811 铜锌超氧化物歧化酶(cuznsod) TTGGAGACAATACAAATGGGTG
CATCGGAATCGGCAGTCAXM027176836 肌动蛋白(β-actin) GTACCACCATGTACCCTGGC
GTGCCTTTCATTCAGCCACCEU161065 表 2 氨氮和鱼的种类双因素对仔鱼抗氧化酶和先天性免疫指标的影响
Table 2 Effects of ammonia and species on antioxidant enzyme of different feeding habits fish larvae
指标Index 主效应 P值Major impact P-value 鱼种类
Fish species氨氮浓度
Ammonia concentration鱼种类×氨氮浓度
Fish species×Ammonia concentration总抗氧化T-AOC <0.001 <0.001 0.150 丙二醛MDA 0.288 0.037 0.916 超氧化物歧化酶SOD 0.972 <0.001 0.149 过氧化氢酶CAT <0.001 0.003 0.080 谷胱甘肽过氧化物酶GPx <0.001 <0.001 0.087 溶菌酶LYZ 0.315 <0.001 0.219 补体3C3 0.001 <0.001 0.027 铜/锌超氧化物歧化酶基因cuzusod 0.001 0.540 0.113 过氧化氢酶基因cat 0.158 0.580 0.302 谷胱甘肽过氧化物酶基因gpx <0.001 0.673 0.015 肿瘤坏死因子α基因tnfα 0.124 <0.001 0.001 白细胞介素1β基因il1β <0.001 <0.001 <0.001 补体3基因c3 <0.001 <0.001 <0.001 表 3 氨氮暴露下4种仔鱼之间C3含量及基因c3、gpx、il1β和tnfα转录水平变化
Table 3 The changes of C3 levels and c3, il1β, tnfα translation among four species of fish larvae after ammonia exposure
指标Index 氨氮
Ammonia nitrogen (mg/L)鱼种Species 鲢 H.m. 草鱼 C.i. 团头鲂 M.a. 黄颡鱼 P.f. 补体3含量
C30 179.01±17.61a 212.13±27.95a 105.94±3.51b 92.35±0.69b 1 146.38±12.48b 211.40±16.76a 129.45±17.20bc 81.05±7.02c 2 171.57±10.33b 244.82±35.29a 115.24±6.20bc 75.99±1.29 c 3 138.91±5.61ab 207.25±38.14a 122.51±26.30b 82.44±4.14b 补体3基因
c30 1.03±0.10 1.19±0.25 1.01±0.04 1.25±0.36 1 1.43±0.26ab 1.74±0.05a 1.15±0.11bc 0.70±0.07c 2 2.85±0.33 3.07±0.24 2.15±0.26 2.06±0.58 3 2.37±0.23bc 3.99±0.80ab 2.12±0.19c 4.69±1.02a 谷胱甘肽过氧化物酶
gpx0 1.05±0.15 1.01±0.09 1.04±0.16 1.04±0.12 1 1.11±0.22a 0.94±0.07b 1.23±0.16b 0.50±0.14b 2 1.49±0.22a 1.16±0.03b 1.23±0.12b 0.33±0.06b 3 1.45±0.25a 1.18±0.06b 1.39±0.05b 0.30±0.09b 白细胞介素1β基因
il1β0 1.16±0.30 0.96±0.31 1.07±0.12 1.02±0.44 1 0.89±0.11a 0.29±0.09b 0.94±0.25a 0.40±0.04b 2 0.88±0.12b 0.94±0.25b 3.04±0.47a 4.21±1.19a 3 0.57±0.05c 2.12±0.30c 29.98±5.31a 12.06±2.78b 肿瘤坏死因子α基因
tnfα0 1.04±0.15 1.14±0.28 1.20±0.24 1.07±0.48 1 0.95±0.18a 1.23±0.11a 0.88±0.09ab 0.49±0.21b 2 1.68±0.38 1.48±0.23 0.73±0.35 1.81±0.79 3 3.79±1.15ab 2.05±0.28b 6.20±1.14a 5.47±1.40a -
[1] Ruyet J P L, Chartois H, Quemener L. Comparative acute ammonia toxicity in marine fish and plasma ammonia response [J]. Aquaculture, 1995, 136(1-2): 181-194. doi: 10.1016/0044-8486(95)01026-2
[2] Wilkie M P. Mechanisms of ammonia excretion across fish gills [J]. Comparative Biochemistry and Physiology Part A: Physiology, 1997, 118(1): 39-50. doi: 10.1016/S0300-9629(96)00407-0
[3] Randall D J, Tsui T K N. Ammonia toxicity in fish [J]. Marine Pollution Bulletin, 2002, 45(1-12): 17-23. doi: 10.1016/S0025-326X(02)00227-8
[4] Svobodová Z. Water quality and fish health [J]. Food and Agriculture Organization of the United Nations, 1993(54): 59.
[5] Ruyet J P L, Lamers A, Roux A L, et al. Long-term ammonia exposure of turbot: effects on plasma parameters [J]. Journal of Fish Biology, 2003, 62(4): 879-894. doi: 10.1046/j.1095-8649.2003.00073.x
[6] Brinkman S F, Woodling J D, Vajda A M, et al. Chronic toxicity of ammonia to early life stage rainbow trout [J]. Transactions of the American Fisheries Society, 2009, 138(2): 433-440. doi: 10.1577/T07-224.1
[7] Armstrong B M, Lazorchak J M, Murphy C A, et al. Determining the effects of ammonia on fathead minnow (Pimephales promelas) reproduction [J]. Science of the Total Environment, 2012, 420: 127-133. doi: 10.1016/j.scitotenv.2012.01.005
[8] Randall D J, Wright P A. Ammonia distribution and excretion in fish [J]. Fish Physiology and Biochemistry, 1987, 3(3): 107-120. doi: 10.1007/BF02180412
[9] Yeong K J, Chang Y J. Effects of ammonia concentration on histological and physiological status in black seabream (Acanthopagrus schlegeli) [J]. Korean Journal of Fisheries and Aquaic Society, 1996, 29(6): 828-836.
[10] Arillo A, Margiocco C, Melodia F, et al. Ammonia toxicity mechanism in fish: studies on rainbow trout (Salmo gairdneri Rich.) [J]. Ecotoxicology and Environmental Safety, 1981, 5(3): 316-328. doi: 10.1016/0147-6513(81)90006-3
[11] Fromm P O, Gillette J R. Effect of ambient ammonia on blood ammonia and nitrogen excretion of rainbow trout (Salmo gairdneri) [J]. Comparative Biochemistry and Physiology, 1968, 26(3): 887-896. doi: 10.1016/0010-406X(68)90008-X
[12] Hernández-Fonseca K, Cárdenas-Rodríguez N, Pedraza-Chaverri J, et al. Calcium-dependent production of reactive oxygen species is involved in neuronal damage induced during glycolysis inhibition in cultured hippocampal neurons [J]. Journal of Neuroscience Research, 2008, 86(8): 1768-1780. doi: 10.1002/jnr.21634
[13] Jin L H, Bahn J H, Eum W S, et al. Transduction of human catalase mediated by an HIV-1 TAT protein basic domain and arginine-rich peptides into mammalian cells [J]. Free Radical Biology and Medicine, 2001, 31(11): 1509-1519. doi: 10.1016/S0891-5849(01)00734-1
[14] Hou J, Li L, Xue T, et al. Hepatic positive and negative antioxidant responses in zebrafish after intraperitoneal administration of toxic microcystin-LR [J]. Chemosphere, 2015(120): 729-736. doi: 10.1016/j.chemosphere.2014.09.079
[15] Li M, Gong S, Li Q, et al. Ammonia toxicity induces glutamine accumulation, oxidative stress and immunosuppression in juvenile yellow catfish Pelteobagrus fulvidraco [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2016(183-184): 1-6.
[16] Sun Y, Li Y, Rao J, et al. Effects of inorganic mercury exposure on histological structure, antioxidant status and immune response of immune organs in yellow catfish (Pelteobagrus fulvidraco) [J]. Journal of Applied Toxicology, 2018, 38(6): 843-854. doi: 10.1002/jat.3592
[17] Hegazi M M, Attia Z I, Ashour O A. Oxidative stress and antioxidant enzymes in liver and white muscle of Nile tilapia juveniles in chronic ammonia exposure [J]. Aquatic Toxicology, 2010, 99(2): 118-125. doi: 10.1016/j.aquatox.2010.04.007
[18] Sinha A K, AbdElgawad H, Giblen T, et al. Anti-oxidative defences are modulated differentially in three freshwater teleosts in response to ammonia-induced oxidative stress [J]. PLoS One, 2014, 9(4): e95319. doi: 10.1371/journal.pone.0095319
[19] Kim S H, Kim J H, Park M A, et al. The toxic effects of ammonia exposure on antioxidant and immune responses in Rockfish, Sebastes schlegelii during thermal stress [J]. Environmental Toxicology and Pharmacology, 2015, 40(3): 954-959. doi: 10.1016/j.etap.2015.10.006
[20] Guo H, Lin W, Hou J, et al. The protective roles of dietary selenium yeast and tea polyphenols on growth performance and ammonia tolerance of juvenile Wuchang bream (Megalobrama amblycephala) [J]. Frontiers in Physiology, 2018(9): 1371. doi: 10.3389/fphys.2018.01371
[21] Zhang L, Zhao Z G, Fan Q X. Effects of ammonia on growth, digestion and antioxidant capacity in juvenile yellow catfish Pelteobagrus fulvidraco (Richardson, 1846) [J]. Journal of Applied Ichthyology, 2016, 32(6): 1205-1212. doi: 10.1111/jai.13203
[22] 翁朝红, 谢仰杰. 环境因素对鱼类免疫功能的影响 [J]. 集美大学学报(自然科学版), 2001, 6(2): 184-189. Weng Z H, Xie Y J. Effects of environmental factors on fish immunity [J]. Journal of Jimei University (
Natural Science ) , 2001, 6(2): 184-189. [23] Bowden T J. Modulation of the immune system of fish by their environment [J]. Fish & Shellfish Immunology, 2008, 25(4): 373-383.
[24] 覃川杰, 杨川, 陈昌福. 水温对鱼类免疫活动的影响 [J]. 河南师范大学学报(自然科学版), 2011, 39(5): 129-133. Qin C J, Yang C, Chen C F. Effect of environmental temperature on lmmune status of fish [J]. Journal of Henan Normal University (
Natural Science Edition ) , 2011, 39(5): 129-133. [25] 李海波, 李月红, 吉尚雷, 等. 几种环境因素对鱼类免疫机能的影响 [J]. 中国水产, 2013(9): 60-61. doi: 10.3969/j.issn.1002-6681.2013.09.021 Li H B, Li Y H, Ji S L, et al. Effects of several environmental factors on immune function of fish [J]. China Fisheries, 2013(9): 60-61. doi: 10.3969/j.issn.1002-6681.2013.09.021
[26] Liu B L, Jia R, Huang B, et al. Interactive effect of ammonia and crowding stress on ion-regulation and expression of immune-related genes in juvenile turbot (Scophthalmus maximus) [J]. Marine and Freshwater Behaviour and Physiology, 2017, 50(3): 179-194. doi: 10.1080/10236244.2017.1360726
[27] Cheng C H, Yang F F, Liao S A, et al. Effect of acute ammonia exposure on expression of GH/IGF axis genes GHR1, GHR2 and IGF-1 in pufferfish (Takifugu obscurus) [J]. Fish Physiology and Biochemistry, 2015, 41(2): 495-507. doi: 10.1007/s10695-015-0025-1
[28] Li S, Wang D, Liu H, et al. Expression and antimicrobial activity of c-type lysozyme in Taimen (Hucho taimen, Pallas) [J]. Developmental & Comparative Immunology, 2016, 63: 156-162.
[29] Xing X, Li M, Yuan L, et al. The protective effects of taurine on acute ammonia toxicity in grass carp Ctenopharynodon idellus [J]. Fish & Shellfish Immunology, 2016, 56: 517-522.
[30] Amado L L, Monserrat J M. Oxidative stress generation by microcystins in aquatic animals: why and how [J]. Environment International, 2010, 36(2): 226-235. doi: 10.1016/j.envint.2009.10.010
[31] Sun H, Yang W, Chen Y, et al. Effect of purified microcystin on oxidative stress of silver carp Hypophthalmichthys molitrix, larvae under different ammonia concentrations [J]. Biochemical Systematics and Ecology, 2011, 39(4-6): 536-543. doi: 10.1016/j.bse.2011.08.001
[32] Emerson K, Russo R C, Lund R E, et al. Aqueous ammonia equilibrium calculations: effect of pH and temperature [J]. Journal of the Fisheries Research Board of Canada, 1975, 32(12): 2379-2383. doi: 10.1139/f75-274
[33] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔ CT method [J]. Methods, 2001, 25(4): 402-408. doi: 10.1006/meth.2001.1262
[34] 蒋菁菁. 鲢补体C7和白细胞介素-1β基因的克隆、表达及序列分析 [D]. 重庆: 重庆师范大学, 2012. Jiang J J. Molecular cloning and genetic diversity analysis of the seventh component of complement and interleukin-1β in Hypophthalmichthys molitrix [D]. Chongqing: Chongqing Normal University, 2012.
[35] Foss A, Imsland A K, Roth B, et al. Effects of chronic and periodic exposure to ammonia on growth and blood physiology in juvenile turbot (Scophthalmus maximus) [J]. Aquaculture, 2009, 296(1-2): 45-50. doi: 10.1016/j.aquaculture.2009.07.013
[36] El-Greisy Z A E B, Elgamal A E E, Ahmed N A M. Effect of prolonged ammonia toxicity on fertilized eggs, hatchability and size of newly hatched larvae of Nile tilapia, Oreochromis niloticus [J]. The Egyptian Journal of Aquatic Research, 2016, 42(2): 215-222. doi: 10.1016/j.ejar.2016.04.001
[37] Segner H, Verreth J. Metabolic enzyme activities in larvae of the African catfish, Clarias gariepinus: changes in relation to age and nutrition [J]. Fish Physiology and Biochemistry, 1995, 14(5): 385-398. doi: 10.1007/BF00003376
[38] Cousin J C B, Laurencin F B. Morphogenèse de l’appareil digestif et de la vessie gazeuse du turbot, Scophthalmus maximus L. [J]. Aquaculture, 1985, 47(4): 305-319. doi: 10.1016/0044-8486(85)90216-9
[39] Pittman K, Skiftesvik A B, Berg L. Morphological and behavioural development of halibut, Hippoglossus hippoglossus (L.) larvae [J]. Journal of Fish Biology, 1990, 37(3): 455-472. doi: 10.1111/j.1095-8649.1990.tb05876.x
[40] Ching B, Chew S F, Wong W P, et al. Environmental ammonia exposure induces oxidative stress in gills and brain of Boleophthalmus boddarti (Mudskipper) [J]. Aquatic Toxicology, 2009, 95(3): 203-212. doi: 10.1016/j.aquatox.2009.09.004
[41] Jia R, Cao L P, Du J L, et al. Effects of carbon tetrachloride on oxidative stress, inflammatory response and hepatocyte apoptosis in common carp (Cyprinus carpio) [J]. Aquatic Toxicology, 2014(152): 11-19. doi: 10.1016/j.aquatox.2014.02.014
[42] Jia R, Han C, Lei J L, et al. Effects of nitrite exposure on haematological parameters, oxidative stress and apoptosis in juvenile turbot (Scophthalmus maximus) [J]. Aquatic Toxicology, 2015(169): 1-9. doi: 10.1016/j.aquatox.2015.09.016
[43] Giera M, Lingeman H, Niessen W M A. Recent advancements in the LC-and GC-based analysis of malondialdehyde (MDA): a brief overview [J]. Chromatographia, 2012, 75(9-10): 433-440. doi: 10.1007/s10337-012-2237-1
[44] 高春生, 王春秀, 张书松. 水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响 [J]. 农业环境科学学报, 2008, 27(3): 1157-1162. doi: 10.3321/j.issn:1672-2043.2008.03.055 Gao C S, Wang C X, Zhang S S. Effects of copper on activities of antioxidant enzymes and total antioxidative competence in hepatopancreas of Cyprinus carpio [J]. Journal of Agro-Environment Science, 2008, 27(3): 1157-1162. doi: 10.3321/j.issn:1672-2043.2008.03.055
[45] Sinha A K, Zinta G, AbdElgawad H, et al. High environmental ammonia elicits differential oxidative stress and antioxidant responses in five different organs of a model estuarine teleost (Dicentrarchus labrax) [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2015, 174-175: 21-31.
[46] Stephensen E, Sturve J, Förlin L. Effects of redox cycling compounds on glutathione content and activity of glutathione-related enzymes in rainbow trout liver [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2002, 133(3): 435-442.
[47] Eyckmans M, Celis N, Horemans N, et al. Exposure to waterborne copper reveals differences in oxidative stress response in three freshwater fish species [J]. Aquatic Toxicology, 2011, 103(1-2): 112-120. doi: 10.1016/j.aquatox.2011.02.010
[48] 王咏梅. 自由基与谷胱甘肽过氧化物酶 [J]. 解放军药学学报, 2005, 21(5): 369-371. Wang Y M. Free radicals and glutathione peroxidase [J]. Pharmaceutical Journal of PLA, 2005, 21(5): 369-371.
[49] Chen Y, Sun H, Yang W, et al. Incubation and oxidative stress of grass carp (Ctenopharyngodon idella) embryos exposed to different un-ionized ammonia levels [J]. Journal of Freshwater Ecology, 2012, 27(1): 143-150.
[50] Zhang W, Xia S, Zhu J, et al. Growth performance, physiological response and histology changes of juvenile blunt snout bream, Megalobrama amblycephala exposed to chronic ammonia [J]. Aquaculture, 2019(506): 424-436. doi: 10.1016/j.aquaculture.2019.03.072
[51] McCord J M, Fridovich I. Superoxide dismutase: an enzymic function for erythrocuprein (hemocuprein) [J]. Journal of Biological Chemistry, 1969, 244(22): 6049-6055. doi: 10.1016/S0021-9258(18)63504-5
[52] Krinsky N I. Mechanism of action of biological antioxidants [J]. Experimental Biology and Medicine, 1992, 200(2): 248-254. doi: 10.3181/00379727-200-43429
[53] 周龙艳, 李秀明, 付世建. 捕食驯化对胭脂鱼和中华倒刺鲃游泳行为、应激和免疫功能的影响 [J]. 水生生物学报, 2021, 45(5): 1112-1119. doi: 10.7541/2021.2020.015 Zhou L Y, Li X M, Fu S J. The effect of predation acclimation on swimming behavior, stress and immune responses of juvenile Myxocyprinus asiaticus and Spinibarbus sinensis [J]. Acta Hydrobiologica Sinica, 2021, 45(5): 1112-1119. doi: 10.7541/2021.2020.015
[54] 姜丹莉. 四种不同食性的温水鱼类应激反应及其对糖代谢的影响 [D]. 杭州: 浙江大学, 2017. Jiang D L. Stress response in four warmwater fish species with different food habits and its effect on glycometabolism [D]. Hangzhou: Zhejiang University, 2017.
[55] 王梦杰, 马本贺, 王玮欣, 等. 慢性氨氮胁迫对台湾泥鳅幼鱼生长、免疫及组织结构的影响 [J]. 水生生物学报, 2021, 45(2): 267-274. doi: 10.7541/2021.2019.281 Wang M J, Ma B H, Wang W X, et al. Effects of chronic ammonia stress on growth, immunity and histological structure of juvenile Taiwan loach (Paramisgurnus dabryanus ssp. Taiwan) [J]. Acta Hydrobiologica Sinica, 2021, 45(2): 267-274. doi: 10.7541/2021.2019.281
[56] Parkin J, Cohen B. An overview of the immune system [J]. Lancet, 2001, 357(9270): 1777-1789. doi: 10.1016/S0140-6736(00)04904-7
[57] Saurabh S, Sahoo P K. Lysozyme: an important defence molecule of fish innate immune system [J]. Aquaculture Research, 2008, 39(3): 223-239. doi: 10.1111/j.1365-2109.2007.01883.x
[58] Holland M C H, Lambris J D. The complement system in teleosts [J]. Fish & Shellfish Immunology, 2002, 12(5): 399-420.
[59] Lin W, Guo H, Wang L, et al. Nitrite enhances MC-LR-induced changes on splenic oxidation resistance and innate immunity in male zebrafish [J]. Toxins, 2018, 10(12): 512. doi: 10.3390/toxins10120512
[60] 章琼. 团头鲂g型溶菌酶和caspase家族基因的全长cDNA克隆及在氨氮胁迫下的表达分析 [D]. 南京: 南京农业大学, 2015. Zhang Q. Molecular cloning of G-type lysozyme and caspase family gene from blout snout bream (Megahbrama amblycephala) and it’s expression analysis under ammonia-N stress [D]. Nanjing: Nanjing Agricultural University, 2015.
[61] Qin C J, Shao T, Wang Y M, et al. Effect of ammonia-N on histology and expression of immunoglobulin M and component C3 in the spleen and head kidney of Pelteobagrus vachellii [J]. Aquaculture Reports, 2017(8): 16-20. doi: 10.1016/j.aqrep.2017.08.001
[62] 黎庆, 龚诗雁, 黎明. 慢性氨氮暴露诱发黄颡鱼幼鱼谷氨酰胺积累、氧化损伤及免疫抑制的研究 [J]. 水产学报, 2015, 39(5): 728-734. Li Q, Gong S Y, Li M. Chronic ammonia toxicity induces glutamine accumulation, oxidative damage and immunosuppression of juvenile yellow catfish Pelteobagrus fulvidraco [J]. Journal of Fisheries of China, 2015, 39(5): 728-734.
[63] 崔红红, 刘波, 戈贤平, 等. 肌醇对氨氮应激下团头鲂幼鱼免疫的影响 [J]. 水产学报, 2014, 38(2): 228-236. Cui H H, Liu B, Ge X P, et al. Effects of dietary inositol on immune function of juvenile Wuchang bream under ammonia stress [J]. Journal of Fisheries of China, 2014, 38(2): 228-236.
[64] 梁健. α-酮戊二酸对草鱼氨氮胁迫的缓解作用研究 [D]. 长沙: 湖南农业大学, 2014. Liang J. Studies of α-ketoglutarate on alleviating ammonia nitrogen stress of Ctenopharyngodon idellus [D]. Changsha: Hunan Agricultural University, 2014.
[65] 高珊, 余涛, 周景祥, 等. 鱼类白介素及其受体的研究 [J]. 水产学杂志, 2014, 27(3): 62-64. doi: 10.3969/j.issn.1005-3832.2014.03.014 Gao S, Yu T, Zhou J X, et al. A review of interleukin and receptors in fish [J]. Chinese Journal of Fisheries, 2014, 27(3): 62-64. doi: 10.3969/j.issn.1005-3832.2014.03.014
[66] Sigh J, Lindenstrøm T, Buchmann K. Expression of pro-inflammatory cytokines in rainbow trout (Oncorhynchus mykiss) during an infection with Ichthyophthirius multifiliis [J]. Fish & Shellfish Immunology, 2004, 17(1): 75-86.
[67] Zambon C F, Basso D, Navaglia F, et al. Pro-and anti-inflammatory cytokines gene polymorphisms and Helicobacter pylori infection: interactions influence outcome [J]. Cytokine, 2005, 29(4): 141-152. doi: 10.1016/j.cyto.2004.10.013
[68] Illi J, Miaskowski C, Cooper B, et al. Association between pro-and anti-inflammatory cytokine genes and a symptom cluster of pain, fatigue, sleep disturbance, and depression [J]. Cytokine, 2012, 58(3): 437-447. doi: 10.1016/j.cyto.2012.02.015
[69] Qi X Z, Xue M Y, Yang S B, et al. Ammonia exposure alters the expression of immune-related and antioxidant enzymes-related genes and the gut microbial community of crucian carp (Carassius auratus) [J]. Fish & Shellfish Immunology, 2017(70): 485-492.
[70] Cheng C H, Yang F F, Ling R Z, et al. Effects of ammonia exposure on apoptosis, oxidative stress and immune response in pufferfish (Takifugu obscurus) [J]. Aquatic Toxicology, 2015(164): 61-71. doi: 10.1016/j.aquatox.2015.04.004
[71] 刘雨, 丁炜东, 曹哲明, 等. 急性氨氮胁迫对翘嘴鳜幼鱼抗氧化酶活性及炎症反应相关基因表达的影响 [J]. 南方农业学报, 2019, 50(8): 1860-1868. doi: 10.3969/j.issn.2095-1191.2019.08.29 Liu Y, Ding W D, Cao Z M, et al. Effects of acute ammonia nitrogen stress on antioxidant enzymes activity and gene expression involved in inflammation of juvenile Siniperca chuatsi [J]. Journal of Southern Agriculture, 2019, 50(8): 1860-1868. doi: 10.3969/j.issn.2095-1191.2019.08.29
[72] 李冰, 张木子, 黎明, 等. 急性氨氮毒性对黄颡鱼头肾巨噬细胞抗氧化及炎症相关基因表达的影响 [J]. 水产学报, 2018, 42(12): 1889-1895. Li B, Zhang M Z, Li M, et al. Effect of acute ammonia toxicity on genes involved in antioxidant and inflammation in head kidney macrophage of Pelteobagrus fulvidraco [J]. Journal of Fisheries of China, 2018, 42(12): 1889-1895.
-
期刊类型引用(11)
1. 朱庭耀,李冬春,向坤,梁超,朋泽群,赵建,郭建林,叶章颖. 流速对鱼类的影响及其在循环水养殖中的应用. 水生生物学报. 2025(01): 211-221 .  本站查看
本站查看
2. 楚天舒,赖世宣,杨行,赵智强,郭青霞. 基于地表水目标水质的畜禽粪便水环境承载力估算. 中国农业大学学报. 2024(01): 146-156 .  百度学术
百度学术
3. 蒋文枰,程顺,刘士力,郑建波,迟美丽,杭小英,彭苗,李飞. 翘嘴鲌及翘嘴鲌“全雌1号”氨氮胁迫下的生理应答反应及耐受性分析. 四川农业大学学报. 2024(01): 134-139 .  百度学术
百度学术
4. 田海军,姜汉军,杨铁柱,刘加慧. 十二烷基苯磺酸钠对黄颡鱼免疫相关酶活性的影响. 水产学杂志. 2024(02): 55-60 .  百度学术
百度学术
5. 郭红会,王勋伟,葛恒,王羽慧,李怡雯,李欣月,邹桂伟,梁宏伟,李莉. 皮质醇(COR)介导的氨氮抑制团头鲂免疫功能. 淡水渔业. 2024(03): 60-68 .  百度学术
百度学术
6. 朱俊鹏,陆根海,施永海,李雪松,曹祥德,李二超. 氨氮和亚硝酸盐氮对美洲鲥幼鱼的急性胁迫研究. 水产养殖. 2024(06): 24-29 .  百度学术
百度学术
7. 李建平,胡强,夏英,张桂元,湛栋,李永吉. 氨氮胁迫对两种泥鳅急性毒性及抗氧化功能的影响. 渔业研究. 2024(03): 254-259 .  百度学术
百度学术
8. 李梦娇,王倩,张婷,任金亮,王志远,赵蔚蓝,王恒杰,王灿莉,袁向阳. 氨氮胁迫对团头鲂生长、抗氧化和免疫的影响. 水产科学. 2024(04): 640-647 .  百度学术
百度学术
9. 胡雅菲,贾欣,耿志远,陈晨,张月,刘少贞,宋晶. 氨氮对幼鲫鳃组织及其非特异性免疫指标的影响. 淡水渔业. 2024(05): 59-68 .  百度学术
百度学术
10. 聂丽玲,杨占虎,张卿,鲍瑞峰,朱传坤,李礼,朱晓鸣,辛未,张磊. 低浓度氨氮预适应后高氨氮暴露对黄颡鱼鳃组织结构、免疫指标及相关基因的影响. 水生生物学报. 2024(11): 1812-1821 .  本站查看
本站查看
11. 刘可欣,林旺,罗惠敏,罗玥,林诗婷,张运生,杨品红. 氨氮胁迫对青鲫幼鱼急性毒性和抗氧化功能的影响. 湖南文理学院学报(自然科学版). 2023(02): 57-61+87 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载: